Введение
Апоптоз – один из видов программируемой клеточной гибели - играет двоякую роль в образовании, росте опухолей и их ответе на противоопухолевое лечение. С одной стороны, известно, что эффект противоопухолевых терапевтических воздействий реализуется путем запуска ПКГ, и в частности апоптоза [6].Сдругойстороны,существуютданные, свидетельствующиеотом, чторазвитиеиростопухолейтакжесопровождаютсяувеличениемуровняапоптоза[2; 3;5;8-10]. Вработе[4] показано, что апоптоз, индуцированный лучевой терапией, может стимулировать восстановление популяции опухолевых клеток как invitro, так и invivo за счет усиления синтеза простагландина Е, который, в свою очередь, стимулирует рост опухолевых клеток.
Все это указывает на важность изучения роли апоптоза в биологии опухолевого роста иреализации эффектов противоопухолевых воздействий.
Ключевым ферментом апоптоза является каспаза-3.В ИНБИ им.А.Н.Баха РАН разрабатываются генетически кодируемые сенсоры для прижизненной визуализации активности каспазы-3. Ранее был разработансенсор каспазной активности, представляющий собой FRET-пару цветных белков TagRFPиKFP, связанных между собой линкером. В результате разрезания линкера каспазой-3 нарушаются условия FRET,и флуоресценция донора увеличивается [1]. Клетки опухолей человека, трансфицированные данной генно-инженерной конструкцией,демонстрировали увеличение интенсивности и времени жизни флуоресценции трансфицированных клеток [7].Следующим шагом в работе являлось получение моделей на основе трансфицированных клеток для исследований invivo.
Цель исследования
Целью настоящей работы является характеристика роста и флуоресцентных свойств опухоли А-549, полученной путем имплантации иммунодефицитныммышам опухолевых клеток, трансфецированных конструкцией TR23K.
Материалы и методы
В работе использованы мыши nu/nu, самки, массой 19-21 г, разведения питомника «Пущино».Все исследования на животных проводились в соответствии с национальными требованиями к гуманному обращению с экспериментальными животными.
Животные содержались в специальных модулях при температуре 26°С в клетках, оснащенных HEPA-фильтрами, поддерживающими стерильность внутри клеток.
На протяжении всего эксперимента мыши получали сертифицированный полнорационный корм «Чара» (ЗАО «Ассортимент Агро», Россия) и воду без ограничений.
Опухоли получали путем инокуляции под кожу спины мышей клеток линии А-549 (аденокарцинома легкого человека), трансфицированных конструкцией TRK23K.
Клетки поддерживали в логарифмической фазе роста путем пассированиякультуры через 2-3 дня в соотношении 1:3 или 1:4.
Для получения прививочного материала клетки, выращенные в вентилируемых культуральных флаконах (CorningCostar, США), обрабатывали смесью трипсин-ЭДТА, отмывали в растворе DPBS(«ПанЭко», Россия), центрифугировали 5 минут при 1000 об/мин, ресуспендировали в растворе DPBS до состояния клеточной суспензии, состоящей из одиночных клеток. Количество жизнеспособных клеток в суспензии определяли по окрашиванию трипановым синим с последующим подсчетом в камере Горяева. Создавали «концентрацию» клеток 20 млн/мл и прививали мышам в объеме 0,05 мл. Прививочная доза составляла таким образом – 1 млн клеток.
День прививки считали нулевым днем роста опухоли.
Опухолиизмеряли2-3 раза в неделюштангенциркулем и затем рассчитывали размер по формуле: Vопухоли= π/6*a*b*c, где a,b,c – длина, ширина и высота опухоли, соответственно. Вклад кожи при этом не учитывался.
Срок наблюдения за животными составил 45дней.
Флуоресцентные исследования проводили методом планарной томографии.
Измерения флуоресценции проводили invivo2-3 раза в неделю. Для этого мышей обездвиживали на растяжках с помощью «дышащего» пластыря Omnifilm или наркотизировали с смесью золетил : рометар в соотношении 1 : 1 в объеме 0,04 мл/мышь. Наркозу животных подвергали не чаще, чем 2 раза в неделю.
Флуоресцентные изображения получали на автоматизированной системе iBox (UVP, США) для анализа изображений лабораторных животныхinvivo. Базовым элементом установки является тёмный бокс с моторизованным лифтом и фильтрами для вырезания диапазона длин волн, требуемого для возбуждения и регистрации флуоресценции. Установка оснащена автоматизированным источником Biolite для эпилюминесценции и охлаждаемойCCD-камерой.
Флуоресценцию возбуждали в диапазонедлин волн 502-547 нм, регистрацию осуществляли в диапазоне 570-640 нм.Анализ изображений проводили с помощью программы ImageJ.При математической обработке флуоресцентных изображений выделяли области опухоли и кожи, определяли среднюю интенсивность флуоресценции и нормировали среднюю интенсивность флуоресценции опухоли на среднюю интенсивность участка кожи.
Результаты
После прививки клеток А-549-TR23Kопухолевые узлы развивались у всех животных(n=10). Латентный период варьировал от 6 до 14дней. У 90%мышей он составлял 6-8 дней.
В течение месяца наблюдался устойчивый рост опухолей (рис.1). Случаев спонтанной регрессии не отмечено.
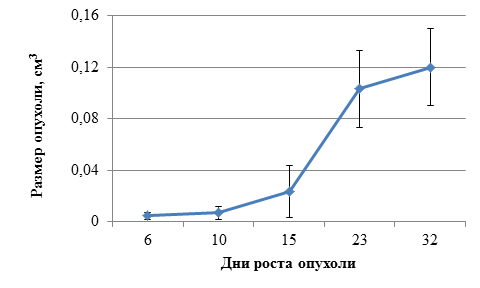
Рис.1. Изменение размеров опухоли А549-TR-23-K в течение срока наблюдения.
Результаты изучения флуоресцентных свойств опухоли А549-TR-23-K представлены на рис.2-4.
6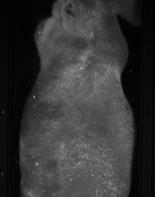 10
10 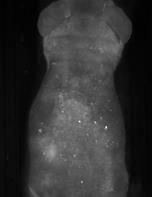 15
15 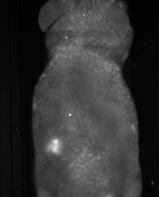 23
23 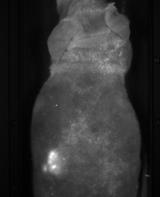
Дни роста опухоли
Рис.2. Флуоресцентные изображения мыши с опухолью А-549-TR23Kвразличные сроки после имплантации опухолевых клеток.
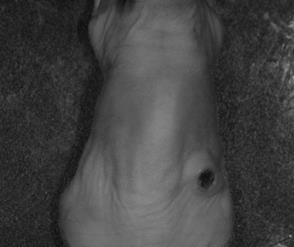
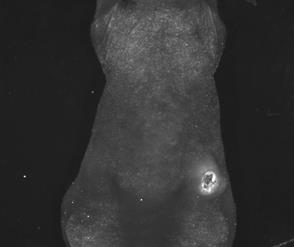
Рис.3. Изображения мыши с опухолью А-549-TR23Kна 38-й день роста опухоли, полученные в белом свете (а) и при возбуждении флуоресценции (б).
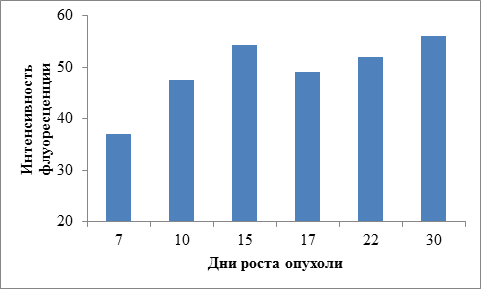
Рис.4. Изменение интенсивности флуоресценции опухоли А-549-TR23Kв процессе ее роста. Представлены данныепо средней интенсивности флуоресценцииопухоли
Как видно из рисунков, распределение флуоресценции по опухоли неравномерно (например, рис.2 в, д). У некоторых мышей в зоне прирастания опухоли к коже образовывался некроз с формированием струпа, который был аранжирован участками более яркой флуоресценции, чем остальная опухоль (рис.3). При этом интенсивность флуоресценции как отдельных участков, так и в среднем по опухоли возрастала по мере ее роста (рис.4).
Увеличение интенсивности флуоресценции в опухоли по мере ее роста может быть вызвано различными причинами, напримерза счет увеличения количества флуоресцирующих опухолевых клеток.Кроме того, как описано в работе [8], при прогрессировании злокачественных новообразований в опухолевых клетках может возрастать активность каспазы-3. Если увеличение активности этого фермента происходит и в опухоли А-549-TR23K, то это может приводить к расщеплению субстрата каспазы-3 TR23K и, следовательно, к увеличению интенсивности люминесценции опухолевого очага в целом. В пользу этого предположения свидетельствуют данные о яркой флуоресценции в зоне распада опухоли (рис.3). По мере роста в клетках может увеличиваться синтез флуорофора или происходить «разбалансировка» экспрессии пары цветных белков, и, например,можетэкспрессироватьсясвободныйTagRFP, который, как указано выше, люминесцирует ярче, находясь в свободном состоянии, чем при связывании с KFP. Можно выдвинуть еще ряд предположений, но все они, как и высказанные выше, нуждаются в экспериментальной проверке.
Таким образом, природа изменения флуоресценции требует детального изучения. Информация об условиях эффективного действия сенсора, в частности потенциального влияния на него спонтанного апоптозатрансдуцированных опухолевых клеток, необходима при последующем тестировании новых противоопухолевых средств, изучении апоптотического статуса экспериментальных опухолей и его влияния на эффективность противоопухолевых воздействий.
Работа выполнена при финансовой поддержке Министерства образования и науки по государственному контракту № 14.512.11.0023.
Рецензенты:
Королева О.В., д.б.н., зав. лабораторией молекулярных основ биотрансформаций Института биохимии им. А.Н. Баха РАН, г.Москва.
Шишкин С.С., д.б.н., профессор, зав. лабораторией биомедицинских исследований Института биохимии им. А.Н. Баха РАН, г.Москва.
Библиографическая ссылка
Казачкина Н.И., Жердева В.В., Меерович И.Г., Савицкий А.П. ХАРАКТЕРИСТИКА МОДЕЛИ ОПУХОЛЕВОГО РОСТА, ПРЕДНАЗНАЧЕННОЙ ДЛЯ ОЦЕНКИ АПОПТОЗА INVIVO // Современные проблемы науки и образования. – 2013. – № 4. ;URL: https://science-education.ru/ru/article/view?id=9772 (дата обращения: 20.04.2024).



