Введение
Интерес исследователей к методу иммуноферментного анализа (ИФА) как методу иммунодиагностики обусловлен его преимуществом перед другими методами экспресс-диагностики и связан с высоким уровнем специфичности, чувствительности, простотой выполнения, исключающей использование радиоактивных меток, громоздкой аппаратуры.
В основу ИФА положено специфическое взаимодействие определяемого вещества с антителами и детекция образовавшегося комплекса антиген-антитело (Аг-Ат) с помощью ферментативной реакции [4] с использованием в качестве фермента для метки пероксидазы хрена марки А, RZ = 2,7, предварительно окисленной до альдегидной формы перйодатом натрия [6].
Пероксидаза хрена, выделенная из корневищ хрена Armoraciarusticana, является гли-копротеином с молекулярной массой около 40 кДа и содержит в качестве кофакторовгем и два иона кальция. Основной отличительной особенностью в структуре пероксидазы хрена по сравнению с другими растительными пероксидазами является наличие участка длиной в 34 аминокислотных остатка между спиралями остатков фенилаланина (F) и глицина G (рисунок 1) . Эта область, которая является частью канала для доступа субстрата.
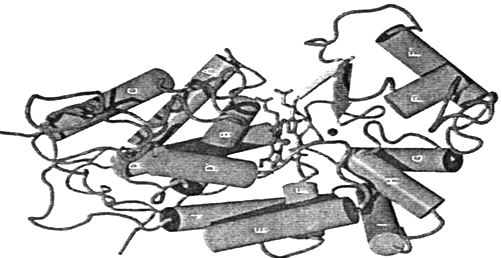
Рисунок 1. Пространственная структура пероксидазы хрена [7]
Известно, что срок годности иммуноферментных конъюгатов ограничен и составляет до 6 месяцев для жидких препаратов и до 12 месяцев для лиофилизированных. Это связано с тем, что ферменты имеют слабожёсткую структуру и подвержены отрицательному влиянию внешних воздействий.
В работах Т. Н. Бородиной с соавторами [1] и Sukhorukov G. B. andetc. [10] пред-ставлены данные по капсулированию биологически активных веществ с использованием перспективной технологии послойной (Layer-by-Layer (LBL)) адсорбции противоположно заряженных полиэлектролитов (ПЭ) на неорганических коллойдных частицах. Д. В. Во-лодькиным с соавторами показано, что включение белков в микрокапсулы возможно мето-дом последовательной адсорбции полиэлектролитов на агрегаты белков [2]. Научный интерес представляет использование технологии LBL адсорбции противоположно заряженных полиэлектролитов на агрегаты белка при капсулировании фермента пероксидазы хрена и иммуноглобулинового коньюга тапероксидазы хрена (КПХ).
Цель исследования: применение метода микрокапсулирования для сохранения активности и стабильностифермента пероксидазы хрена и иммуноферментного конъюгата.
Материалы и методы исследования
При выделении иммуноглобулинов использовали сыворотку диагностическую туляремиийную сухую для реакции агглютинации (РА) производства ФГУЗ «Иркутский государственный научно-исследовательский противочумный институт Сибири и Дальнего Востока» (ОСО 42-28-28-84-01 П). Количественное определение белка проводили на спектрофотометре СФ-26 («ЛОМО», г. Санкт-Петербург) при длине волны 280 нм. Конъюгацию иммуноглобулинов, фракционированных каприловой кислотой [9], с ферментом пероксидазой хрена фирмы «Sigma» проводили методом перйодатного окисления по Р.К. Nakane, А. Kawaоi [8]. Рабочий титр и специфическую активность конъюгатов определяли по методике M. Clark и A. Adams в «сэндвич»-варианте ИФА [5].
Постановку ферментативной реакции проводили по схеме: к 2 мкл раствора перок-сидазы хрена, который готовили растворением 1 мг фермента в 5 мл 0,3 М раствора NаНCO3, добавляли 100 мклсубстрат-индикаторного раствор. В качестве субстрат-индикаторного раствора использовали цитратный буферный раствор (рН = 5,0) в который вносили 20 мкл 3%-ного раствора перекиси водорода и ортофенилендиамин (ОФД) с концентрацией 0,4 мг/мл. Реакцию инкубировали при комнатной температуре в течение 15 минут в темноте. Останавливали реакцию добавлением 50 мкл 4 N раствора Н2SO4. Оптическую плотность окрашенного раствора измеряли на приборе ФЭК- КФК-2 при длине волны 492 нм в кювете с толщиной слоя 10 мм.
Капсулирование пероксидазы хрена должно проводиться в мягких условиях при исключении воздействия внешних факторов, способных влиять на потерю активности фермента. Для этого 10 мг фермента пероксидазы растворяли в 5 мл 0,3 М раствора NaHCO3. К 2 мл данного раствора прибавляли поочередно по 3 мл полиэлектролитов (хитозан / каррагинан) концентрацией 2 мг/мл, количество слоев регулировалось в зависимости от процента включения и времени высвобождения активного вещества из микрокапсул. Полиэлектролиты растворяли в фосфатном буферном растворе рН = 6,9. Сформированные микрокапсулы от несвязавшегося ПЭ отмывали трехкратно бидистиллированной водой объемом 3,5 мл. Капсулированный фермент хранили в виде суспензии микрокапсул в воде при температуре +4°С.
Процесс высвобождения фермента из капсул проводили при перемешивании суспен-зии микрочастиц (концентрация 0,25–0,50 мг/мл) в течение 20 минут в карбонат бикарбо-натном (КББ) буферном растворе рН = 9,5. Концентрацию белка в супернатанте определяли по методу Варбурга и Кристиана [3]. Процент высвобождения фермента из микрочастиц оценивали как отношение содержания белка в супернатанте к содержанию его в микрокапсулах.
Иммуноглобулиновый КПХ включали в микрокапсулы следующим способом: к 0,5 мл иммуноглобулинового коньюгата, растворенного в 0,3 М растворе NaHCO3, прибавляли поочередно, при перемешивании по 1,5 мл полиэлектролитов (хитозан / каррагинан) концентрацией 5 мг/мл. Количество наносимых слоев – 6. Полиэлектролиты растворяли в фосфатном буферном растворе рН 6,9. Сформированные микрокапсулы от несвязавшегося ПЭ отмывали трехкратно бидистиллированной водой объемом 3,5 мл. Капсулированный коньюгат хранили в виде суспензии в дистиллированной воде при температуре +4 °С.
Результаты исследования и их обсуждение
На начальном этапе целесообразно провести капсулирование самого фермента перок-сидазы хрена, оценить процент включения в микрокапсулы и сопоставить активность рас-творимого и капсулированного фермента.
Особенность строения фермента пероксидазы хрена и возможность потери активности фермента при воздействии внешних факторов способствовало выбору метода капсули-рования, который предполагает формирование оболочки последовательным нанесением полиэлектролитов каррагинан / хитозан из раствора на молекулы белка. Полученные данные по включению перксидазы хрена в ПЭ микрокапсулы представлено в таблице 1.
Таблица 1. Иммобилизация фермента пероксидазы хрена в микрокапсулы
|
Количество фермента, взятого для микрокапсулирования, мг |
Количество слоев полиэлектролитов (хитозан/ каррагинан) |
Количество микрокапсулированного фермента, мг |
Процент включения, % |
|
4,00 |
2 |
1,78 |
44,5±0,59 |
|
4 |
1,61 |
40,3±0,47 |
|
|
6 |
1,58 |
39,6±0,40 |
|
|
ts=4,3; Р=0,95 |
|||
После нанесения шестого слоя процент включения фермента составил 39,6 %.
Для сравнительной оценки сохранения активности растворимого и капсулированного фермента оптимизирован состав компонентов ферментативной реакции фермент субстрат (рисунок 2). Выявлено, что оптимум активности растворимого фермента пероксидазы хрена наблюдается при соотношении 0,4 мкг фермента 100 мкг субстрата.
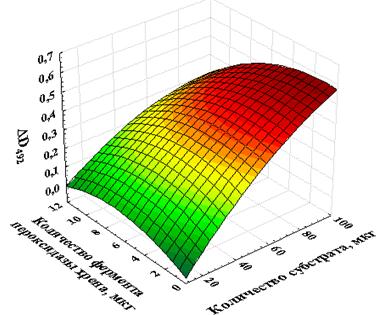
Рисунок 2. Оптимизация количества фермента и субстрата при постановке ферментативной реакции
Процесс высвобождения фермента из микрокапсул сопровождается их полным раз-рушением при рН = 9,5. На спектрофотометре СФ -46 оценивали количество высвободившегося из микрокапсул белка, процент высвобождения составил 100 %. Анализ сохранения активности представлен на рисунке 3.
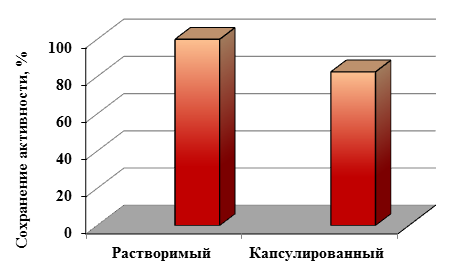
Рисунок 3. Сохранение активности фермента пероксидазы хрена
Капсулированный фермент сохранял 82,5% активности.
Полученные результаты дают нам право продолжить работу по капсулированию им-муноглобулинового коньюгата, с целью увеличения срока действия и сохранения активности дорогостоящего препарата. Капсулирование коньюгата проводили последовательным нанесением полиэлектролитов на агрегаты белка. Оболочку капсул формировали из шести слоев ПЭ: трех хитозана и трех каррагинана, начиная с хитозана. Процент включения коньюгата в микрокапсулы составил 23,6 %.
Постановку иммуноферментного анализа с использованием капсулированного коньюгата проводили на полистироловых планшетах. Коньюгат извлекали из микрокапсул добавлением 3,5 мл карбонат бикарбонатного (КББ) буферного раствора рН = 9,5 к суспензии микрочастиц (концентрация 0,25–0,50 мг/мл) при перемешивании в течение 20 минут при температуре 18–22 °С.
Рабочий титр и специфическую активность КПХ определяли по методике M. Clark и A. Adams [5] в «сэндвич»-варианте ИФА. Учет результатов проводили на фотометре «Multiskan FC» (Финляндия).
При постановке ИФА использовали стандартные планшеты для иммунологических реакций отечественного и импортного производства. Для первого покрытия планшетов применяли иммуноглобулины (IgG), фракционированные каприловой кислотой [9] из туляремийной гипериммунной сыворотки. В лунки вносили по 100 мклIgG, разведенных фосфатно-солевым буферным раствором (ФСБ) с рН = 7,4±0,02 до концентрации белка 100 мкг/мл. Сенсибилизацию планшетов производили при температуре 37 °С в течение 3 часов. Несорбированные IgG удаляли, лунки отмывали два раза 0,05 %-ым раствором твин-20 на фосфатно-солевом буферном растворе. Раствор из лунок удаляли энергичным встряхиванием, так чтобы в лунках не осталось жидкости. Затем в первую лунку вносили туляремийный полигрупповой водорастворимый антиген в концентрации 0,1 мг/мл и титровали в шахматном порядке на 0,1М ФСБ рН = 7,2, содержащем 0,05 %-ый раствор твин – 20 и 0,1%-ый раствор бычьего сывороточного альбумина (БСА), 12-я лунка не содержала антигена и являлась контрольной. После часовой инкубации при 37 °С из планшета удаляли несвязавшийся антиген, микроплаты отмывали два раза 0,05 %-ым раствором твин-20 на ФСБ и подсушивали. Далее в течение 1 ч при температуре 37 °С проводили инкубацию с антителами, меченными пероксидазой хрена в разведениях от 1:100 до 1:800. КПХ вносили в лунки в объеме 100 мкл и инкубировали 1 часпри 37 °С. После шестикратной промывки планшета производили определение присутствия антигена в присутствии субстрат-индикаторного раствора. Субстрат-индикаторную смесь добавляли по 100 мкл во все лунки и инкубировали при комнатной температуре без доступа света в течение 10 мин. Для остановки реакции использовали 4N раствор серной кислоты, который вносили в лунки объемом 50 мкл. Результаты реакции учитывали визуально и на регистрирующем спектрофотометре «Multiskan» при длине волны 492 нм путем определения оптической плотности проб, находящихся в лунках планшета. Результаты считали положительными, если оптическая плотность (ОП) исследуемого образца в два и более раза превосходила среднее значение ОП отрицательных контролей (таблица 2).
Таблица 2. Результаты контроля чувствительности и специфичности с использованием микрокапсулированного коньюгата в ИФА в сравнении с традиционным методом ИФА
|
Метод ИФА |
Вид микроорганизма |
||||||||
|
F.tularensis |
|||||||||
|
Концентрация м.к. в пробе |
|||||||||
|
1,25×107 |
6,12×106 |
3×106 |
1,5×106 |
7,5×105 |
3,7×105 |
2×105 |
1×105 |
Контроль |
|
|
Показатель оптической плотности: опыт/отрицательный контроль |
|||||||||
|
Микрокапсулированный коньюгат |
1,081 |
0,969 |
0,860 |
0,721 |
0,693 |
0,532 |
0,411 |
0,214 |
0,121 |
|
Традиционный |
1,395 |
1,266 |
1,181 |
1,227 |
0,839 |
0,687 |
0,476 |
0,290 |
0,153 |
|
|
B.abortus |
||||||||
|
Микрокапсулированный коньюгат |
0,199 |
0,184 |
0,152 |
0,134 |
0,123 |
0,112 |
0,110 |
0,103 |
0,102 |
|
Традиционный |
0,202 |
0,198 |
0,167 |
0,151 |
0,141 |
0,132 |
0,129 |
0,122 |
0,123 |
Из данной таблицы следует, что чувствительность ИФА при использовании микро-капсулированного коньюгата и традиционного совпадает и составляет 2×10 5 м.к./мл при отсутствии перекрестных реакций с гетерологичным штаммом B.abortus.
Заключение
Таким образом, получены капсулированные препараты пероксидазы хрена и имму-ноглобулировых коньюгатов методом последовательной адсорбции полиэлектролитов на агрегаты белка. Процент включения пероксидазы хрена и иммуноглобулирового коньюгата составил 39,6 % и 23,6 % соответственно. При этом капсулированный фермент сохранял 82,5 % активности. Результаты ИФА свидетельствуют о том, что чувствительность метода при использовании микрокапсулированного коньюгата и традиционного совпадает и составляет 2×10 5 м.к./мл, при этом не наблюдается перекрестных реакций с гетерологичным штаммом B.abortus. В дальнейшем это позволит рассмотреть вопрос получения тест-систем для диагностики особо опасных и других инфекций с использованием микрокапсулированного иммуноглобулинового коньюгата.
Рецензенты:
Орлова Ирина Георгиевна, доктор биологических наук, старший научный сотрудник по специальности, профессор кафедры медицинской биохимии, клинической лабораторной диагностики и фармации ФГАОУ ВПО «Северо-Кавказский федеральный университет», г. Ставрополь.
Тимченко Людмила Дмитриевна, доктор ветеринарных наук, профессор, заведующийпроблемной научно-исследовательской лаборатории «Экспериментальной иммуноморфологии, иммунопатологии и иммунобиотехнологии» ФГАОУ ВПО «Северо-Кавказский федеральный университет», г. Ставрополь.
Библиографическая ссылка
Ковалькова М.В., Воробьева О.В., Аванесян С.С., Филиппова А.М., Жарникова И.В. КАПСУЛИРОВАНИЕ ПЕРОКСИДАЗЫ ХРЕНА И ИММУНОФЕРМЕНТНОГО КОНЪЮГАТА С ЦЕЛЬЮ ИСПОЛЬЗОВАНИЯ ЕГО В ИММУНОФЕРМЕНТНОМ АНАЛИЗЕ // Современные проблемы науки и образования. – 2013. – № 1. ;URL: https://science-education.ru/ru/article/view?id=8368 (дата обращения: 19.04.2024).



