Производные пиридина представляют собой важный класс гетероциклических соединений, представители которых проявляют высокую биологическую активность [1]. Ряд медицинских препаратов содержит в своем составе кольцо пиридина, которое является фармакофорной группой [1].
В лаборатории халькогенорганических соединений Иркутского института химии имени А. Е. Фаворского СО РАН проводятся систематические исследования по разработке эффективных подходов к новым халькогенорганическим соединениям с потенциальной биологической активностью [2-9]. Следует отметить, что селен и сера представляют собой важные составляющие белков и ферментов. Селен является важным микроэлементом, недостаток которого в организме человека увеличивает вероятность возникновения сердечно-сосудистых и опухолевых заболеваний, инсульта, артрита, кариеса и многих других наиболее распространенных патологий [10]. Ряд селеноорганических соединений обладает высокой биологической активностью, в том числе глутатионпероксидазаподобным действием. Селенсодержащие ферменты являются катализаторами реакций восстановления глутатионом перекисных соединений, которые, как известно, нарушают клеточные мембраны в организме человека и вызывают преждевременное старение клеток, провоцируя многие распространенные заболевания [10].
В результате исследований разработаны эффективные подходы к получению винильных производных серы, селена и теллура на основе элементных халькогенов и нуклеофильного присоединения к ацетилену халькогенсодержащих анионов, генерированных в основно-восстановительных системах [2-9].
В настоящем сообщении обсуждены результаты, полученные при исследовании реакций халькогенов с ацетиленом и 2-бромпиридином в основно-восстановительных системах.
Целью исследования является разработка эффективных методов синтеза 2-винилтелланилпиридина, 2-винилселанилпиридина и 2-винилсульфанилпиридина - новых полупродуктов и синтонов для органического синтеза, перспективных для получения органических соединений с потенциальной биологической активностью.
Материалы и методы исследования
Реакции проводили в автоклаве под давлением ацетилена 10-14 атм при нагревании реагентов при температуре 100-140 °С в системах КОН/восстановитель/апротонный биполярный растворитель/вода.
Спектры ЯМР 1Н и 13С регистрировали на приборе Bruker DPX-400 (рабочие частоты 400.13, и 100.61 МГц, соответственно) в CCl4, внутренний стандарт - ГМДС. Элементный анализ выполнен на приборе Thermo Finigan EA 1112.
Синтез 2-винилсульфурилпиридина. Типичная методика
Смесь 2-бромпиридина (4.2 г, 0.027 моль), элементной серы (1.54 г, 0.048 моль), КОН (4.0 г), гидразингидраты (5 мл) и ГМФТА (50 мл) нагревали в 1-литровой вращающемся автоклаве в течение 5 часов при температуре 130-140 °С. На следующий день в смесь добавили КОН (8.0 г), воду (8 мл) и гидразингидрат (5 мл) и нагревали под давлением ацетилена (12-14 атм) в течение 5 часов при температуре 130-140 °С. На следующий день реакционную смесь разбавили в 4 раза водой и экстрагировали этилацетатом (5 х 20 мл). Экстракт промыли 2 раза водой, высушили над безводным сульфатом натрия и отогнали растворитель в вакууме. Целевой 2-винилсульфурилпиридин (1.71 г, выход 47 %) выделен колоночной хроматографией (элюент: хлороформ/гексан 3:1). Соединение представляет собой маслянистую жидкость светло-жёлтого цвета с характерным запахом.
Результаты и обсуждение
Разработаны методы синтеза ранее неизвестных 2-винилсульфанилпиридина (1), 2-винилселанилпиридина (2) и 2-винилтелланилпиридина (3) с выходами 47-62 % в одну стадию из 2-бромпиридина, ацетилена и элементных халькогенов. Реакции проводили в автоклаве под давлением ацетилена 10-14 атм при нагревании реагентов при температуре 100-140°С в системе КОН/гидразингидрат/гексаметилфосфортриамид (диметилсульфоксид)/ вода (схема 1).
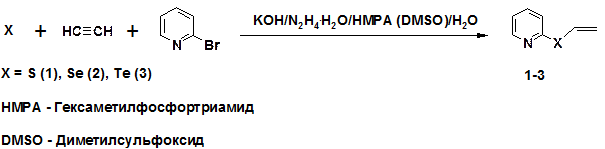
Схема 1
Путь реакции включает генерацию дихалькогенид-анионов из элементных халькогенов под действием гидразингидрата и КОН и нуклеофильное замещение брома в 2-бромпиридине под действием дихалькогенид-анионов (схема 2). Образующиеся бис(2-пиридил)дихалькогениды (4-6) под действием гидразингидрата и КОН восстанавливаются до 2-пиридилхалькогенолат-анионов (7-9), присоединение которых к ацетилену дает 2-винилхалькогенилпиридины.
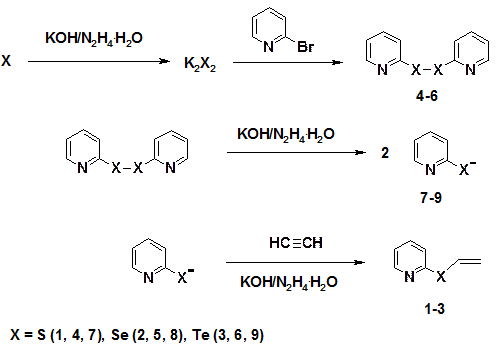
Схема 2
Такой путь реакции подтвержден экспериментально (схема 3). Использование бис(2-пиридил)дихалькогенидов (4-6) в реакции с ацетиленом в системе КОН/ДМСО/гидразингидрат приводит к 2-винилхалькогенилпиридинам (1-3). На основе этой реакции разработаны эффективные способы получения 2-винилсульфанилпиридина (выход 80%), 2-винилселанилпиридина (выход 91%) и 2-винилтелланилпиридина (выход 94 %) (схема 3).
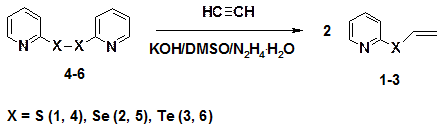
Схема 3
Исходные бис(2-пиридил)дихалькогениды (4-6) получены с высоким выходом из 2-бромпиридина и элементных халькогенов (схема 4). Путь реакции включает генерацию дихалькогенид-анионов из элементных халькогенов под действием гидразингидрата и КОН и нуклеофильное замещение брома в 2-бромпиридине под действием дихалькогенид-анионов.
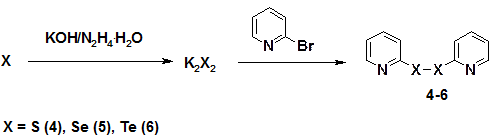
Схема 4
Строение синтезированных соединений надежно доказано методами ЯМР 1Н и 13С, масс-спектрометрии и подтверждено данными элементного анализа. В масс-спектрах проявляются молекулярные ионы 137, 185 (Se80) и 235 (Te130), соответствующие соединениям 1, 2 и 3. Спектральные характеристики соединений 1-3 объединены в таблице 1. Выходы и данные элементного анализа соединений 1-3 представлены в таблице 2.
Таблица 1. Спектральные характеристики соединений 1-3
|
Соединение |
Спектр ЯМР 1Н, δ м. д. |
Спектр ЯМР 13С, δ м. д. |
|
1 |
5.49 д (1H, =CH2, 3J = 10.0 Гц), 5.54 д (1H, =CH2, 3J = 17.4 Гц), 6.51 дд (1H, SCH=,3J = 10.0 Гц, 3J = 17.4 Гц), 7.02 м (1H, Py), 7.17 м (1H, Py), 7.52 м (1H, Py), 8.46 м (1H, Py) |
114.8 (=CH2), 119.5 (Py), 121.6 (Py), 128.4 (SCH=), 135.7 (Py), 149.5 (Py), 156.7 (Py) |
|
2 |
5.86 д (1H, =CH2, 3J = 9.8 Гц), 5.70 д (1H, =CH2, 3J = 17.5 Гц), 7.0 дд (1H, SeCH=, 3J = 9.8 Гц, 3J = 17.5 Гц), 7.25-7.45 м (3H, Py), 8.42 м (1H, Py) |
118.9 (=CH2), 119.7 (Py), 124.1 (SeCH), 125.9 (Py), 127.8 (Py), 135.2 (Py), 149.5 (Py) |
|
3 |
6.09 д (1Н, =CH2, 3J = 17.9 Гц), 6.53 д (1Н, =CH2, 3J = 10.2 Гц), 7.04 м (1Н, Py), 7.35-7.49 м (3Н, Py, TeCH=), 8.49 м (1Н, Py) |
95.6 (ТeCH=), 111.6 (=CH2), 121.5 (Py), 130.9 (Py), 135.9 (Py), 144.1 (Py), 151.3 (Py)
|
Таблица 2. Выходы и данные элементного анализа соединений 1-3
|
Соеди-нение |
Вы-ход, % |
Найдено, % |
Брутто-формула |
Вычислено, % |
|
1 |
80 |
C 60.86, H 5.34, N 10.68, S 22.98 |
C7H7NS |
C 61.28, H 5.14, N 10.21, S 23.37 |
|
2 |
91 |
C 45.97, H 4.01, N 7.42, Se 43.12 |
C7H7NSe |
C 45.67, H 3.83, N 7.61, Se 42.89 |
|
3 |
94 |
С 35.92, Н 3.02, N 5.91, Te 55.28 |
C7H7NTe |
С 36.13, Н 3.03, N 6.02, Te 54.83 |
В ПМР спектрах соединений 1-3 винилхалькогеногруппы проявляются двумя дублетами протонов =СН2-групп и дублетами дублетов протонов =СНХ-групп, связанных с атомом халькогена. Сигналы протонов =СНХ-групп, связанных с атомом халькогена, смещаются в сторону слабого поля (в сторону увеличения химических сдвигов) в ряду халькогенов: сера, селен, теллур.
Соединения 1-3 выделены колоночной хроматографией (элюент: хлороформ/гексан 3:1). Они представляют собой маслянистые жидкости светло-жёлтого цвета с характерным запахом.
Выводы
На основе элементных халькогенов, 2-бромпиридина и ацетилена разработаны эффективные методы синтеза 2-винилтелланилпиридина, 2-винилселанилпиридина и 2-винилсульфанилпиридина - новых полупродуктов для органического синтеза, перспективных для получения соединений с потенциальной биологической активностью.
Работа выполнена в рамках программы фундаментальных исследований Отделения химии и наук о материалах РАН и при финансовой поддержке РФФИ (проект № 12-03-01098).
Рецензенты:
- Ларина Л. И., д.х.н., ведущий научный сотрудник ИрИХ СО РАН, г. Иркутск.
- Мартынов А. В., д.х.н., ведущий научный сотрудник ИрИХ СО РАН, г. Иркутск.
Библиографическая ссылка
Малинович Д.А. ЭФФЕКТИВНЫЕ МЕТОДЫ СИНТЕЗА 2-ВИНИЛТЕЛЛАНИЛ-, –СЕЛАНИЛ– И –СУЛЬФАНИЛПИРИДИНОВ НА ОСНОВЕ ЭЛЕМЕНТНЫХ ХАЛЬКОГЕНОВ, 2-БРОМПИРИДИНА И АЦЕТИЛЕНА // Современные проблемы науки и образования. – 2012. – № 5. ;URL: https://science-education.ru/ru/article/view?id=7205 (дата обращения: 16.04.2024).



