Материал и методы
В отделении хирургии артериальной патологии Научного Центра сердечно-сосудистой хирургии им. А. Н. Бакулева РАМН с 2000 года было прооперировано 12 пациентов с послеоперационными инфицированными аневризмами дистального отдела дуги и нисходящего отдела грудной аорты. Виды первичных операций приведены в таблице 1.
Таблица 1 Виды первичных операций
|
Вид операций |
Число больных |
|
Истмопластика синтетической заплатой |
2 |
|
Истмопластика с подключичной артерией |
3 |
|
Линейное протезирование аорты |
6 |
|
Эндопротезирование |
1 |
Из симптомов чаще всего отмечались: повышение температуры тела (12 больных), боли в груди (9), в межлопаточной области (3), одышка (12), кашель (10), боли в области сердца (2), сердцебиение (6). В единичных случаях наблюдались симптомы, обусловленные сдавлением соседних органов и структур: осиплость голоса у 2 больных, в связи со сдавлением возвратного нерва, затрудненное глотание и загрудинные боли за счет сдавления пищевода.
Следует отметить, что успех хирургического лечения послеоперационных инфицированных аневризм нисходящей грудной аорты в значительной мере зависел от точности дооперационной диагностики.
На предварительном этапе диагностики при клинических проявлениях послеоперационных аневризм нисходящей грудной аорты проводили рентгенологическое исследование. Далее методами диагностики больных с ложными послеоперационными аневризмами нисходящего отдела грудной аорты являлись: компьютерная томография (12 пациентов), трансторакальная (12) и чреспищеводная эхокардиография (8), используемая как до, так и интраоперационно, и рентгеноконтрастная ангиография (5).
Наличие инфицированной послеоперационной аневризмы нисходящего отдела грудной аорты является абсолютным показанием к операции. Консервативная терапия даже самыми современными антибактериальными средствами при сохранении инфицированного инородного материала бесперспективна.
У всех пациентов оперативное вмешательство проводилось двухэтапно. Вначале доступом по 4 межреберью справа выполнялась торакотомия. Во всех случаях со значительными техническими трудностями, из-за выраженного перипроцесса, выделялись нисходящий отдел грудной аорты и восходящая аорта. Боковым отжатием формировалось окно в восходящей аорте, и накладывался проксимальный анастомоз. После проверки анастомоза на герметичность протез проводили кпереди от корня легкого, и накладывался дистальный анастомоз с нисходящим отделом грудной аорты, дренирование, ушивание торакотомии. Затем вторым этапом больного переворачивали на правый бок. Выделяли общую бедренную артерию и вену для подключения к аппарату искусственного кровообращения. В связи с высоким риском кровотечения на этапе выделения инфицированного протеза вспомогательное ИК начинали заблаговременно в режиме параллельной перфузии. Выполнялась торакотомия обычно по 5 межреберью слева. Также во всех 12 случаях в спаечном инфильтрате выделяли левую подключичную артерию, левую общую сонную артерию и дугу аорты, проксимальнее левой общей сонной артерии, нисходящий отдел аорты выше наложенного анастомоза. Инфицированный протез иссекался полностью с максимально возможным объемом измененных окружающих тканей. Аорта пересекалась и прошивалась в нисходящем отделе проксимально и дистально в местах неизмененной или малоизмененной стенки. Операция заканчивалась типично.
В послеоперационном периоде проводилась массивная детоксикационная, антибактериальная и иммунокоррегирующая терапия. Смертность при повторных вмешательствах составила 2 пациента: 1 больной скончался от гнойно-септических осложнений в ближайшем послеоперационном периоде, в другом случае смерть была обусловлена острой сердечно-сосудистой недостаточностью на фоне массивной кровопотери. Остальные больные были выписаны из стационара после операции в удовлетворительном состоянии, c улучшением показателей клинического анализа крови, нормализацией температуры тела.
Клинический пример
Пациент Б., 53 лет, поступил в отделение хирургического лечения артериальной патологии НЦССХ им А. Н. Бакулева РАМН 12.05.2004 года с жалобами на боли в левой половине грудной клетки, преимущественно в лопаточной области, одышку при минимальных физических нагрузках, подъемы температуры тела в вечерние часы до 38,5- 39,5 °С, общую слабость.
В июле 2003 года получил травму грудной клетки (падение с высоты). В ноябре - январе 2003 года находился на лечении в госпитале по месту жительства, где при РКТ органов грудной клетки диагностирована частично тромбированная аневризма нисходящего отдела грудной аорты. Также выявлен воспалительный процесс в области аневризмы с вовлечением 8-го грудного позвонка. 23.12.03 г. произведено эндопротезирование грудного отдела аорты. В связи с продолжающейся гипертермией, астенизацией пациента, нарастанием болей в грудной клетке больной был переведен в НЦССХ имени А. Н. Бакулева
При поступлении: кожные покровы бледно-серого цвета, с желтушным оттенком. Температура тела - 37,8 °С.
ЭХО-КГ: дистальнее левой подключичной артерии и до уровня диафрагмы визуализируется стент, d = 25 мм, наружный размер аорты - 41 мм.
РКТ 09.03.04: парааортальное образование в области нисходящей аорты, прилегающее преимущественно к левой стенке нисходящего отдела грудной аорты, диаметром 4,0×5,0 см. Состояние после эндопротезирования.
Аортоангиография 12.03.04: от устья левой подключичной артерии до уровня отхождения висцеральных ветвей стенка аорты покрыта стент-графтом. Стенки протеза ровные, четкие. Затекания контрастного вещества по наружному контуру протеза не отмечено, функция протеза в норме.
Пациент проконсультирован специалистом лаборатории микробиологии и антимикробной терапии, дано заключение о клинико-лабораторных признаках септического состояния (включая положительный прокальцитониновый тест): за 2 недели до оперативного вмешательства назначена антибиотикопрофилактика в виде моксифлоксацина 400 мг 1 раз/сутки, per os и ванкомицина 1,0 г 2 раза/сутки в/в; интраназально - «Бактробан» 2 раза/день.
Окончательный диагноз: травматическая аневризма перешейка грудной аорты. Состояние после операции эндопротезирования нисходящей грудной аорты. Нагноение парааортальной гематомы, парааортальный абсцесс. Инфекция стент-протеза. Сепсис.
Спустя 4 недели после начала антибактериальной терапии пациенту выполнено: аорто-аортальное шунтирование от восходящей к нисходящей грудной аорте, резекция аневризмы, удаление эндопротеза, санация парааортального абсцесса, иссечение нисходящей грудной аорты в условиях вспомогательного ИК (рис. 1). Из правосторонней торакотомии произведено экстраанатомическое аорто-аортальное шунтирование от восходящей к нисходящей грудной аорте эксплантатом «Басэкс» 18 мм, с проведением протеза кпереди от корня легкого. После закрытия торакотомии справа больной переложен на правый бок и произведена торакотомия слева по 4 межреберью. После выделения из выраженного перипроцесса дуги аорты проксимальнее отхождения левой подключичной артерии и грудной аорты, дистальнее аневризмы, аневризма вскрыта, и удален эндопротез. Многократная санация полости аневризмы, окружающих тканей. Аорта ушита двухрядным швом проксимальнее и дистальнее аневризмы. Стенки аневризмы максимально иссечены. Типичное завершение операции. Заживление ран первичным натяжением. Выписан из стационара на 18-е сутки после операции в удовлетворительном состоянии, раны зажили первичным натяжением, признаков сепсиса нет.
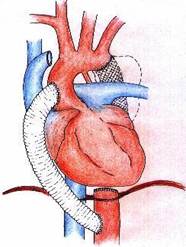
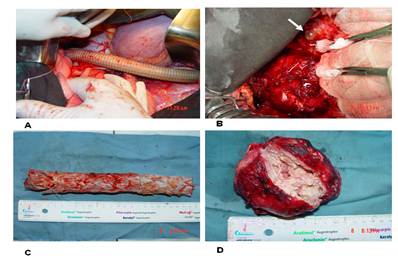
Рисунок 1. Схема операции и интраоперационные фото этапов оперативного лечения: А -аорто-аортальный шунт, В - аневризма нисходящего отдела грудной аорты, С - удаленный эндопротез, D - аневризматическая чаша с инфицмрованным распадающимся содержимым
Обсуждение
Изучение результатов хирургического лечения заболеваний нисходящего отдела грудной аорты показало, что в отдаленные сроки после операции у части больных развиваются ложные, часто инфицированные аневризмы в зоне анастомозов, что является одной из сложнейших проблем современной сердечно-сосудистой хирургии [1]. Следует отметить, что в большинстве случаев послеоперационные аневризмы являются ложными, что характеризуется образованием патологической полости вокруг аорты (аневризматический мешок), образовавшийся путем организации околососудистой гематомы, сообщающейся с просветом артерии [2, 6]. Большинство авторов считают, что причина возникновения ложных аневризм в разном сопротивлении дегенеративно измененной стенки аорты и протеза, что, в первую очередь, отражается на состоянии анастомоза [3, 7, 8]. Несмотря на то, что пульсовое напряжение одинаково распространяется по линии швов и окружности протеза, дегенеративные изменения в области анастомозов, дистрофия внутренней капсулы протеза, косое направление кровотока в области проксимального анастомоза являются предрасполагающими факторами к развитию ложных аневризм.
Однако раннее развитие аневризм (до 40 мес.) чаще связывают с инфицированием протеза. Выделяют следующие факторы, повышающие риск инфицирования сосудистого протеза:
- операции в порядке срочной помощи;
- наличие несанированных очагов инфекции (в т.ч. 4 стадия заболевания у больных с облитетрирующими заболеваниями артерий);
- длительное время операции (более 4 часов);
- повторные вмешательства;
- нарушение правил асептики и антисептики;
- длительное пребывание в стационаре;
- наличие поверхностной инфекции в ране;
- симультантные вмешательства на желудочно-кишечном тракте.
К сопутствующим заболеваниям, способствующим развитию инфекционных осложнений, относят сахарный диабет, онкопатологию, иммунодефицитные состояния, хроническую почечную недостаточность, прием кортикостероидов, химиотерапию и др. Таким образом, более 90 % пациентов имеют 1 и более предрасполагающий фактор для развития инфекции протеза.
Эволюция концепции борьбы с инфекцией протеза за последние 40 лет, основанная, прежде всего, на клиническом опыте и лабораторных исследованиях, привела к выработке основных принципов лечения [1, 10]:
- Удаление инфицированного протеза.
- Полное хирургическое удаление омертвевших и инфицированных тканей для обеспечения заживления раны.
- Сохранение или восстановление кровотока в дистальном русле.
- Интенсивная и длительная антибиотикотерапия для лечения сепсиса и профилактики вторичной инфекции протеза.
Однако в редких случаях возможно сохранение инфицированного протеза. Главное условие - отсутствие признаков инфицирования анастомозов, что в клинической ситуации достаточно трудно четко определить. При сомнении в отсутствии инфекции синтетический протез необходимо удалять полностью. При такой тактике хорошие результаты лечения наблюдаются примерно в 70 % случаев [5, 9].
Полное удаление протеза можно сочетать как с репротезированием (что почти всегда обречено на реинфицирование), так и с экстраанатомической реконструкцией. Неоспоримым преимуществом этого метода является то, что первым этапом выполняется чистая часть операции, и анастомозы формируются вне зоны контаминации [4]. Существенной проблемой экстраанатомических шунтов остается остаточная контаминация в зоне перевязанной аорты, частота которой составляет менее 10 %, но разрыв перевязанной аорты обычно заканчивается фатально [10].
Подавление развития инфекции - основная задача антибиотикотерапии. Проблема выбора антибиотика будет существовать, пока появляются новые антибактериальные препараты, и продолжает меняться чувствительность бактерий к ним. Принимая решение о выборе антибиотика, как правило, врач последовательно оценивает следующие факторы: спектр активности, фармакокинетические характеристики, безопасность и переносимость. Антибиотики широкого спектра действия назначаются за 1 час до операции и впоследствии вводятся каждые 4 часа вмешательства. Если пациент имеет в анамнезе длительное применение антибиотиков, перенесенный сепсис или тяжелую пневмонию, имеются указания на непереносимость основных применяемых средств, больной должен быть проконсультирован специалистом по антибиотикопрофилактике. Длительность назначения антибактериальных средств определяется индивидуально.
Таким образом, ложные инфицированные послеоперационные аневризмы грудной аорты - это серьезные осложнения, требующие экстренного хирургического вмешательства. Летальность хирургического лечения послеоперационных аневризм нисходящей грудной аорты остается высокой и составляет от 5 до 28 % [1, 3, 10]. И хотя на современном этапе развития медицины летальность при экстраанатомических шунтированиях остается в пределах 10 %, этот метод позволяет наиболее эффективно оказывать помощь этой очень сложной категории пациентов.\
Рецензенты:
- Умаров В. М., д.м.н., главный научный сотрудник отделения хирургического лечения корня аорты. Научный центр сердечно-сосудистой хтрургии им. А. Н. Бакулева РАМН, г. Москва.
- Коваленко О. А., д.м.н., главный научный сотрудник отделения хирургического лечения ИБС. Научный центр сердечно-сосудистой хтрургии им. А. Н. Бакулева РАМН- Институт коронарной и сосудистой хирургии, г. Москва.
Библиографическая ссылка
Григорян Г.Р., Аракелян В.С., Гамзаев Н.Р., Чшиева И.В., Иванов А.А., Папиташвили В.Г., Гидаспов Н.А. ОПЫТ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ ИНФИЦИРОВАННЫХ ГРУДНЫХ АОРТАЛЬНЫХ ПРОТЕЗОВ // Современные проблемы науки и образования. – 2012. – № 3. ;URL: https://science-education.ru/ru/article/view?id=6304 (дата обращения: 23.04.2024).



