При выявлении первых признаков ГХ и своевременно начатой терапии прогноз более благоприятный [4; 16; 17]. В случае предрасположенности к развитию ГХ большое значение имеет сбор анамнеза и проведение лабораторных тестов, подтверждающих диагноз [18-20]. При этом нельзя ограничиваться определением только сывороточного железа (СЖ). НГХ может сочетаться с другими не менее тяжелыми заболеваниями, с такими как поздняя кожная порфирия (ПКП), β-талассемия и сахарный диабет. На основании анализа HLA-A аллелей получены определенные доказательства связи НГХ с ПКП. Не исключается, что пациенты с β-талассемией могут иметь мутацию в гене HFE (С282Y и H63D). При этих патологических состояниях наблюдается повышение HLA-В7 либо HLA-A3 [20-22].
Целью настоящей работы явилось изыскание новых дополнительных методов ранней диагностики НГХ путем расширенного изучения показателей метаболизма железопорфиринового комплекса, обмена порфиринов в сочетании с функциональным состоянием печени.
МАТЕРИАЛ И МЕТОДЫ. Под наблюдением находилось 155 больных с ГХ в возрасте от 25 до 45 лет (мужчин - 106, женщин - 49), которые были разделены на 4 группы. 1-ю группу составили 26 больных с гомозиготной формой заболевания, 2-ю - 47 пациентов с гетерозиготной формой ГХ в сочетании с ПКП, в 3-ю группу вошли 37 больных с гетерозиготной формой заболевания в чистом виде. В 4-ю группу (контроль) вошли 82 больных с вторичным приобретенным ГХ, у которых нарушения в обмене железа были связаны с регулярными гемотрансфузиями. При поступлении состояние 85 больных с НГХ оценивалось как средней тяжести и 70 - тяжелое. Больные жаловались на общую слабость, утомляемость, неприятные ощущения в области сердца, одышку, тяжесть в правом и левом подреберьях, сонливость, артралгии, похудание, боли в эпигастральной области, дискомфорт со стороны желудочно-кишечного тракта. При осмотре обнаружена выраженная коричневая пигментация кожи. У больных с НГХ при сочетании с ПКП на открытых участках тела выявлены рубцовые изменения, связанные с повышенной фотосенсибилизацией кожи. У всех больных увеличены размеры печени и селезенки. Печень плотной консистенции, у 56 - с неровной поверхностью.
У больных исследовались эритроцитарные (RBC, MCV, MCH, MCHC, RDW) и биохимические показатели (АЛТ и АСТ, гаммаглютамилтранспептидаза - ГГТ, ЩФ, ЛДГ, тимоловая проба). Определялись СЖ и общая железосвязывающая способность сыворотки крови (ОЖСС) по методу R. Henry et al. (1958), рассчитывался коэффициент насыщения белка трансферрина железом (КНТ). Имуноферментным методом с применением моноклональных антител исследовались растворимые трансферриновые рецепторы (рТФР). Сывороточный ферритин (СФ) определялся плашечным иммуноферментным методом с использованием набора «DRG» (США). В костном мозге подсчитывалось количество железосодержащих клеток - сидеробластов (СБ) и сидероцитов (СЦ). Изучалась концентрация железа в печени путем проведения пункционной биопсии органа. Определялась величина экскреции железа с мочой и уровень десфералового теста (метод R. Henry, 1958). Критериями перегрузки организма железом (ПЖ) были показатели СЖ > 35 мкмоль/л, КНТ > 50% и СФ ≥ 300 нг/мг, которые служили в качестве отборочного теста для проведения последующей дифференциальной диагностики наследственного и приобретенного ГХ. Все лица обследовались на носительство гена НГХ: антигенное тестирование по HLA (метод Терасаки, 1970) и ПЦР. Благодаря HLA типированию выявлены серологические маркеры наследственности ГХ - антигены HLA-A3, В7 и/или В14. С помощью ПЦР-диагностики у 38 больных обнаружена мутация в двух аллелях гена НГХ и у 13 в одном, которая приводила к аминокислотной замене С282Y (гомозиготный и гетерозиготный типы наследования). Мутация гена НГХ с аминокислотной заменой Р63D имела место у 20 больных. Семейно-генетические исследования подтверждали наследственный характер НГХ. У ближайших родственников больных выявлялись аномальные нарушения в обмене железа, которые, как правило, сводились к повышенному уровню СЖ и сидеробластозу в костном мозге, снижению ОЖСС, увеличению КНТ, повышению СФ и к полному отсутствию выделения железа с мочой.
Изучались основные предшественники порфиринового обмена - δ-аминолевулиновая кислота (АЛК) и порфобилиноген (ПБГ) по методу D. Mauzerall, S. Granik (1956), свободный эритроцитарный уропорфирин (УП), копропорфирин (КП) и протопорфирин (ПП) по методу Т. Dressel, J. Falk (1956). В моче определялась экскреция УП и КП (метод S. Schwarts et al., 1951) и Р. Koskelo (1956), а в кале концентрация КП и ПП (G. Holti et al., 1958). Проводились сонография органов брюшной полости. Комплексная программа лечения больных с ГХ включала сеансы флеботомий (ФТ) 2-3 раза в месяц, десферал (ДФ) до 2 г в неделю, лечебный плазмаферез (ПА) не менее 2 раз в месяц, гепатопротекторы (ГПТ) - гептрал либо редутокс до 2 г в неделю.
Для оценки полученных результатов применен параметрический критерий Стьюдента. При статистической обработке результатов использовали статистическую программу «Statistika 6». Статистически достоверными считались результаты различия p < 0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ. У больных с НГХ выявлены изменения эритроцитометрических показателей. Так, в 1-й группе больных уровень Hb и содержание эритроцитов достоверно отличались от нормальных показателей (170±13,8 г/л и RBC 6,2±1,15х1012/л; p < 0,001) и несущественно от больных 2-й и 3-й групп (158±10 г/л, RBC 5,5±0,6х1012/л; 160±11,7 г/л, 5,6±0,2х1012/л соответственно). Лейкоцитоз определялся независимо от формы заболевания. Значения RDW обнаружены повышенными у всех больных с ГХ. Показатели MCV в 1 и 2 группе составили 97,5±2,9 фл и 95±5,3 фл соответственно. Наряду с этим регистрировались признаки гемолиза эритроцитов, о чем свидетельствовал ретикулоцитоз и высокое содержание общего билирубина в сыворотке крови за счет не прямой фракции.
Следует отметить, что проведенное лечение не повлияло на такие показатели, как MCH и MCHC. Независимо от формы заболевания у всех больных с ГХ определялась нарушенной функциональная способность печени (табл. 1). Максимально высокие значения АЛТ и АСТ, как до так и после лечения, наблюдались у тех больных, у которых заболевание осложнялось присоединением вирусной инфекции гепатитов В и С и сопутствующей ПКП. Одновременно выявлена высокая активность ЛДГ, ГГТ и ЩФ. Нарушенные биохимические показатели в сочетании с клинической симптоматикой свидетельствовали о глубоких и необратимых изменениях в печени, которые трудно поддавались лечению. При НГХ выявлена гиперферремия, что характеризовалось высоким уровнем СЖ, СФ, КНТ. Перегрузка железом организма больных подтверждалась результатами биопсии печени. Во всех случаях обнаруживалось повышенное содержание железа в гепатоцитах и Купферовских клетках. Фиброзные изменения в печени выявлены у 11 больных 1-й и у 10 - 2-й группы, у которых имело место сочетание ГХ с ПКП. Гранулы железа содержались в портальном тракте и в макрофагах. Пункционная биопсия печени, кроме подтверждения развития ПЖ, свидетельствовала о наличии в органе некроза, воспаления, дистрофии и склероза.
Таблица 1 - Динамика основных биохимических показателей при ГХ в процессе проводимого лечения
|
Тесты и их нормы |
Период определения |
Форма заболевания |
|||
|
Гомозиготная форма НХЛ |
Гетерозиготная форма НГХ с ПКП |
Вторичный ГХ |
|||
|
Билирубин общий, 5,35-19,8 мкмоль/л |
д/леч. п/леч. |
25,1±1,25 21,5±1,15 |
24,6±1,4 21,5±1,1 |
23,7±1,2 22±1,3 |
27,7±1,2 25,5±1,1
|
|
АЛТ, 8-40 МЕ/л |
д/леч. п/леч. |
58,7±2,8 45,5±2,9 |
76,8±4,7 56,6±2,9 |
52,2±1,4 45,1±2,8 |
54±2,8 44,3±2,25 |
|
АСТ, 5-30 МЕ/л |
д/леч. п/леч. |
49±1,65 45,3±2,8 |
61,4±2,2 53,2±2,5 |
44±2,7 39,9±2,6 |
45,2±2,3 38,1±1,4 |
|
ЩФ, 5-13 ед. |
д/леч. п/леч. |
28±1,8 22±1,18 |
55±2,8 47±2,2 |
37,2±2,5 25,3±1,25 |
28±1,16 22±1,1 |
|
ГГТ, 25-30 ЕД/мг |
д/леч. п/леч. |
64±2,8 52±1,25 |
69±2,9 37±2,5 |
44±2,7 34,7±1,6 |
31±1,3 28±1,16 |
|
ЛДГ, 120-140 U/I |
д/леч. п/леч. |
273±7,5 254±6,9 |
246±16,1 229±15,8 |
271±6,4 203±5,8 |
185±5,8 175±5,6 |
|
Тимоловая пр., до 3 ед. |
д/леч. п/леч. |
14±1,3 8,2±1,1 |
18±1,5 14,5±1,2 |
9,1±0,9 7,5±0,8 |
14±0,5 8,7±0,7 |
У всех пациентов с НГХ начальные этапы синтеза гема определялись нарушенными. АЛК в 1-й группе больных отчетливо снижена (1,1±0,08 мкмоль/8,8 ммоль креатинина, при норме 8,62±0,74 мкмоль/8,8 ммоль креатинина; p < 0,01). Нормальное содержание АЛК в моче при вторичном ГХ являлось отличительным признаком этой формы заболевания от НГХ. В тоже время высокая экскреция АЛК с мочой, равная 14,7±1,3 и 15,1±1,6 мкмоль/8,8 ммоль креатинина, при гетерозиготном НГХ и его сочетаниях с ПКП также являлась характерным диагностическим признаком для данной патологии.
Несмотря на проводимую комплексную терапию, включающую сеансы ФТ и ПА в сочетании с ДФ и гепатопротекторами, синтез АЛК в 1-й группе больных активизировался несущественно (1,38±0,03 мкмоль/8,8 ммоль креатинина). После проведенной терапии повышенное содержание в моче АЛК обнаружено у пациентов 4-й группы, то есть с вторичной формой ГХ (9,2±0,9 мкмоль/8,8 ммоль креатинина). Полученные разноречивые данные о синтезе АЛК по группам свидетельствовали не только о влиянии ПЖ на образование порфиринов, но и о функциональном состоянии печени, обеспечивающей необходимый синтез промежуточных ферментов - синтетазы АЛК (АЛК-С) и порфобилиноген-дезаминазы (ПБГ-Д).
В 1-й группе, куда входили пациенты с гомозиготной формой НГХ, до и после лечения величина ПБГ определялась пониженной (0,21±0,01 и 0,34±0,2 мкмоль/8,8 ммоль креатинина). Его экскреция до лечения умеренно превышала норму во 2-й и 4-й группах (2,25±0,18; 2,4±0,15 мкмоль/8,8 ммоль креатинина). После проводимого лечения ПБГ у больных 3-й группы снизился (2,01±0,14 мкмоль/8,8 ммоль креатинина) и, в то же время, увеличился во 2-й и 4-й группах больных. Вследствие развития перегрузки железом УП у больных 1-й группы был повышенным, что не отразилось на величине экскреции его с мочой. После проведенной терапии выделение УП с мочой умеренно повысилось (4,05±0,16 нмоль/8,8 ммоль креатинина). В остальных группах в динамике количество свободного УП в эритроцитах оставалось высоким (p < 0,01), что ассоциировалось со степенью ПЖ и с повышенной экскрецией вещества с мочой. Следовательно, при высоком уровне Hb и RBC уропорфирин в неадекватных количествах покидал организм через почки. Под влиянием ПЖ синтез УП можно считать либо ускоренным, либо вещество не полностью используется в синтезе гема, а потому накапливается в клетке. В противоположность этим данным синтез копропорфирина (КП) и протопорфирина (ПП) у больных с НГХ в 1-й и 2-й группах больных определялся низким, а в 3-й - нормальным. После лечения его синтез при гомозиготной форме НГХ активизировался у 22 пациентов. Причем наблюдалась высокая экскреция КП не только с мочой, но и с калом. Одновременно отмечено повышение активности АЛТ и АСТ (45±2,8 МЕ/л), рост тимоловой пробы (табл. 1). При вторичном ГХ количество КП в эритроцитах, несмотря на проводимую терапию, существенно превышало норму (0,98±0,07 мкмоль/л и 1,25±0,1 мкмоль/л соответственно, p < 0,01). У них же зарегистрировано высокое содержание КП в моче (497±15,5 и 294±9,5 нмоль/8,8 ммоль креатинина) и в кале (30,5±1,52 и 42,0±2,15 нмоль). Высокое (p < 0,01) содержание КП в моче и в кале больных способствовало развитию сопутствующей вторичной печеночной порфирии, которая чаще развивалась при инфицировании вирусными гепатитами В и С.
Снижение КП в эритроцитах и, наоборот, увеличение его концентрации в моче и кале на фоне проводимой терапии свидетельствовало о том, что при НГХ существует особый механизм, который обеспечивает контроль за образованием и использованием КП для синтеза гема.
При изучении ПП в эритроцитах больных было выявлено следующее: при вторичном ГХ средние величины ПП не отличались от нормальных значений, в то время как при НГХ, независимо от формы заболевания, его синтез определялся сниженным как до, так и после лечения (в 1-й группе - 0,13±0,01 мкмоль/л и 0,28±0,02 мкмоль/л; во 2-й - 0,12±0,01 мкмоль и 0,17±0,02 мкмоль; в 3-й - 0,13±0,02 мкмоль и 0,24±0,02 мкмоль/л соответственно). Наряду с этим наблюдалось снижение экскреции ПП с калом (в 1-й группе - 17,5±1,1 нмоль и 12,8±1,0 нмоль; во 2-й - 12,9±1,1 нмоль и 9,8±0.8 нмоль; в 3-й - 14,9±1,2 нмоль и 21,4±1,5 нмоль, при норме 43,8 ±2,6 нмоль).
Наряду с высокими показателями СЖ во всех группах как до, так и после лечения, что наглядно показано на рисунке 1, обнаружено повышенное содержание СФ. ДФ-тест также свидетельствовал о повышенных запасах железа в организме больных (в 1-й группе - 3,9±1,2 мг/сут.; во 2-й - 3,6±0,11 мг/сут.; в 3-й - 2,7±0,09 мг/сут.; в 4-й - 2,4±0,1 мг/сут. при норме 1,28±0,06 мг/сут.). Высокий уровень запасного железа подтверждался результатами биопсии печени и магнитно-резонансной томографии.
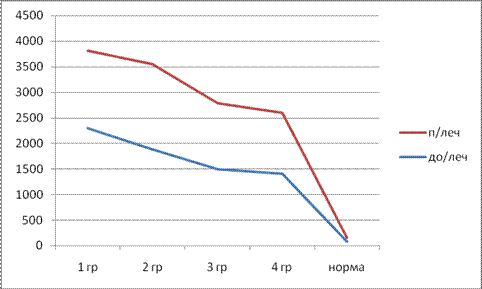
Рис. 1. Динамика содержания сывороточного ферритина в группах больных.
Примечание: до/леч - до лечения, п/леч - после лечения
Железо в печени в 1-й группе больных равнялось 29-37 мг/г сух. вещества печени, во 2-й - 20-25 мг/г сух. вещества печени, в 3-й - 15-19 мг/г сух. вещества печени и в 4-й группе - 10-13 мг/г сух. вещества печени, при норме меньше 1 мг/г сух. вещества печени. Определялось значительное увеличение КНТ и СФ. Наиболее высоким уровень КНТ оказался у пациентов с НГХ (110±8,2%), а самый низкий - у больных с вторичной формой ГХ (62±2,5%). Назначенное лечение не привело к его нормализации, что, вероятно, способствовало поддержанию тяжести состояния больных.
Кроме выше перечисленных параметров, для отражения ПЖ мы дополнительно исследовали запасы железа в костном мозге путем определения количества СБ и СЦ. У всех больных с НГХ, несмотря на проводимое лечение, костный мозг был перенасыщен железом, которое визуализировалось в виде сидерофильных гранул не только в составе эритронормобластов (сидеробласты) и эритроцитов (сидероциты), но и во внеклеточном пространстве, особенно у пациентов с НГХ, покрывая сплошь все поле зрения и создавая определенные трудности в подсчете клеток. Как видно из рисунка 2, содержание СБ было гораздо больше при НГХ (93±7,2%), чем при вторичном ГХ (46,2±2,4%). Высоким, во всех группах больных, определялось и число СЦ.
При анализе рТФР обнаружено, что у больных 1-й и 2-й групп как до, так и после лечения его уровень оставался низким (0,95±0,01 μг/л и 1,2±0,01 μг/л; 1,4±0,02 μг/л и 1,8±0,05 μг/л соответственно; норма - 2,5±0,48 μг/л). Лишь у пациентов 3-й группы уровень рТФР определялся нормальным (2,2±0,25 μг/л и 2,8±0,4 μг/л, соответственно до и и после лечения). Между тем при вторичной форме ГХ количество рТФР исходно и после завершения курса лечения оказалось достоверно повышенным (4,1±0,22 μг/л и 4,5±0,26 μг/л соответственно). Об угнетенной функциональной способности печени у больных с НГХ наряду с печеночными пробами свидетельствовали данные ОЖСС, которая независимо от формы заболевания была низкой. Так, в 1-й и 3-й группах больных ОЖСС составила 31±1,2 мкмоль/л и 34±1,1 мкмоль/л, во 2-й группе ее уровень был еще ниже (26±0,08 мкмоль/л), а в 4-й группе, наоборот, выше (50±3,1 мкмоль/л.) но, тем не менее, ниже нормальных значений (58,6±1,3 мкмоль/л). Одновременно наблюдалось существенное увеличение активности АЛТ и АСТ, изменение тимоловой пробы, а во 2-й группе больных, наряду с этим, повышение содержания общего билирубина в сыворотке крови (табл. 1). В процессе проводимой терапии при НГХ положительной динамики указанных тестов не наблюдалось. Между тем у больных с вторичной формой ГХ после проведенной терапии уровень ОЖСС нормализовался. Полученные данные позволяют утверждать, что при НГХ нарушения функциональной способности печени носят необратимый характер.

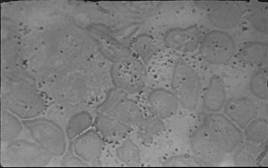
а б
Рис. 2. Скопление гемосидерина в костном мозге больного с НГХ (а) и вторичной формой ГХ (б)
Таким образом, проведенные исследования у больных с ГХ выявили глубокие нарушения в обмене порфиринов. Все биохимические параметры, характеризующие метаболизм железа при ГХ, были повышенными. Высокие показатели СЖ при НГХ во всех случаях сопровождались изменениями в синтезе порфиринов. Особенно выраженные нарушения выявлены при НГХ и при сочетании его гетерозиготной формы с ПКП. Причем обнаружена связь изменений в метаболизме железа и порфиринов с функциональным состоянием печени, в которой синтезируются промежуточные ферменты, необходимые для образования порфириновой структуры гема. Наблюдалось снижение количества УП, КП и ПП в эритроцитах.
Установлено, что при НГХ из-за тяжелой перегрузки железом обмен порфиринов угнетен и этот процесс необратим. У больных с НГХ, у гомо- и гетерозигот при отсутствии существенных различий в показателях метаболизма железа большую помощь в определении тяжести состояния оказывает исследование параметров порфиринового обмена. После проведенного лечения, включавшего ФТ, ПА, ДФ и ГПТ, у больных с НГХ уровень СЖ умеренно понизился. Между тем в группе пациентов с вторичным ГХ после лечения содержание СЖ повысилось, что, по-видимому, связано с основной патологией либо с повышенным ВЖК и дополнительным выходом элемента в кровь из органов депо, главным образом из печени. После проведения соответствующей комплексной терапии наблюдается улучшение функционального состояния печени.
Наиболее информативными дифференциально-диагностическими критериями при НГХ являются изменения содержания АЛК и ПБГ в моче.
Рецензенты:
- Грицаев С.В., д.м.н., главный научный сотрудник гематологической клиники ФГУ «Российский НИИ гематологии и трансфузиологии» ФМБА России, г. Санкт-Петербург.
- Капустин С.И., д.б.н., руководитель лаборатории биохимии ФГУ «Российский НИИ гематологии и трансфузиологии» ФМБА России, г. Санкт-Петербург.
Работа получена 26.07.2011
Библиографическая ссылка
Бессмельцев С.С., Байтаева Д.А. ВЗАИМОСВЯЗЬ ПОКАЗАТЕЛЕЙ МЕТАБОЛИЗМА ЖЕЛЕЗА С ОБМЕНОМ ПОРФИРИНОВ ПРИ ГЕМОХРОМАТОЗЕ // Современные проблемы науки и образования. – 2011. – № 3. ;URL: https://science-education.ru/ru/article/view?id=4674 (дата обращения: 18.04.2024).



