Возрастание заболеваемости первичными опухолями головного мозга среди взрослого населения отмечается во многих странах и представляет глобальную проблему [1]. Среди первичных опухолей мозга более 70% приходится на долю глиом с различной степенью злокачественности (Grade I–IV). В зависимости от локализации они оказывают влияние на функционально значимые структуры головного мозга, снижая качество и продолжительность жизни данной группы пациентов. Несмотря на высокотехнологичные методы хирургии и радиотерапии, прогноз для пациентов с глиомами наиболее высокой степени злокачественности – Grade IV – остается крайне неблагоприятным, и медиана общей выживаемости составляет 9–15 месяцев [1, 2]. Глиомы высокой степени злокачественности (HGG) характеризуются агрессивным ростом с быстрым увеличением объема новообразования и интенсивной клеточной пролиферацией, за счет чего повреждается эндотелий сосудов, развиваются тромбозы, нарастает гипоксия [3]. Помимо роста опухоли, большую роль играет отек перифокальной зоны ложа опухоли, который усугубляет сдавление мозговых структур, особенно на этапе лучевой терапии. В результате поздних лучевых повреждений развиваются нейрокогнитивные расстройства, деменция и, наконец, постлучевые некрозы [4]. Значительная степень повреждающего влияния на мозг злокачественной опухоли и агрессивное действие лучевой терапии диктуют необходимость разработки и включения в состав комплексной терапии биотехнологий, направленных на улучшение качества и продолжительности жизни пациентов с HGG.
Среди перспективных направлений нейроонкологии ученые разных стран рассматривают применение технологий, основанных на использовании факторов физической природы. Показана эффективность методов нейтронной терапии [5], радиосенсибилизации опухоли [6, 7], брахитерапии [8], TTF-терапии электрическими полями. Однако при решении задач локального противоопухолевого влияния не всегда удается избежать побочных системных нарушений ЦНС, что сказывается на снижении резистентности организма, продолжительности и качества жизни пациентов. Новые возможности открывает неинвазивная импульсная транскраниальная магнитотерапия (ТМТ) как вспомогательный метод реабилитации больных интрамедуллярными опухолями в раннем послеоперационном периоде [9]. Вместе с тем существующая стратегия восстановительной терапии ТМТ может существенно расширить возможности благодаря использованию не только локальных (на ложе опухоли), но и системных электромагнитных воздействий на управляющие структуры – гипоталамическую область мозга [10]. Благодаря разработке и научному обоснованию транскраниальной сверхнизкочастотной магнитотерапии (СНЧМП) с различными биотропными параметрами, адекватными эндогенным частотным ритмам мозга, удалось получить ингибирующее влияние на рост перевивных и первично индуцированных опухолей внемозговой локализации, опосредованное многоуровневыми механизмами развития интегральных антистрессорных реакций и повышением неспецифической противоопухолевой резистентности организма [11]. Разработанные принципы и программированные режимы активационной магнитотерапии были обобщены и применены в онкологической практике при комплексном лечении рака легкого, молочной железы, опухолей мозга и опухолей других локализаций [12–14]. С учетом клинического опыта коррекции системных нарушений представляется целесообразным расширить возможности сопроводительного лечения ТМТ путем двойного воздействия, сочетающего индукцию локальных и интегральных системных эффектов на этапах комплексной терапии злокачественных глиальных опухолей. Требуемая экспертиза клинической безопасности и необходимость патогенетической обоснованности такой технологии предполагали, прежде всего, изучение молекулярно-генетических особенностей нестандартного сочетанного и раздельного неионизирующего (СНЧМП и ИМП) и ионизирующего излучения на глиальные клетки опухоли, их пролиферативной активности в эксперименте in vitro. В опытах на культуре глиобластомы человека T98G были разработаны алгоритмы воздействий и выявлены наиболее результативные параметры действующих физических факторов для сдерживания роста опухолевых клеток, подтвержденные патентом Российской Федерации [15], что послужило обоснованием для трансляции метода сопроводительной терапии в клинику.
Цель работы: улучшение результатов комплексного лечения больных со злокачественными глиомами головного мозга посредством сочетания транскраниальной импульсной и сверхнизкочастотной магнитотерапии в раннем послеоперационном периоде и на этапе лучевой терапии.
Материал и методы исследования. В работе приведены данные 50 пациентов с HGG, проходивших лечение в ФГБУ «НМИЦ онкологии» Минздрава России и давших информированное согласие на участие в исследовании и обработку персональных данных. Исследования проводились в соответствии с этическими стандартами Декларации Хельсинки (1964 г., в редакции 2013 г.) и одобрены Этическим комитетом ФГБУ «НМИЦ онкологии» Минздрава России (Протокол экспертизы по этике № 19 от 06.10.2017 г.). Критериями невключения при наборе групп служили: возраст менее 18 лет, сопутствующие тяжелые соматические заболевания, наличие внутричерепных металлических имплантов, кардиостимуляторов, кохлеарных имплантов и слуховых аппаратов, имплантированных помп и насосов. Отбор пациентов проводился методом простой рандомизации с формированием основной и контрольной репрезентативных групп по 25 человек. У подавляющего числа больных обеих групп был верифицирован диагноз «глиобластомы головного мозга» (96% больных в основной группе и 88% – в группе сравнения), большинство больных (91,6%) поступили с новообразованиями, располагавшимися в пределах лобной, височной, теменной областей и области «переднего стыка». Наименьшее количество (8,3%) были с опухолями затылочной области и области «заднего стыка». Поражение 2 (и 3) долей в области переднего и заднего стыков наблюдали в 33,3% случаев. До операции средний объем опухоли у пациентов основной группы составил 58,7 см³ против 60,4 см³ в контрольной группе, средний объем отека в основной группе до операции составил 114,8 см³ против 106,6 см³ в группе контроля. Среди больных доминировали люди в возрасте 60 лет и старше (44% случаев). Таким образом, исследуемые группы были сопоставимы по возрасту и полу, расположению, гистологическому типу и объему новообразований, объему отека перифокальной зоны.
Первым этапом всем пациентам выполнялась костно-пластическая краниотомия с максимальным циторедуктивным удалением новообразования в пределах видимых здоровых тканей с использованием флюоресцентной микроскопии, навигационной системы и нейрофизиологического мониторинга. Спустя 4 недели больным выполняли МРТ головного мозга и госпитализировали для проведения курса конформной лучевой терапии (ЛТ) на аппарате «линейный ускоритель Varian Novalis». ЛТ проводилась на остаточную ткань опухолевой субстанции и ложе удаленного новообразования с разовой дозой облучения (РОД) 2 Гр до достижения суммарной дозы облучения (СОД) 60 Гр; сеансы проводились 1 раз в день, 5 дней в неделю, весь этап лечения составил 6 недель. Третьим этапом комплексного лечения пациентам обеих групп под наблюдением онколога по месту жительства проводилась многокурсовая химиотерапия по схеме: темозоломид 150 мг/м² в 1–5-е дни, затем перерыв 23 дня.
На этапах комплексного лечения пациентам основной группы дополнительно проводилось 2 курса ТМТ: первый – в раннем послеоперационном периоде (10 сеансов, начиная со 2-го дня после операции: первые пять сеансов – ежедневно, а далее – через день, 3 раза в неделю), второй – на протяжении всего этапа лучевой терапии (15 сеансов, через день, 3 раза в неделю). Каждый сеанс ТМТ включал программированный режим двойного воздействия. Сначала проводилось системное воздействие – утром на область проекции гипоталамуса с помощью аппарата «Градиент-4М» СНЧМП в экспоненциальном режиме интенсивности (B) от 3 mT до 1 mT в алгоритме частоты и экспозиции F=0,3 Hz (t= 5 мин), F=3 Hz (t=1 мин), F=9 Hz (t=1 мин). Спустя 2,5–3 ч осуществляли второе локальное (на проекцию ложа опухоли) транскраниальное воздействие импульсным магнитным полем, индуцированным прибором «Нейро-МС/Д терапевтический расширенный» компании «Нейрософт» в аналогичном алгоритме частот F= 0,3 Hz (t=5 мин), F=3 Hz (t=1 мин), F= 9 Hz (t=1 мин), t общее =7 мин, но с большей индукцией B=15 mT. На этапе ЛТ сеанс конформной лучевой терапии осуществляли в промежутке между первым и вторым воздействием ТМТ. Таким образом, за весь период комплексного лечения пациенты основной группы получили 25 сеансов ТМТ, включающих 50 процедур, идентичных по частоте и экспозиции с вариацией интенсивности воздействия и импульсной активности.
МРТ головного мозга пациентам обеих групп выполнялась до операции, через 4 недели после операции, при выписке больных после лучевой терапии. Расчеты объема новообразования производили по формуле Шрека для эллипсоида (V=a×b×c×π/6). Использовался режим МРТ «Bravo 3D» с контрастным усилением. Объем опухоли вычисляли по формуле V1=a1xb1xc1xП/6, где a1, b1, c1 – максимальные размеры образования в трех взаимно перпендикулярных плоскостях, V(оп.) – объем опухоли. Вычисление объема отека перифокальной зоны головного мозга (Vот.) проводилось в режиме T2 Flaire. Сначала измеряли три максимальных размера отека мозга в трех взаимно перпендикулярных плоскостях (a2, b2, c2), затем так же использовали формулу Шрека для расчета объема отека перифокальной зоны вместе с объемом опухоли V(оп.+от.)=a2xb2xc2xП/6. После этого из V(оп.+от.) вычитали V(оп.) и получали значения объема отека перифокальной зоны головного мозга. Анализ данных МРТ до и после курса лучевой терапии с применением ТМТ проводили вышеописанным способом.
Статистический анализ результатов осуществляли с помощью пакета программ Statictica v12. Для оценки измерений объемов новообразования и отека перифокальной зоны головного мозга использовали тест Вилкоксона–Манна–Уитни. Статистическую обработку бессобытийной и общей выживаемости пациентов исследуемых групп осуществляли методом Каплана–Мейера с использованием Log-Rank test. Достоверными считались различия при р<0,05. Учитывая циторедуктивный объем хирургического вмешательства при HGG, у каждого пациента основной и контрольной групп проводили поэтапное линейное определение разницы (Δ) показателей объема опухоли и отека (V1, V2, V3), после этого данные подвергали общегрупповой статистической обработке. Таким образом, представлялось целесообразным не слепое проведение суммации показателей объемов на каждом этапе, а выявление индивидуальной разницы и последующего усреднения этих значений объемов компьютерных изображений опухоли и отека, что помогло определить реальную динамику злокачественного процесса в головном мозге.
Результаты исследования и их обсуждение. При оценке данных нейровизуализации (МРТ) и определении объема опухоли до оперативного вмешательства (V1) существенных различий между показателями основной и контрольной групп не было (р=0,7661). Однако при сравнении разницы между начальным объемом и объемом оставшейся опухоли до начала лучевого лечения в основной группе с сопроводительной ТМТ в раннем послеоперационном периоде был установлен выраженный эффект торможения продолженного роста опухоли, превышающий показатели (V2–V1) в контроле в 3,7 раза (р≤0,05). Аналогичный эффект подтвердил и информативный показатель соотношения V1/V2 (р≤0,05). Важно отметить, что на этапе лучевой терапии эффект сдерживания роста опухоли под влиянием ТМТ выражен слабее, что было связано с противоопухолевой эффективностью ионизирующего излучения. Результаты приведены в таблице 1.
Таблица 1
Показатели объема опухолевой ткани на этапах комплексного лечения исследуемых групп пациентов
|
Показатели объема опухоли |
Средний объем опухоли в см³ (mean± SE) |
Р |
|
|
Основная группа (n=25) |
Контрольная группа (n=25) |
||
|
V1 |
58,7±5,1 |
56,6±9,2 |
0,7661 |
|
V2 |
18,8±4,6 |
38,6±10,7 |
0,1348 |
|
V3 |
13,5±3,8 |
23,0±10,7 |
0,4825 |
|
(V2–V1) |
–37,5±5,4 |
–10,2±4,0 |
0,0016* |
|
(V3–V2) |
–0,21±0,97 |
–6,1±11,6 |
0,4047 |
|
(V3–V1) |
–39,1±7,0 |
–18,5±10,1 |
0,1393 |
|
V1/V2 |
6,7±2,4 |
2,3±0,7 |
0,0215* |
|
V2/V3 |
1,45±0,37 |
1,1±0,23 |
0,4510 |
|
V1/V3 |
9,1±3,8 |
4,3±2,5 |
0,2674 |
P – уровень статистической значимости различий между основной и контрольной группами, р<0,05* – статистически значимые различия между группами; N – выборка; SE – стандартная ошибка; V1 – средний объем новообразования до операции; V2 – средний объем оставшейся опухолевой ткани до лучевого лечения; V3 – объем новообразования после курса лучевой терапии.
В отношении объема перифокального отека ТМТ оказала более выраженное влияние. Первоначальные значения перифокального отека в основной группе существенно не отличались от показателей в контроле. После проведения ТМТ в раннем послеоперационном периоде ситуация значимо изменилась. Если у пациентов контрольной группы на этапе до лучевой терапии значения среднего объема перифокального отека ложа удаленной опухоли уменьшились в 1,4 раза относительно первичных данных, то выраженность этого эффекта в основной группе была практически удвоена (р≤0,05). Более демонстративная динамика регрессии перифокального отека ложа опухоли наблюдалась на этапе после лучевой терапии, где разница в снижении абсолютных значений объема отека в основной группе по сравнению с периодом до операции была отрицательной и составила –76,6 см³, а в группе контроля, напротив, объем отека возрос на 10,1 см³ (p=0,0301). Статистическая достоверность различий между основной и контрольной группами подтверждена как при вычислении разницы V2–V1, V3–V2, V3–V1, так и их соотношений V1/V2, V2/V3, V1/V3 (р≤0,05). Результаты изменения объемов отека перифокальной зоны мозга у пациентов исследуемых групп представлены в таблице 2.
Таблица 2
Показатели объема перифокального отека ложа опухоли на этапах комплексного лечения исследуемых групп пациентов
|
Показатели объема отека |
Средний объем в см³ (mean± SE) |
Р |
|
|
Основная группа (n=25) |
Контрольная группа (n=25) |
||
|
V1 |
112,2±13,4 |
79,1±14,30 |
0,0682 |
|
V2 |
55,0±8,0 |
71,8±13,4 |
0,3677 |
|
V3 |
48,0±9,8 |
115,6±24,4 |
0,0079* |
|
(V2–V1) |
–56,9±13,8 |
–7,3±8,6 |
0,0138* |
|
(V3–V2) |
–9,9±3,5 |
31,1±16,2 |
0,0104* |
|
(V3–V1) |
–76,6±16,4 |
10,1±28,5 |
0,0301* |
|
V1/V2 |
2,7±0,5 |
1,43±0,34 |
0,0392* |
|
V2/V3 |
1,25±0,08 |
0,8±0,17 |
0,0058* |
|
V1/V3 |
3,75±0,84 |
1,04±0,24 |
0,0180* |
P – уровень статистической значимости различий между основной и контрольной группами, р<0,05*– статистически значимые различия между группами; N – выборка; SE – стандартная ошибка; V1 – средний объем перифокального отека мозга до операции; V2 – средний объем перифокального отека мозга до лучевого лечения; V3 – средний объем перифокального отека мозга после курса лучевой терапии.
Выраженный противоотечный эффект ТМТ на этапе окончания лучевой терапии демонстрировал возможность снижения пролонгированного повреждающего влияния ионизирующего излучения на перифокальную зону ложа опухоли. По-видимому, оказанное защитное действие ТМТ могло повлиять и на ближайшие результаты лечения пациентов с HGG.
Анализ показателей общей выживаемости пациентов по методу Каплана–Мейера в группах сравнения позволил охарактеризовать динамику цензурированных событий на сроках 6 и 12 месяцев. Включение сопроводительной ТМТ в состав комплексного лечения пациентов основной группы в раннем послеоперационном периоде и на этапе лучевой терапии через 6 месяцев наблюдения позволило сохранить выживаемость на уровне 100%, в то время как в контрольной группе этот показатель уменьшился до 86,8±8,7% (р=0,0011). При оценке показателей годовой общей выживаемости проявляется еще более выраженная разница: в основной группе одногодичная общая выживаемость составила 69,2±10,4%, превысив показатели контроля, равные 39,0±7,4%. Различия выживаемости между пациентами основной и контрольной групп по Log-Rank test оказались достоверными, р=0,0011 (рис.).
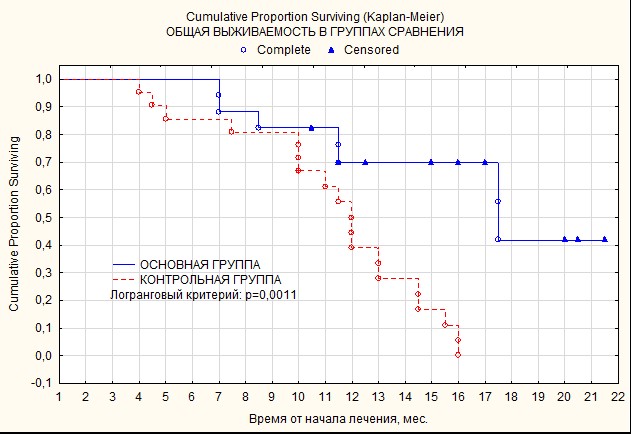
Показатели общей выживаемости больных в группах сравнения
Заключение. Полученные нами результаты подтверждают эффективность предложенного метода сопроводительной терапии с применением ТМТ на этапах хирургического и лучевого лечения. Включение программированного режима магнитотерапии в сопроводительное лечение на первом этапе, т.е. в раннем послеоперационном периоде, у пациентов с HGG основной группы сопровождалось выраженным снижением соотношения объемов опухоли (V1/V2 в основной группе 6,7±2,4 см3 против 2,3±0,7 см3 в контроле; р=0,0215). На втором этапе комплексного лечения клинически важным обстоятельством стало противоотечное влияние ТМТ, что подтверждается достоверным различием соотношений величин средних межгрупповых значений объемов перифокального отека ложа опухоли до лечения и после хирургического и лучевого этапов комплексной терапии V1/V3 (3,75±0,84 против 1,04±0,24 см3 в контроле; р=0,0180). Достоверное увеличение 6- и 12-месячной общей выживаемости пациентов основной группы при анализе данных по методу Каплана–Мейера (Log-Rank test, р=0,0011) свидетельствует о действенности рассмотренных методик и делает целесообразным включение данного вида лечения в комплексную терапию больных с HGG.
Работа выполнена при финансовой поддержке РФФИ в рамках гранта (проект № 19-315-90082\19).
Библиографическая ссылка
Кит О.И., Попов И.А., Шихлярова А.И., Енгибарян М.А., Франциянц Е.М., Росторгуев Э.Е., Гусарева М.А., Розенко Л.Я., Иозефи Д.Я., Жукова Г.В. ВОЗМОЖНОСТИ СОПРОВОДИТЕЛЬНОЙ ТРАНСКРАНИАЛЬНОЙ ЭЛЕКТРОМАГНИТОТЕРАПИИ В КОМПЛЕКСНОМ ЛЕЧЕНИИ БОЛЬНЫХ С ВЫСОКОЗЛОКАЧЕСТВЕННЫМИ ГЛИОМАМИ ГОЛОВНОГО МОЗГА // Современные проблемы науки и образования. – 2021. – № 1. ;URL: https://science-education.ru/ru/article/view?id=30491 (дата обращения: 19.04.2024).



