Аутоиммунные заболевания представлены в современной популяции более чем 100 нозологическими формами и затрагивают порядка 8% жителей планеты [1]. Среди системных аутоиммунных патологий наиболее распространены ревматические заболевания, имеющие в основе этиопатогенеза сочетание генетически детерминированных и приобретенных дефектов иммунорегуляторных механизмов [2]. Патологический процесс обусловлен нарушением толерантности и развитием иммунного ответа на аутоиммунные антитела, размножением эффекторных Т-клонов, распознающих собственные антигены и инициирующих воспаление в отдельном органе или системе организма [3]. Сложность молекулярно-клеточных механизмов, лежащих в основе аутоиммунитета, обусловливает проблемность поиска и изучения новых эффективных методов лечения аутоиммунных заболеваний.
Современные схемы лечения основаны на использовании глюкокортикоидных гормонов, алкилирующих цитостатиков, иммуносупрессоров и экстракорпоральных (иммуносорбция и др.) способов терапии. К числу существенных недостатков базисных методов фармакотерапии относятся множественные побочные эффекты, связанные с развитием тяжелых осложнений, таких как синдром Иценко-Кушинга, нарушения водно-минерального обмена, стероидный диабет или стероидные язвы желудка и кишечника, психические расстройства и др. [4]. Это побуждает к непрерывному поиску новых способов коррекции нарушений здоровья – в первую очередь с помощью инновационных генетически модифицированных биологических препаратов – продуктов фарминг-технологий [5]. При этом вопросы, связанные с эффективной профилактикой и поиском адъювантных средств, снижающих токсичность препаратов базисной терапии, также сохраняют свою актуальность.
Целью работы являлось изучение эффективности коррекции патологических нарушений смесью лимонной и янтарной кислот в модели адъювантного аутоиммунного ревматоидного артрита у крыс.
Материалы и методы исследования. Исследования проводили на крысах-самцах линии Wistar (n=29) массой 400-440 г в возрасте 24 месяца (ФГУП «Питомник лабораторных животных «Рапполово», Ленинградская область). Животные содержались в стандартных условиях вивария при постоянной температуре, влажности и световом режиме 12:12 со свободным доступом к пище и воде. В работе с лабораторными животными придерживались правил и этических норм содержания и ухода, описанных в руководстве National Research Council, 2011 г. и ГОСТ Р53434-2009 «Принципы надлежащей лабораторной практики» с разрешения этического комитета при Институте биомедицинских исследований РАН. Эвтаназию крыс осуществляли в CO2-затравочной камере. Животные были разделены на четыре группы. Манипуляции по введению растворов проводились под легким общим наркозом («Золетил», Франция). Крысам первой группы (негативный контроль (n=6)) вводили в правую заднюю конечность подкожно изотонический раствор натрия хлорида в объеме 0,1 мл на 200 г массы тела (м.т.). Во второй группе крыс (позитивный контроль (n=7)) моделировали адъювантный артрит путем однократного введения в правую заднюю конечность адъюванта Фрейнда (АФ) DIFCO LABORATORIES (Detroit, Michigan, США) в объеме 0,1 мл на 200 г м.т. Животным третьей и четвертой групп (по 8 животных в каждой) на фоне индуцированной патологии (0,1 мл на 200 г м.т. АФ) вводили однократно в день с едой смесь лимонной и янтарной кислот («Л» и «Я» соответственно) в массовом соотношении 1:4 на протяжении всего периода эксперимента (7 недель). Дозировка кислот (нейтрализованных до рН=7,5 минеральной водой) составляла: третья группа 17 мг/кг, четвертая – 88 мг/кг м.т. По окончании эксперимента у животных под наркозом из сердца отбирали кровь, которую стабилизировали гепарином. После центрифугирования в отмытых холодным (t=4 °C) изотоническим раствором эритроцитах изучали активность каталазы по стандартной методике, основанной на спектрофотометрическом измерении кинетики распада перекиси водорода при длине волны 230 нм (T. Beutler, [6]). В плазме определяли содержание гидроперекисей по Гаврилову, используя киты фирмы ООО «Агат-Мед» (Россия).
Двигательную активность животных измеряли по числу пересеченных квадратов в стандартной установке тест-системы «Открытое поле» производства ООО «НПК Открытая наука» (Россия). Видеорегистрацию поведения животных (3 мин.) осуществляли с помощью цифровой системы, подключенной к компьютеру по интерфейсу GigEVision; полученные видеофайлы обрабатывали в программе RealTimer.
Для гистологических исследований у животных извлекали бедренную и берцовые кости, объектом исследования служил коленный сустав. Материал фиксировали в 10% растворе нейтрального формалина, срезы окрашивали раствором гематоксилин-эозина. Микроскопию проводили при увеличении 10х10 и 10х40.
Статистический анализ данных проводили с использованием критерия Стьюдента в программе Excel, входящей в пакет Microsoft Office 2016. Рассчитывали среднее (M) и стандартную ошибку среднего (±m). Первичные данные оценивали по критерию Шапиро-Уилка на нормальность распределения. Все четыре выборки соответствовали нормальному распределению случайных величин и использовались для проверки равенства средних значений в двух сравниваемых выборках (позитивный и негативный контроли; группы леченых животных с позитивным контролем). Статистически значимыми считали значения p<0,05.
Результаты
Введение крысам адъюванта Фрейнда приводит к формированию аутоиммунного ревматоидного артрита, характеризующегося хроническим характером течения. На первой стадии заболевание протекает через фазу острого периартикулярного воспаления, в дальнейшем патологические изменения затрагивают и костную ткань [7]. Поскольку воспалительный процесс приводит к дисбалансу в системе перекисного окисления липидов (ПОЛ) [8], контроль первичных продуктов липопероксидации – гидроперекисей отражает динамику изменений в условиях модельной патологии (позитивный контроль) и ее коррекции антиоксидантами в виде лимонной и янтарной кислот (рис. 1).
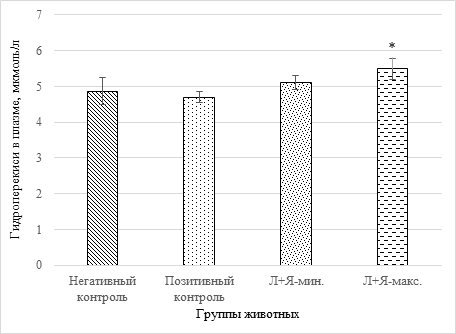
Рис. 1. Содержание гидроперекисей в плазме крови животных в условиях модельного аутоиммунного РА (*-p<0,05 относительно группы позитивного контроля; «Л+Я» - смесь лимонной и янтарной кислот в минимальной и максимальной дозировках, соответственно)
Из рисунка 1 видно, что к седьмой неделе с момента начала формирования патологии у животных, соответствующей четвертой стадии заболевания у людей, концентрация гидроперекисей у крыс с индуцированным РА недостоверно и незначительно снижена (на 4% относительно группы негативного контроля). Коррекция антиоксидантного статуса смесью органических кислот приводит к достоверному дозозависимому повышению гидроперекисей в третьей и четвертой группах на 5-13% (р=0,04 для четвертой группы). Учитывая то обстоятельство, что данные показатели находятся в пределах физиологической нормы, выявленная закономерность может служить позитивным диагностическим признаком, свидетельствующим о поддержании на высоком уровне синтеза простагландинов, лейкотриенов и др. биологически активных компонентов системы комплемента [9].
Реактивность ферментного звена антиоксидантной системы защиты организма представлена на рис. 2.
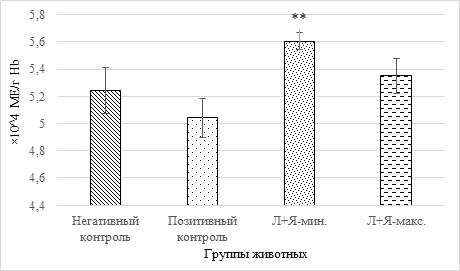
Рис. 2. Активность каталазы (**-p<0,01 относительно группы позитивного контроля; обозначения см. на рис. 1)
Результаты, представленные на диаграмме, свидетельствуют о снижении ферментативной активности в отношении токсичной эндогенной перекиси водорода у животных с модельным ревматодиным артритом на 4%. Уменьшение рисков инициации ПОЛ по реакции Фентона и развития окислительного стресса у крыс с антиоксидантной профилактикой демонстрируется двумя правыми столбцами на диаграмме: введение 17 мг/кг веса антиокислителей приводит к достоверному росту (р=0,007) активности каталазы на 7% относительно животных, составивших группу позитивного контроля.
Позитивные изменения на молекулярном уровне в условиях антиоксидантной модификации аутоиммунных нарушений проявились сохранением суставного аппарата у леченых животных (рис. 3).
|
а |
б |
|
в |
г |
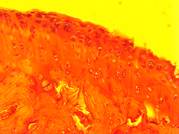
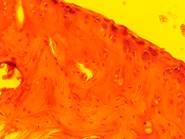
Рис. 3. Морфология коленного сустава животных: а – негативный контроль; б – позитивный контроль; в, г – коррекция органическими кислотами в дозировках 17 и 88 мг/кг веса соответственно
У всех животных модельной группы (3б) прослеживались изменения суставного аппарата различной степени тяжести. В синовиальной оболочке отмечалась пролиферация синовиоцитов, гиперплазия, отечность и утолщение слоев, в строме – очаги периваскулярного инфильтрата, представленного преимущественно лимфоцитами. Морфологическая картина надхрящницы свидетельствует о признаках дезорганизации соединительной ткани в виде истончения и разволокнения как наружного слоя рыхлой волокнистой соединительной ткани с умеренно выраженным периваскулярным отеком и единичными лимфоцитами в сосудистой стенке, фокусами кровоизлияний, так и внутреннего слоя с относительным уменьшением клеточного состава.
У животных, получавших в рационе смесь лимонной и янтарной кислот, патологические изменения выражены значительно слабее (3 в, г). Степень пролиферации синовиоцитов близка к норме (контрольным животным), покровный и коллагено-эластический слои синовиальной мембраны без видимых признаков гиперплазии, однако в отдельных местах у некоторых животных слои сливаются вместе и истончаются. Глубоко расположенные хондроциты имеют округлую форму и лежат в виде правильных вертикальных рядов. Хондроциты, расположенные поверхностно, имеют как овальную (веретенообразную), так и уплощенную форму и чаще не образуют групп. Гистоархитектоника у животных контрольной группы (3а) без видимых признаков патологических изменений.
На организменном уровне эффективность введения животным веществ с восстановительным потенциалом проявилась увеличением двигательной активности в тест-системе «открытое поле» (рис. 4).
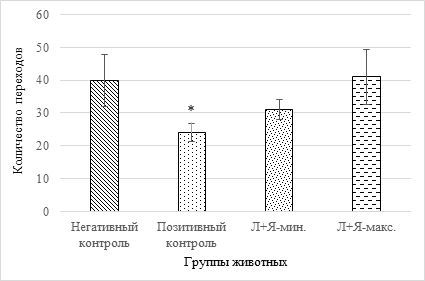
Рис. 4. Количество пересеченных секторов за период наблюдения 3 мин. (обозначения см. на рис. 1)
Из рисунка 4 видно, что протективный эффект исследуемых препаратов в отношении диартрозов проявился и на общей подвижности грызунов. Достоверные отличия между животными негативного и позитивного контроля выявляют характерные клинические признаки, свойственные для РА: болевой синдром, скованность и др., влияющие на поведение животных. Количество переходов между отдельными секторами в модельной группе снижается на 40% (р=0,046), в то время как защитное действие кислот способствует дозозависимому купированию патологических признаков. Характерным является то обстоятельство, что у животных с максимальной дозировкой число пересеченных секторов совпадает с животными контрольной группы и составляет 41±8,4 и 40±7,9 соответственно.
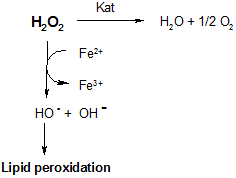
Хронический характер многих системных заболеваний, к числу которых относится РА, сопровождается нарушением энергетического и пластического обмена в организме [10]. В этой связи введение в рацион основных субстратов цикла трикарбоновых кислот – лимонной и янтарной - способствует нормализации не только процессов катаболизма, но и антиоксидантного статуса, нарушение которого является неизбежным следствием воспалительного процесса, являющего патогенетическую основу аутоиммунных заболеваний. Согласно полученным результатам, профилактика сукцинат-цитратной смесью способствует достоверному повышению активности каталазы, что служит маркером снижения рисков эндогенной интоксикации за счет накопления активных форм кислорода [11]. В их числе наибольшую опасность окисления биологических субстратов представляют гидроксильные радикалы:
 .
.
Последние, как следует из схемы, являются инициаторами процессов перекисного окисления липидов. Переокисление биологических мембран может приводить к ложно заниженным диагностическим показателям по отдельным продуктам ПОЛ. В этой связи контролируемый процесс генерации гидроперекисей, отмеченный у животных с антиоксидантами в режиме «доза - эффект» на фоне животных позитивного контроля, может служить признаком компенсаторной выработки медиаторов воспаления – простагландинов (PG), тромбоксанов (ТХА) и простациклинов (TGI):
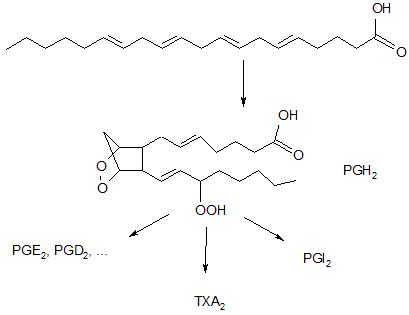
Дилатирующий эффект простагландинов, сочетанный со снижением образования и накопления гистамина и лимфокинов, может способствовать модификации воспалительного процесса. Это в свою очередь могло позитивно проявиться на клинике эрозивно-деструктивного полиартрита, развивающегося при аутоиммунных заболеваниях. Так, у животных с модельным адъювант-индуцированным РА, характеризуемым дегенеративными изменениями гиалинового хряща коленного сустава в виде истончения поверхностного слоя молодых хондроцитов, варьирующего от слабой до умеренной степени, очаговыми кровоизлияниями, ткани животных леченых групп сохраняют правильное строение. В промежуточной зоне хондроциты представлены изогенными группами, клетки округлой формы, ядра не увеличены. Признаков дистрофических изменений в субхондральной кости леченых животных также не отмечено.
Объективным проявлением корригирующего эффекта явилось дозозависимое повышение двигательной и ориентировочно-исследовательской активности животных, выявленное в модели «открытое поле». Сохранение на уровне контроля (негативного) количества двигательных актов у животных, получавших максимальную дозировку протекторов, свидетельствует о значительном облегчении симптомов и проявлений ревматоидного артрита.
Заключение
Комплексный подход к оценке профилактического действия смеси лимонной и янтарной кислот, включающий в себя результаты биохимических, гистологических и поведенческих исследований, позволяет рекомендовать эффективные и безопасные препараты в качестве иммуномодуляторов при аутоиммунных заболеваниях.
Библиографическая ссылка
Бадтиев А.К., Скупневский С.В., Пухаева Е.Г., Руруа Ф.К., Батагова Ф.Э., Фарниева Ж.Г. КОРРИГИРУЮЩИЙ ЭФФЕКТ СМЕСИ ЛИМОННОЙ И ЯНТАРНОЙ КИСЛОТ В МОДЕЛИ ИНДУЦИРОВАННОГО АУТОИММУННОГО РЕВМАТОИДНОГО АРТРИТА У КРЫС // Современные проблемы науки и образования. – 2020. – № 6. ;URL: https://science-education.ru/ru/article/view?id=30422 (дата обращения: 26.04.2024).