Несмотря на внедрение малоинвазивных технологий в абдоминальной хирургии, число открытых операций, особенно в ургентной хирургии, не уменьшилось. Одним из осложнений лапаротомий является образование послеоперационных грыж, которые регистрируются у 15-25% оперированных. Процент рецидивов увеличивается до 35% и более у больных с сопутствующей патологией (наличие системной дисплазии соединительной ткани, ожирение, сахарный диабет и др.). При этом нужно отметить, что более 50% рецидивов после вмешательства регистрируется в первые два года после операции [1].
Срединные вентральные грыжи в линейке наружных грыж составляют 17,5%. Хирургическое лечение рецидивов приводит к возврату заболевания от 3 до 22% оперированных [2-4]. В настоящее время стандартом хирургии срединных послеоперационных и рецидивных срединных грыж является герниопластика с использованием протезирующих материалов [5-7]. Широкое внедрение протезирующей герниопластики при срединных грыжах значительно улучшило результаты лечения этих больных, снижая частоту рецидива, улучшая качество жизни пациентов [8; 9].
Однако применение протезирующих материалов не всегда дает положительные результаты. Это касается, прежде всего, частоты раневых послеоперационных осложнений, достигающих, по данным ряда авторов, 21–49% и выше. По мнению исследователей, количество осложнений зависит от состава материала имплантата, его покрытия, тканевой реакции на него, расположения по отношению к анатомическим структурам передней брюшной стенки, брюшной полости. Инфекционные осложнения в области хирургического вмешательства наиболее часто встречаются в структуре осложнений. Частота их достигает выше 21,5% случаев. Как у нас в стране, так и за рубежом имеются исследования, в основе которых лежит нанесение на протез композиционных смесей, в состав которых входит высокодисперсное серебро, а также смеси йодопирона и мезогеля и пр. однако их применение связано с возрастанием стоимости как самих протезирующих имплантатов, так и в целом операции [10; 11].
В последнее время в современной герниологии определенным трендом является использование биологических имплантатов. Перспективными являются разработки по культивированию собственного коллагена на культуре тканей. Однако данные технологии являются очень дорогостоящими, кроме того, требуют значительного времени. В настоящее время наиболее часто в качестве биологического аутотрансплантата используется кожа пациента. Аутокожа подготавливается, с целью удаления ее дериватов, различными методами: термическим (метод В.Н. Янова), диатермоэлектрокоагуляцией либо лазерной абляцией. Недостатком всех этих методов является денатурация белков сетчатого слоя дермы вследствие воздействия высокой температуры. Это негативно сказывается на эластических свойствах имплантата и качестве его приживления [12].
Имеющиеся способы предупреждения раневой инфекции (периоперационное ведение антибиотиков, профилактика образования экссудата и др.) не в полной мере снижают инфекционные осложнения. Поэтому придание имплантату антимикробной активности к госпитальным штаммам бактерий в алгоритме профилактики раневых осложнений является очень важным.
Целью данного исследования явилось изучение бактерицидных и бактериостатических свойств деэпителизированного консервированного кожного аутотрансплантата, используемого для укрепления анатомических структур в хирургии срединных послеоперационных вентральных грыж.
Материал и методы исследования
Антибактериальную активность деэпителизированного консервированного свободного кожного аутотрансплантата в растворе оксигенированной воды и цефтриаксона изучали на наличие госпитальных штаммов бактерий на базе кафедры общей хирургии с курсом последипломного образования Астраханского ГМУ и сертифицированной бактериологической лаборатории ГБУЗ АО «ГКБ № 3» г. Астрахань. Были использованы клинические госпитальные изоляты грамотрицательных (Escherichia coli), неферментирующих бактерий (Pseudomonas aeruginosa) и грамположительных (Staphylococcus aureus). Выделение и идентификацию использованных культур возбудителей проводили с использованием анализатора VITEK 2 Compact 30 4700733 (Франция). Способность подавлять развитие микроорганизмов определяли методом диффузии в агаре. Исследования выполнены согласно рекомендациям Европейского общества по клинической микробиологии и инфекционным болезням «Определение чувствительности к антимикробным препаратам» диско-диффузионным методом EUCAST (версия 6.0, 2017 г.). Пограничные значения диаметров зон подавления роста калиброваны по отношению к гармонизированным европейским пограничным значениям, которые опубликованы EUCAST и расположены в свободном доступе.
В опытной группе исследования забор материала производился у больных во время операций при иссечении и формировании кожного аутоимплантата. Кожный лоскут подготавливался по оригинальной авторской методике, которая включала в себя его деэпителизацию дерматомом, консервацию в специальном растворе, содержащем антибиотик цефтриаксон (1 г) и оксигенированный препарат (50 мл) [13]. Консервирующая подготовка трансплантата проводилась в течение 60-80 минут после его забора. Масса аутотрансплантатов составляла 3±0,2 г. Проведено 30 исследований (рис. 1).
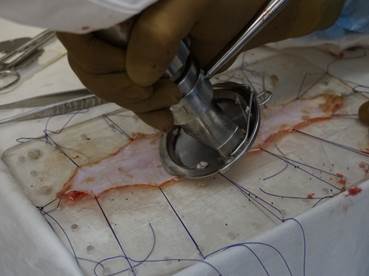 a
a  b
b
Рис. 1. Этапы подготовки аутодермального трансплантата (а – деэпителизация при помощи циркулярного дерматома, b - консервация в растворе)
Суточные культуры бактерий засевали шпателем на среду Мюллера – Хиптена (Санкт-Петербург) или Уро Агар в концентрации 105 КОЕ в 1 мл взвеси. С соблюдением правил подготовки инокулята и инокуляции чашек с агаром добивались формирования равномерного сплошного слоя бактериального роста (газон). Кусочки консервированного деэпителизированного кожного аутотрансплантата наносили на газон бактерий. Посев инкубировался в термостате на протяжении 18-24 часов при t 37 °С. При измерении зон подавления роста ориентировались на зону полного подавления роста микроорганизмов, определяемую невооруженным глазом при расположении чашки примерно в 30 см от глаз. Измерение зон подавления роста проводили с точностью до миллиметра при помощи штангенциркуля. По диаметру задержки роста определяли антимикробную активность. Отсутствие зоны задержки роста: бактерии не восприимчивы к препарату - R. Зона задержки роста диаметром выше 10 мм интерпретировалась как высокая чувствительность микробов. В качестве контроля мы использовали две группы по 30 исследований. В первой контрольной группе исследования использовали антибиотические диски, пропитанные препаратом цефтриаксон (1 г). Во второй контрольной группе использовали аутодермальный трансплантат, подготовленный по методике В.Н. Янова [14].
Статистическую обработку полученных данных проводили методами параметрической статистики с помощью программ SPSS 11.5, Statistica7.0, MS Exсel. Различия значений считали значимыми при уровне вероятности 95% (р≤0,05).
Результаты исследования и их обсуждение
Результаты исследования позволили установить, что консервированный по авторской методике деэпителизированный аутотрансплантат в консерванте, состоящем из оксигенированной воды и цефтриаксона в соотношении 50 мл оксигенированной воды и 1 грамм цефтриаксона, существенно повышает антимикробные свойства. Зона задержки роста в зависимости от возбудителя колебалась от 35 до 55 мм (рис. 2).
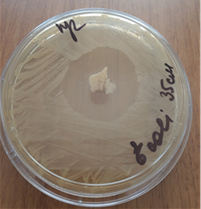 a
a 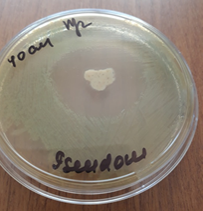 b
b 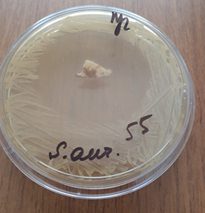 c
c
Рис. 2. Зоны подавления роста госпитальных изолятов (Escherichia coli – a, Pseudomonas aeruginosa – b, Staphylococcus aureus – с) с использованием деэпителизированного консервированного кожного аутотрансплантата
При сравнительном анализе антимикробного воздействия мы провели тест на чувствительность флоры на цефтриаксон. При интерпретации результатов в первой контрольной группе было установлено, что антимикробная активность дисков с цефтриаксоном была значительно меньше, чем воздействие на флору консервированного деэпителизированного аутотрансплантата. Она колебалась в зависимости от штаммов от 0,1 до 11 мм (рис. 3).
 a
a 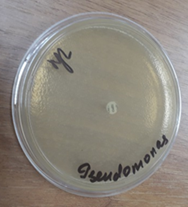 b
b 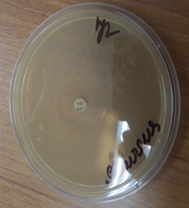 c
c
Рис. 3. Зоны подавления роста госпитальных изолятов (Escherichia coli – a, Pseudomonas aeruginosa – b, Staphylococcus aureus – с) с использованием антибиотических дисков (цефтриаксон 1,0)
Во второй контрольной группе с применением аутодермального трансплантата, приготовленного по методике В.Н. Янова, не отмечено зон подавления роста госпитальных изолятов (рис. 4).
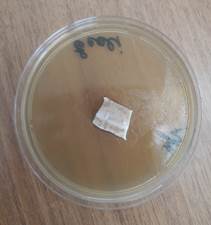 a
a 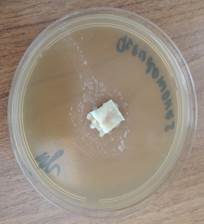 b
b  c
c
Рис. 4. Отсутствие зон подавления роста госпитальных изолятов (Escherichia coli – a, Pseudomonas aeruginosa – b, Staphylococcus aureus – с) с использованием аутодермального трансплантата, приготовленного по методике В.Н. Янова
Количественные данные, характеризующие антимикробные свойства деэпителизированного консервированного аутодермального трансплантата, в сравнении с антибиотическими дисками представлены в таблице.
Антимикробные свойства в группах исследования (p≤0,05)
|
Группы исследования (n=90) |
Зона подавления роста (мм) госпитальных изолятов |
||
|
Escherichia coli |
Pseudomonas aeruginosa |
Staphylococcus aureus |
|
|
Консервированный аутодермальный трансплантат (n=30) |
35,3±1,2* |
41,1±1,1* |
55,2±1,3* |
|
Антибиотические диски (цефтриаксон, 1 г) (n=30) |
8,6±0,5 |
0,12±0,4 |
11,3±0,3 |
|
Аутодермальный трансплантат по В.Н. Янову (n=30) |
R |
R |
R |
*- значения в группах при значении p≤0,05.
Таким образом, антимикробные свойства аутотрансплантата по сравнению с первой контрольной группой в отношении Escherichia coli были выше на 75,6%, в исследованиях со штаммами Pseudomonas aeruginosa – 99,5%, а при использовании в качестве изолята Staphylococcus aureus – 79,5%.
Сложность в анализе результатов состояла в том, что экспериментальные исследования, проводимые по антибактериальной активности применяемых имплантатов, очень немногочисленны. А работ по изучению антимикробной активности деэпителизированного свободного кожного аутотрансплантата в доступных источниках и электронных ресурсах мы не встречали.
В работах по антимикробной активности, в основном аллопротезов, отмечалось, что эта активность составляет от 7 до 20 мм в зависимости от возбудителя [15]. Проведенные исследования бактерицидных свойств деэпителизированного консервированного свободного кожного аутотрансплантата позволили установить его высокие бактерицидные свойства, которые были в зависимости от возбудителя в пределах 35–55 мм, т.е. в 3–5 раз выше, чем воздействие дисков, пропитанных цефтриаксоном.
Во второй контрольной группе, где исследовался аутодермальный имплантат по В.Н. Янову, антимикробных свойств в отношении госпитальных штаммов возбудителей отмечено не было. Данное обстоятельство можно рассматривать как неблагоприятный фактор для развития имплантационной инфекции в зоне операционного вмешательства.
Таким образом, на наш взгляд, пропитанный консервантом деэпителизированный кожный имплантат сохраняет свои высокие бактерицидные свойства за счет входящего в состав консерванта - оксигенированного препарата, который потенцирует действие антибактериального препарата.
Заключение
Данные экспериментального исследования говорят об аргументированности применения деэпителизированного консервированного свободного кожного имплантата в профилактике инфекционных осложнений в зоне хирургического вмешательства и о возможности более широкого его применения в хирургии вентральных грыж.
Библиографическая ссылка
Топчиев А.М., Топчиев М.А., Паршин Д.С., Мухтаров И.А., Смирнягина Е.О. ОЦЕНКА АНТИМИКРОБНОЙ АКТИВНОСТИ ДЕЭПИТЕЛИЗИРОВАННОГО КОНСЕРВИРОВАННОГО КОЖНОГО АУТОИМПЛАНТА, ПРИМЕНЯЕМОГО В ХИРУРГИИ СРЕДИННЫХ ВЕНТРАЛЬНЫХ ГРЫЖ // Современные проблемы науки и образования. – 2020. – № 5. ;URL: https://science-education.ru/ru/article/view?id=30214 (дата обращения: 20.04.2024).



