Проблема реформы высшего образования в России находится в центре общественного внимания. Следует отметить, что наряду с общими проблемами, возникающими при осуществлении образовательной деятельности, преподавание непрофильных дисциплин связано с дополнительными особенностями [1, 2]. Так, для студентов-физиков типично мнение, что химия не пригодится им в профессиональной деятельности. Такая же ситуация характерна и для некоторых западноевропейских стран. Согласно [3] только 4% выпускников средней школы выражают пожелание изучать химию в университете, при этом отрицательно оценивая полезность химии с точки зрения будущей карьеры. Как общий результат следует отметить тенденцию к снижению числа часов, отводимых на химию, что в сочетании с жесткими требованиями обязательной программы по этой дисциплине авторы [3] называли в числе возможных причин негативного отношения к ней.
О низком уровне химического образования у студентов непрофильных вузов свидетельствуют и результаты тестирования по химии [1, 4]. Однако химическая грамотность является компонентом научной грамотности [5]. Например, в [6] отмечено, что низкий уровень химического образования выпускаемых техническими вузами бакалавров и специалистов приводит в том числе и к нарастанию экологической угрозы при реализации современных проектов и технологий, а также препятствует формированию целостного восприятия природных и техногенных явлений, являющегося необходимым для обеспечения высокой профессиональной квалификации выпускников.
Целью данного исследования является разработка методики преподавания химии в непрофильном вузе, способствующей усилению мотивации к изучению дисциплины и, как следствие, повышению химической грамотности.
Материалы и методы исследования. Решению поставленной задачи способствует формирование представления о важности химии как в перспективе получения образования и построения карьеры, так и в повседневной жизни [3]. Это предполагает совершенствование методики преподавания, обеспечивающей укрепление связей между химией и профильными дисциплинами, а также демонстрирующей возможность применения полученных знаний на бытовом уровне.
Современная отечественная система высшего профессионального образования нацелена на передачу студентам не столько готовой информации по предмету, сколько методов ее получения, осмысления, преобразования и применения для дальнейшего саморазвития [7]. Здесь огромная роль принадлежит экспериментальной работе, в том числе той, которая может быть реализована факультативно. Так, в МИФИ практикуют факультативное проведение работы, связанной с использованием инструментального метода анализа (ICP-спектрометрии) при изучении темы «Разделение и очистка веществ» на примере карбонатной очистки урана [2], предложена методика обучения студентов химическому анализу на примере определения содержания витамина С в растениях, выращенных при использовании отличающихся по спектру источников освещения [8]. Однако к проведению факультативных занятий студенты привлекаются лишь выборочно. Поэтому при решении поставленной задачи первостепенное значение приобретает совершенствование лабораторных работ, входящих в обязательную программу курса химии.
Значение изучения химической кинетики в укреплении междисциплинарных связей. К числу разделов курса химии, наиболее тесно связанных с профильными для МИФИ дисциплинами (физикой, математикой, специальными курсами), относится химическая кинетика, причем это проявляется как в использовании близкого студентам-физикам языка, так и в существовании аналогий между изучаемыми в соответствующих курсах процессами.
В первую очередь следует отметить, что знание раздела «Химическая кинетика» непосредственно востребовано при изучении такой актуальной для специальных кафедр темы, как процесс радиоактивного распада. Для обучающихся по специальности «Биофизика» интерес представляет изучение каталитических процессов, в частности ознакомление с механизмом действия катализатора и ингибитора, поскольку использование модели ингибирования фермента продуктом позволяет делать выводы о последовательности присоединения к ферменту субстратов и образования продуктов. При изучении механизма ферментативных реакций кинетические кривые, необходимые для анализа, получают методом начальных скоростей, на примере которого, как правило, изучают химическую кинетику в лабораторном практикуме по химии для студентов первого курса. Этот пример представляется показательным, поскольку иллюстрирует возможность установления последовательности взаимодействия молекул за счет использования метода исследования, доступного даже тем, кто только начинает изучение химии. Отдавая дань возможностям химии, Р. Фейнман отмечал: «Чтобы узнать, как расположены атомы в какой-нибудь невероятно сложной молекуле, химик смотрит, что будет, если смешать два разных вещества! Да физик никогда не поверит, что химик, описывая расположение атомов, понимает, о чем говорит. Но вот уже больше 20 лет, как появился физический метод (метод появился в 1930-х гг. [примечание автора]), который позволяет разглядывать молекулы и описывать расположение атомов не по цвету раствора, а по измерению расстояний между атомами. И что же? Оказалось, что химики почти никогда не ошибаются!» [9]
Также в качестве примера междисциплинарных связей можно отметить аналогию между кинетикой химических и квазихимических реакций, поскольку многие процессы, протекающие в твердом теле (например, затухание люминесценции, термовысвечивание), можно трактовать в рамках модели Вагнера–Шоттки, рассматривающей их как результат квазихимического взаимодействия точечных дефектов кристаллов [10].
Наконец, следует иметь в виду, что привлекательной для студентов-физиков является востребованность при изучении кинетики математического аппарата, которым они владеют.
Совершенствование методов преподавания химической кинетики идет по нескольким направлениям. Внимание уделяется демонстрационным опытам, как, например, в [11], где рассматриваются реакция «иодных часов» и некоторые другие реакции. В [12, 13] обсуждены проблемы, возникающие при рассмотрении тем «Химическая термодинамика» и «Химическая кинетика». Настоящая работа посвящена обсуждению особенностей методики проведения лабораторной работы в рамках лабораторного практикума для студентов первого курса.
Кинетика разложения тиосульфата в сернокислой среде. Лабораторный практикум по кинетике в МИФИ, как и в ряде других вузов [7], основан на изучении скорости реакции
Na2S2O3+H2SO4→S↓+SO2↑+Na2SO4+H2O.
Здесь следует отметить, что у студентов может вызывать затруднение вопрос об определении мгновенной и средней скорости химической реакции, хотя, когда речь идет об аналогичном понятии из курса физики (о скорости движения), таких проблем не возникает. На наш взгляд, причина этого состоит в том, что математический аппарат, который студенты готовы привлечь при описании химических процессов, ограничивается только простейшими арифметическими или алгебраическими действиями. Однако именно при изучении кинетики химической реакции различие в средней и мгновенной скоростях может быть продемонстрировано весьма убедительно и обсуждается в ходе лабораторной работы.
Так, при ее выполнении о скорости судят по промежутку времени 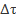 , который требуется для того, чтобы в объеме
, который требуется для того, чтобы в объеме 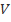 выделилось одно и то же для всей серии опытов количество серы
выделилось одно и то же для всей серии опытов количество серы 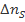 , приводящее к утрате реакционной системой прозрачности. По определению
, приводящее к утрате реакционной системой прозрачности. По определению
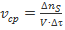 , откуда
, откуда 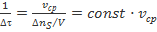 .
.
Однако следует иметь в виду, что если для мгновенной скорости, определяемой как
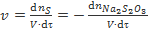 или
или 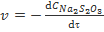 (при
(при 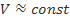 )
)
(где С – концентрация), в случае реакции первого порядка справедливо уравнение линейной зависимости 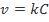 , то для величины
, то для величины 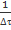 , характеризующей среднюю скорость реакции, решение дифференциального уравнения дает выражение
, характеризующей среднюю скорость реакции, решение дифференциального уравнения дает выражение 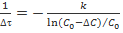 (
(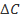 – это изменение концентрации тиосульфата за время
– это изменение концентрации тиосульфата за время 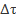 ).
).
При разложении в ряд функции 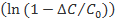 получим
получим
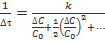 .
.
Если 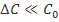 , и в знаменателе можно ограничиться первым членом ряда, то для величины
, и в знаменателе можно ограничиться первым членом ряда, то для величины 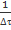 , характеризующей среднюю скорость, будет получено выражение
, характеризующей среднюю скорость, будет получено выражение 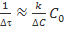 , аналогичное выражению для мгновенной скорости. Однако, если это не так, то есть условие
, аналогичное выражению для мгновенной скорости. Однако, если это не так, то есть условие 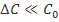 нарушается, то значения
нарушается, то значения 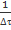 будут лежать ниже прямой
будут лежать ниже прямой 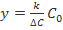 . Соответствующие расчетные кривые
. Соответствующие расчетные кривые 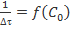 , полученные при различных значениях
, полученные при различных значениях 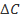 , выраженных, как и
, выраженных, как и 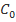 , в относительных единицах, приведены на рисунке. Здесь следует обратить внимание аудитории на то, что замена мгновенной скорости на среднюю может привести к получению ими нелинейной зависимости, хотя при малых величинах
, в относительных единицах, приведены на рисунке. Здесь следует обратить внимание аудитории на то, что замена мгновенной скорости на среднюю может привести к получению ими нелинейной зависимости, хотя при малых величинах 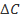 и при расширении диапазона изменения начальной концентрации нелинейность сглаживается и укладывается в погрешность эксперимента (рисунок).
и при расширении диапазона изменения начальной концентрации нелинейность сглаживается и укладывается в погрешность эксперимента (рисунок).
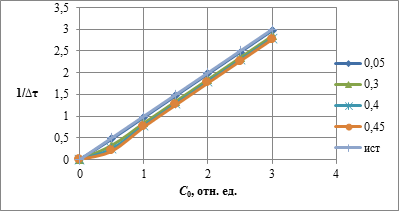
Зависимость величины 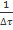 от начальной концентрации
от начальной концентрации 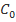 (в диапазоне от 0 до 3)
(в диапазоне от 0 до 3)
при значениях 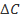 от 0,05 до 0,45. Линия «ист» соответствует зависимости, получаемой при
от 0,05 до 0,45. Линия «ист» соответствует зависимости, получаемой при 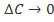
При проведении эксперимента стакан с реакционной смесью устанавливают на бумагу с рисунком и для определения величины 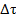 фиксируют момент, когда рисунок, рассматриваемый через реакционную смесь, станет неразличимым из-за выпадения осадка серы. Мы считали целесообразным при проведении опыта выбрать такие начальные концентрации реагентов, реакционный сосуд такого диаметра и такой трафарет, чтобы по крайней мере в отдельных случаях (на графиках только некоторых студентов) нелинейность обсуждаемой зависимости все-таки проявлялась. Во-первых, это позволяет продемонстрировать влияние выбора условий эксперимента на качество получаемых зависимостей и иллюстрирует роль методических погрешностей при проведении эксперимента. Во-вторых, важным представляется и то, что обучающиеся рассматривают проведение этого эксперимента в том числе и как тест на проверку остроты зрения (чем она выше, тем больше шансов, что нелинейность зависимости будет проявляться). В свою очередь, это мотивирует студентов к самостоятельному и добросовестному выполнению задания, а не к списыванию готовых результатов или к фальсификации полученных данных.
фиксируют момент, когда рисунок, рассматриваемый через реакционную смесь, станет неразличимым из-за выпадения осадка серы. Мы считали целесообразным при проведении опыта выбрать такие начальные концентрации реагентов, реакционный сосуд такого диаметра и такой трафарет, чтобы по крайней мере в отдельных случаях (на графиках только некоторых студентов) нелинейность обсуждаемой зависимости все-таки проявлялась. Во-первых, это позволяет продемонстрировать влияние выбора условий эксперимента на качество получаемых зависимостей и иллюстрирует роль методических погрешностей при проведении эксперимента. Во-вторых, важным представляется и то, что обучающиеся рассматривают проведение этого эксперимента в том числе и как тест на проверку остроты зрения (чем она выше, тем больше шансов, что нелинейность зависимости будет проявляться). В свою очередь, это мотивирует студентов к самостоятельному и добросовестному выполнению задания, а не к списыванию готовых результатов или к фальсификации полученных данных.
В целом получение большинством студентов линейной зависимости величины 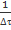 от начальной концентрации тиосульфата натрия при постоянном значении начальной концентрации серной кислоты позволяет сделать вывод о том, что для изучаемой реакции частный порядок по тиосульфату равен единице. В этом случае формально можно отметить, что он совпадает со стехиометрическим коэффициентом при тиосульфате в уравнении реакции. Однако, на наш взгляд, если ограничиться проведением только этого опыта, у обучающихся закрепляется ошибочное суждение, что порядок во всех случаях численно равен соответствующему стехиометрическому коэффициенту. Чтобы предотвратить подобное заблуждение, мы считали целесообразным дополнить лабораторную работу опытом по определению частного порядка по серной кислоте.
от начальной концентрации тиосульфата натрия при постоянном значении начальной концентрации серной кислоты позволяет сделать вывод о том, что для изучаемой реакции частный порядок по тиосульфату равен единице. В этом случае формально можно отметить, что он совпадает со стехиометрическим коэффициентом при тиосульфате в уравнении реакции. Однако, на наш взгляд, если ограничиться проведением только этого опыта, у обучающихся закрепляется ошибочное суждение, что порядок во всех случаях численно равен соответствующему стехиометрическому коэффициенту. Чтобы предотвратить подобное заблуждение, мы считали целесообразным дополнить лабораторную работу опытом по определению частного порядка по серной кислоте.
Было установлено, что изменение концентрации серной кислоты действительно влияет на скорость реакции, однако слабее, чем концентрация тиосульфата. Для определения численного значения частного порядка студентам предлагают подобрать линеаризованную форму кинетического уравнения, повторяя тем самым соответствующие разделы курса математики. Для серной кислоты определенный экспериментально порядок составляет примерно  , то есть не совпадает со стехиометрическим коэффициентом при соответствующем реагенте, что позволяет обучающимся сделать вывод о том, что рассматриваемая реакция является сложной.
, то есть не совпадает со стехиометрическим коэффициентом при соответствующем реагенте, что позволяет обучающимся сделать вывод о том, что рассматриваемая реакция является сложной.
По результатам проведенного исследования обучающиеся составляют кинетическое уравнение, вычисляя константу скорости k. Для этого следует использовать величины условных констант 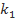 и
и 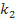 (
(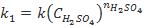 ,
, 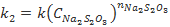 ), полученные при обработке данных о зависимости скорости реакции соответственно от начальной концентрации тиосульфата (при
), полученные при обработке данных о зависимости скорости реакции соответственно от начальной концентрации тиосульфата (при 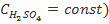 или серной кислоты (при
или серной кислоты (при 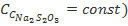 . Следует отметить, что значения k, вычисленные по значениям
. Следует отметить, что значения k, вычисленные по значениям 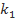 и
и 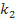 , совпадают в пределах ±15%. Здесь же обсуждается понятие «псевдопорядок реакции». Следует отметить, что многие студенты ошибочно предполагают, что псевдопорядок совпадает с частным порядком по тому компоненту, который взят в большом избытке. Для разъяснения этого вопроса также полезно привлечь математические выкладки.
, совпадают в пределах ±15%. Здесь же обсуждается понятие «псевдопорядок реакции». Следует отметить, что многие студенты ошибочно предполагают, что псевдопорядок совпадает с частным порядком по тому компоненту, который взят в большом избытке. Для разъяснения этого вопроса также полезно привлечь математические выкладки.
Для проверки составленного кинетического уравнения студенты получают дополнительное задание, состоящее в определении скорости реакции при таких концентрациях Na2S2O3 и H2SO4, которые не были использованы при проведении предшествующего опыта, но попадают в диапазон изученных значений концентраций, причем значения концентраций задают одинаковыми для всех студентов группы. Полученное экспериментально значение скорости сравнивают со значением, вычисленным по составленному ими кинетическому уравнению. На этой стадии работы появляется соревновательная составляющая, так как результаты, полученные разными студентами группы для системы одного и того же состава, сопоставляются.
Завершающим опытом этой лабораторной работы является изучение зависимости скорости реакции от температуры реагентов. Изучаемый интервал температур 25–50°С. Для получения более корректных результатов как исходные реагенты, так и ячейку, в которой проводят реакцию, термостатируют. По результатам опыта обучающиеся определяют энергию активации проведенной реакции, для чего используют линеаризованную форму уравнения Аррениуса. Подобная обработка экспериментальных данных позволяет в более полной степени использовать в курсе химии знания, полученные при изучении математики.
Заключение. Таким образом, вышеизложенное позволяет сделать вывод, что изучение химической кинетики в рамках лабораторного практикума по общей химии для студентов непрофильного (нехимического) технического вуза способствует формированию навыков обработки экспериментальных данных, которые будут востребованы в дальнейшей исследовательской работе по специальности. Кроме того, специфика выбранного объекта, то есть изучение понятия скорости на примере химической реакции, позволяет более наглядно раскрыть разницу между средними и мгновенными значениями величины, продемонстрировать, как отражается такая замена на получаемых экспериментально зависимостях, и оценить, при каком условии возможно использование средних значений вместо мгновенных. Наряду с модификацией лекционного курса, связанной с использованием при изучении законов химии примеров не только химических, но и квазихимических реакций, подобный подход к организации лабораторного практикума способствует повышению мотивации к обучению химии в непрофильном вузе и формированию у аудитории представления о существовании единого комплекса взаимосвязанных дисциплин.
Библиографическая ссылка
Глаголева М.А. ОСОБЕННОСТИ ИЗУЧЕНИЯ ХИМИЧЕСКОЙ КИНЕТИКИ В ФИЗИЧЕСКОМ ВУЗЕ // Современные проблемы науки и образования. – 2020. – № 5. ;URL: https://science-education.ru/ru/article/view?id=30174 (дата обращения: 19.04.2024).



