Головной мозг – уникальный орган, обладающий интенсивным метаболизмом, при этом не имеет собственных энергетических запасов. Главным субстратом образования энергии для мозга является глюкоза. Утилизация глюкозы в основном происходит в результате аэробного гликолиза, поэтому для нормальной работы мозга необходимо стабильное поддержание напряжения кислорода в крови. Системная мозговая циркуляция осуществляет доставку глюкозы, обеспечивая метаболизм мозга. Гипоксия и гипотония приводят к увеличению смертности лиц с тяжелой черепно-мозговой травмой (ЧМТ). По данным статистики, летальность у лиц с ЧМТ средней степени тяжести варьирует от 1,5 до 4%, и в случае утяжеления летальность достигает 60–70%. На сегодняшний день в Российской Федерации заболеваемость ЧМТ, по данным Минздрава, составляет 4‰. У лиц с черепно-мозговой травмой тяжелой степени зачастую причиной смерти становится сопутствующее ишемическое повреждение головного мозга [1, с. 102086]. Факторы, которые могут способствовать ишемическому повреждению головного мозга, включают анемию, гипоксию, гипотензию, повышенное внутричерепное давление, дислокацию мозга, спазм мозговых артерий вследствие субарахноидального кровоизлияния, длительные судорожные припадки и сердечно-легочную недостаточность. Наличие гипоксии (P02 <60 мм рт. ст.), гипотонии (систолическое артериальное давление <90 мм рт. ст.) и гиперкапнии (PC02> 45 мм рт. ст.) коррелирует с наступлением коматозных состояний в 37, 16 и 8% случаев соответственно [2, с. 7115]. К настоящему времени изучение механизмов травм и их лечения достигло колоссальнейших успехов, однако многие аспекты остаются не изученными, поэтому исследования в этой области остаются по-прежнему актуальными.
Целью нашего исследования было изучение особенностей неврологического дефицита у крыс при черепно-мозговой травме с сопутствующей гипоксией в 1-е сутки с момента повреждения.
Материалы и методы исследования
Исследование выполнено на 40 нелинейных белых крысах обоего пола массой 250-300 г. Все манипуляции с животными проводились в соответствии с Руководством по содержанию и использованию лабораторных животных [3]. Животным проводилось анестезиологическое пособие, включающее интраперитонеальное введение препаратов: «Золетил 100» (из расчета 8 мг/кг) и «Ксилазин» (из расчета 0,5 мл/кг). Модель острой нормобарической гипоксической гипоксии с гиперкапнией заключалась в помещении каждого животного в герметичный контейнер объёмом 1 л на 30 мин. [4, с. 16]. Моделирование черепно-мозговой травмы (ЧМТ) наркотизированным животным проводилось по следующей методике: в надорбитальной области слева над черепом производился разрез кожи, мышцы отделялись от кости, костная ткань очищалась от крови, стоматологическим бором производилось высверливание трепанационного окна диаметром 5 мм (локализация отверстия – на 5 мм ростральнее и 2,5 мм медиальнее брегмы). Устанавливался ударник, затем на ударник оказывал воздействие свободнопадающий груз в металлической трубке с заданной энергией, равной 0,07 Дж. После чего трепанационное окно закрывалось цементом для пломбирования, кожа подшивалась. Животные были разделены на четыре группы: группа 1 - только гипоксия (n = 10); группа 2 - только ЧМТ (n = 10); группа 3 – гипоксия +ЧМТ (n = 10), а также контрольная группа (n=10) – животные в этой группе не подвергались оперативным вмешательствам.
На аппаратном комплексе BIOPAC проводилось измерение парциального давления кислорода (Р02), углекислого газа (РС02) и среднего артериального давления в соответствии со стандартными методиками [5]. С целью оценки выраженности неврологического дефицита в 1-е сутки были применены тесты: «Открытое поле», «Стимулирование конечностей», «Приподнятый крестообразный лабиринт» [6] и тест Rota rod для оценки моторной координации (при постоянной скорости вращающего стержня V=20 об/мин.). В тесте Rota-rod мы фиксировали временной период 1-го падения животного со стержня и суммарное время удержания по результатам 3 попыток. Статистическую обработку полученных данных проводили при помощи пакета программ Statistica 6.0. Был применен параметрический t-критерий Стьюдента и критерий Манна-Уитни. Результаты представлены следующим образом, М ± m (М - среднее, m - ошибка среднего). Различия принимались за статистически значимые при p < 0,05.
Результаты исследования и их обсуждение
До начала эксперимента контрольный уровень среднего артериального давления был равен 102,24 ± 11,76 мм рт. ст., р<0,05. Нанесение черепно-мозговой травмы вызывало апноэ в течение 15–45 секунд в группе животных № 2, что сопровождалось статистически значимым повышением САД на 23%, р<0,05. В условиях травматического повреждения головного мозга, при котором происходит выброс биологически активных пептидов, возникают различные эффекты, в т.ч. и вазоактивные. В группе № 2 САД достигло контрольного уровня через 1,5 часа после травмы. На данном примере можем увидеть, что нарастающая гиперактивность протеолиза при повреждении мозговой ткани, как триггер системного воспалительного ответа, протекает с высвобождением вазодилатирующих веществ из разрушенных клеток и приводит к нарушению кровообращения. Прогрессирующие ишемические изменения быстро затрагивают и непораженные участки мозговой ткани, так, у крыс в группе № 3 САД статистически значимо снижалось до уровня 81,31 ± 15,21 мм рт. ст., р<0,05, в течение всего периода гипоксии.
Ключевой показатель обмена веществ – потребление кислорода. Динамика изменений индикаторов кислородтранспортной функции, собственно, и позволяет определить характер метаболических сдвигов, что особенно важно в условия нашего эксперимента. Анализ результатов показал, что во всех группах достижение нормоксии сопровождалось стабилизацией САД. Уровень P02 и PC02 в контрольной группе составляли 87,4 ± 6,2 и 38,5 ± 4,2 мм рт. ст. соответственно, р<0,05. Уровень потребления кислорода отражает степень тяжести состояния, особенно это актуально в условиях травматического шока. В группе животных № 2 статистически значимое снижение P02 на 36% до уровня 55,8±3,1 мм рт. ст., p<0,05, возможно, обусловлено нарушением адекватной тканевой перфузии. Нами установлено, что нанесение контролируемого ударного повреждения в сенсомоторную область через трепанационное окно у крыс приводит к стойкому неврологическому дефициту, наиболее выраженные клинические проявления отмечаются в первые 24 часа с момента повреждения (табл. 1).
Таблица 1
Поведенческие показатели у крыс в тесте «Открытое поле» совместно с показателями САД, P02, PC02
|
Показатель |
1 сутки |
|||
|
Контроль (n=10) |
1 группа. Гипоксия (n=10) |
2 группа. ЧМТ (n=10) |
3 группа. Гипоксия +ЧМТ (n=10) |
|
|
Тест «Открытое поле» |
|
|
|
|
|
Время в центре, с |
3,3±0,51 |
3,03±0,17٭ |
1,5±0,73٭ |
0,5±0,1 |
|
Число пересеченных квадратов, шт. |
12,9±1,33 |
12,3±1,45٭ |
7,3±2,2 |
5,9±0,5٭ |
|
Число дефекаций, шт. |
1,7±0,75 |
1,6±0,7 |
1,9±0,4٭ |
2,3±0,5٭ |
|
Число уринаций, шт. |
0,5±0,55 |
0,4±0,5 |
0,2±0,1 |
0,1±0,1 |
|
Время груминга, с |
6,3+1,55 |
5,4±1,07* |
3,4±1,5 |
0,7±0,67٭ |
|
Число вертикальных стоек, шт. |
4,1±0,65 |
3,9±0,6٭ |
2,89±0,6٭ |
1,8±0,8 |
|
Число заглядываний, шт. |
3,2±0,46 |
3,3±0,5 |
2,6±0,2٭ |
1,5±0,5٭ |
|
Время обнюхивания, с |
151,2±2,97 |
156,12±3,62٭ |
174,5±8,23٭ |
186,12±11,62٭ |
|
|
|
|
|
|
|
САД, мм рт. ст. |
102,24 ± 11,76 |
82,57 ± 9,96٭ |
123,45 ± 17,04* |
81,31 ± 7,21٭ |
|
P02, мм рт. ст. |
87,4 ± 6,2 |
74,9 ± 7,2٭ |
55,8±3,1٭ |
42,7±3,2٭ |
|
PC02, мм рт. ст. |
38,5 ± 4,2 |
43,5 ± 5,2٭ |
48,8±8,0٭ |
59,5 ± 4,2٭ |
Примечание: *- статистическая значимость отличия по отношению к показателям группы контроля при р<0,05.
У животных в 3-й группе выраженность неврологического дефицита напрямую связана с нарастанием расстройств в моторной и рефлекторной сферах. Большинство животных из этой группы находились в состоянии ступора, сохранялся экзофтальм и отсутствие фотореакции. Время груминга у животных 3-й группы было статистически значимо ниже на 90% в сравнении с группой контроля, р<0,05, а у 10% животных груминг отсутствовал, отмечено выраженное брадипноэ и нарастание гипоксии (цианоз конечностей). Зафиксированная нами преходящая артериальная гипотензия после травмы головного мозга приводит к вазодилятации, повреждению эндотелия, нарушению метаболизма в мышечной стенке сосудов головного мозга, что в свою очередь снижает чувствительность сосудов к гипотонии, гипоксии и гиперкапнии.
В тесте Rota rod в группах животных № 2 и № 3 зафиксировано проявление нарушений координации и силы (табл. 2). Статистически значимое снижение латентного периода 1-го падения у грызунов в группе № 3 составило уровень в 11±0,97 секунды, р<0,05. Менее выраженные изменения были выявлено у грызунов в группе № 1 (гипоксия).
Таблица 2
Время удержания животных на вращающемся стержне в тесте Rota rod
|
Группа Показатель |
Контроль (n=10) |
1 группа. Гипоксия (n=10) |
2 группа. ЧМТ (n=10) |
3 группа. Гипоксия +ЧМТ (n=10) |
|
Время удержания на вращающемся стержне за 1 попытку, с |
79±2,67 |
65±7,46 |
37±2,54* |
11±0,97* |
|
Время удержания на вращающемся стержне за 3 попытки, с |
165±5,34 |
135±4,78* |
71±2,87* |
44±2,05* |
Примечание: *- статистическая значимость отличия по отношению к показателям группы контроля при р<0,05.
В тесте «Стимулирование конечностей» показатели группы № 1 имели лучшие результаты, практически не имели выраженных двигательных нарушений передних и задних конечностей, двигательные функции конечностей восстановились в полном объеме спустя 1 час (табл. 3).
Таблица 3
Результаты теста «Стимулирование конечностей»
|
Показатель |
1 сутки |
|||
|
Контроль (n=10) |
1 группа. Гипоксия (n=10) |
2 группа. ЧМТ (n=10) |
3 группа. Гипоксия +ЧМТ (n=10) |
|
|
Тест «Стимулирование конечностей», балл |
14,00±0,00 |
12,00±0,00* |
4,3±0,57* |
0,9±0,1* |
Примечание: *- статистическая значимость отличия по отношению к показателям группы контроля при р<0,05.
Все крысы реагировали на защемление хвоста легким движением конечности перед травмой. Травматическое повреждение приводило к кратковременной ригидности конечностей. Только у 20% крыс с ударной травмой спустя 6 часов с момента травмы было выявлено сгибание передних конечностей, на противоположной стороне тела относительно участка повреждения.
Первым признаком восстановления после удара было спонтанное дыхание, которое возобновлялось в течение 60 секунд после удара. Неврологический дефицит был более выражен у животных в 3-й группе, восстановление функций наблюдалось через 4,5-5 часов с момента повреждающего воздействия. Животные из 2-й группы обычно начинали двигать конечностями через 1–3 часа после травмы. Движение у крыс 3-й группы (гипоксия + ЧМТ) были медленнее, и крысы часто спокойно лежали в своих клетках (рис.).
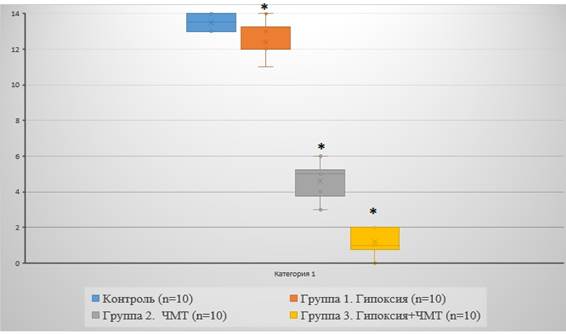
Функции передних и задних конечностей в тесте «Стимулирование конечностей», в баллах
В тесте «Приподнятый крестообразный лабиринт» нами установлено, что животные, получившие травматическое повреждение (группы животных № 2 и № 3) статистически значимо меньше времени проводили в открытых отсеках, прослеживается явная тенденция предпочтения животными темных отсеков, животные из группы № 3 находились в темном отсеке 185,4±7,2 секунды, что статистически значимо больше на 20% в сравнении с группой контроля, р<0,05. Количество посещений темных отсеков группами животных № 2 и № 3 было статистически значимо больше в сравнении с группой контроля на 12,8 и 25,5% соответственно, р<0,05 (табл. 4). Особенно обращает на себя внимание тот факт, что груминг и количество вертикальных стоек в открытых рукавах отсутствовали даже у животных в контрольной группе, этот показатель свидетельствует об уровне высокой тревожности и страха.
Таблица 4
Результаты теста «Приподнятый крестообразный лабиринт»
|
1 сутки |
Количество посещений, шт. |
Время пребывания, с |
Груминг, с. |
Количество вертикальных стоек, шт. |
|||||
|
Светлый отсек |
Темный отсек |
Светлый отсек |
Темный отсек |
Светлый отсек |
Темный отсек |
Светлый отсек |
Темный отсек |
||
|
Контроль (n=10) |
4,3 ±0,21 |
4,7 ±0,29 |
110,8 ±4,95 |
145,4± 6,41 |
- |
4,21 ±0,31 |
- |
7,63 ±0,43 |
|
|
1 группа. Гипоксия (n=10) |
3,9 ±0,43 |
6,5 ±0,49 |
93,8 ±7,94* |
155,4± 7,46* |
- |
4,29 ±0,43 |
- |
5,63 ±0,56* |
|
|
2 группа. ЧМТ (n=10) |
2,1±1,07* |
5,3±1,57* |
103,8 ±8,94* |
165,4± 9,4 |
- |
5,21 ±0,43* |
- |
2,7 ±0,71* |
|
|
3 группа. Гипоксия +ЧМТ (n=10) |
2,3 ±0,2* |
5,9 ±0,2* |
53,8 ±7,9* |
185,4± 7,2* |
- |
6,87 ±0,43* |
- |
1,09 ±0,3* |
|
Примечание: *- статистическая значимость отличия по отношению к показателям группы контроля при р<0,05.
Период нахождения в темных отсеках лабиринта и количество заходов в них характеризуется как тревожное расстройство, возможно, данные реакции обусловлены сочетанным влиянием стрессовой ситуации и травматического повреждения головного мозга.
Оценка неврологического дефицита при черепно-мозговой травме у крыс позволяет предположить, что ранняя гипоксия значительно ухудшает исход после повреждения головного мозга. Травма, вызванная ударным повреждением, сильно ослабляет способность мозгового кровотока компенсаторно увеличиваться во время гипоксии; это нарушение продолжает сохраняться в течение нескольких часов с момента возникновения ЧМТ. Наличие гипотонии (САД у животных в группе № 3 81,31 ± 7,21 мм рт. ст., р<0,05) во время гипоксии, возможно, способствует прогрессирующему ишемическому повреждению, хотя только нормобарическая гипоксическая гипоксия с гиперкапнией не вызывает стойкого неврологического дефицита. При черепно-мозговой травме в условиях нормобарической гипоксической гипоксии с гиперкапнией происходит активация анаэробного гликолиза. Анаэробный гликолиз, как 1-й этап патологической реакции, сопряжен с метаболическим ацидозом, способствует формированию локальных участков инфаркта мозга. Скорость метаболических процессов и ионного транспорта в условиях ацидоза снижается до минимума. Ионный гомеостаз клеток и процессы окисления энергетических субстратов нарушены и вызывают «субстратный голод». В условиях «субстратного голода» и энергодефицита (прекращение окислительного фосфорилирования) инициируется процесс накопления Ca2+ в клетке и отток К+ из клетки, и собственно запуск механизмов запрограммированной клеточной гибели нейронов, что и объясняет вышеописанные нарушения.
Заключение
Гипоксия диагностируется у 30-50% пациентов, поступивших в медицинские организации с диагнозом черепно-мозговая травма тяжелой степени, с последующим развитием комы, а ишемизированные участки головного мозга были обнаружены более чем у половины пациентов с ЧМТ, несовместимой с жизнью [1]. Результаты нашего исследования показали, что 30-минутный период острой нормобарической гипоксической гипоксии с гиперкапнией не вызывает стойкого неврологического дефицита. Комбинация гипоксии и черепно-мозговой травмы статистически значимо ведет к стойким неврологическим нарушениям, чем просто черепно-мозговая травма. Представленная модель ЧМТ с нормобарической гипоксической гипоксией с гиперкапнией поможет улучшить представление о механизмах развития посттравматических изменений, а также, возможно, может оказаться полезной в оценке эффективности фармакологической коррекции травм головного мозга в эксперименте.
Библиографическая ссылка
Инчина В.И., Коробков Д.М., Петрунин А.О. ИЗУЧЕНИЕ ОСОБЕННОСТЕЙ ВЫРАЖЕННОСТИ НЕВРОЛОГИЧЕСКОГО ДЕФИЦИТА У КРЫС C ЦЕРЕБРАЛЬНОЙ ПАТОЛОГИЕЙ ТРАВМАТИЧЕСКОГО ГЕНЕЗА И СОПУТСТВУЮЩЕЙ ГИПОКСИЕЙ В ОСТРОМ ПЕРИОДЕ // Современные проблемы науки и образования. – 2020. – № 3. ;URL: https://science-education.ru/ru/article/view?id=29794 (дата обращения: 19.04.2024).



