Проблема лечения пациентов, у которых грыжи сформировались со значительным уменьшением объема брюшной полости (loss domain), является весьма актуальной, что связано с высокими показателями продолжительности госпитализации, риска рецидива, частоты осложнений и летальности [1]. Существуют методики, позволяющие приблизиться к решению указанных вопросов. Данные способы базируются на технике разделения компонентов брюшной стенки (components separation technique – CST) [2]. Основным преимуществом последней является то, что в результате диссекции и мобилизации слоев передней брюшной стенки существенно увеличивается объем брюшной полости, что необходимо при выполнении пластики в ситуации loss domain. Однако сепарационные методики полноценно не изучены. Это связано с небольшим количеством проведенных исследований в рассматриваемой области, отвечающих требованиям доказательной медицины, с разным подходом к выполнению CST, с применением различных сетчатых эндопротезов, с нюансами ведения послеоперационного периода и ограниченным опытом выполнения подобных вмешательств у большинства хирургов [3]. В целом ряде случаев данные операции являются прерогативой одного-двух специалистов в клинике из-за сложностей в освоении технических навыков диссекции тканей, четкой идентификации слоев брюшной стенки, риска осложнений и отдаленных неблагоприятных последствий [4]. При анализе отечественной литературы было установлено, что опыт применения задней сепарационной пластики в РФ относительно небольшой [5]. Несмотря на очевидные перспективы реконструкции брюшной стенки с помощью сепарационных методик, известную техническую сложность их выполнения и наличие в клинической практике неоднозначных результатов, до настоящего времени практически не проводилось серьезных исследований данных методов на лабораторных животных.
Цель исследования: изучить возможность и исследовать особенности техники выполнения задней сепарационной протезирующей пластики брюшной стенки в остром эксперименте.
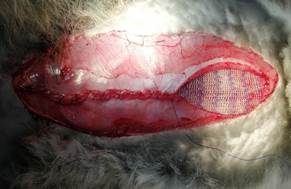
Материал и методы исследования. Эксперимент выполнен на базе кафедры общей, оперативной хирургии и топографической анатомии им. А.И. Кожевникова на 19 кроликах породы «Калифорнийский» и «Русская шиншилла» разного пола, массой от 2,5 до 4,5 кг с разрешения локального этического комитета – протокол № 7 от 05.07.2018 г. План исследования и его методика в полном объеме соответствовали приказу Минздрава РФ от 01.04.2016 г. № 199н и отвечали основным положениям концепции 3R (reduction, refinement, replacement), признанной в экспериментальной хирургии и биологии [6]. В остром эксперименте создавали грыжевой дефект разного размера – от 14 до 18 см в длину и от 8 до 12 см в ширину. Изучали особенности техники задней протезирующей сепарационной пластики, используя сетки из полипропилена отечественного производства (ES3030). Эндопротез размещали типично [3, 7]. Сетку фиксировали узловыми швами монофиламентной полипропиленовой нитью 5/0. Операции выполнены в условиях общей анестезии препаратами золетил 100 (25 мг/кг) и ксилавет (3 мг/кг) внутримышечно. До и в ходе эксперимента каждому животному проводили измерение площади передней брюшной стенки, грыжевого дефекта, объема талии и вычисляли соотношение в процентах площадей дефекта и переднебоковой стенки живота. Фиксировали продолжительность оперативного вмешательства. Техника оперативного вмешательства соответствовала основным принципам методики transversus abdominis muscle release (TAR) [7]. Выполняли срединный доступ. Обнажали белую линию живота. Отступив от нее латерально 2 мм, рассекали влагалище прямой мышцы на протяжении до 20 см, выполняли ретромускулярную диссекцию (рис. 1). Затем визуализировали поперечную мышцу живота и на 1 см кнаружи от медиального края данной мышцы рассекали ее волокна и продолжали диссекцию под мышцей в латеральном направлении до 11–12 см от срединной линии живота (рис. 2). В ходе работы на данном этапе нередко возникали трудности, связанные с очень тонким строением передней брюшной стенки кролика, особенно подлежащих структур, что нередко являлось причиной непреднамеренного проникновения в брюшную полость и образования отверстий в заднем отсепарованном слое. Большие дефекты приходилось ушивать полипропиленовой нитью, а маленькие (до 0,5 см в диаметре) оставляли in situ. Все этапы выполняли билатерально. Затем выкраивали дефект (рис. 3) в брюшной стенке и последовательно его ушивали непрерывным швом полипропиленовой нитью 2/0. На восстановленный задний листок (рис. 4) укладывали сетку, которую фиксировали узловыми швами полипропиленовой нитью 5/0 в нескольких местах. Поверх сетки соединяли передние листки влагалищ прямых мышц полипропиленовой нитью 2/0, восстанавливая их нормальное анатомическое положение (рис. 5), послойно ушивали рану. Этапы выполнения задней сепарации с последующей реконструкцией передней брюшной стенки показаны на рисунках 1–5. Животных выводили из эксперимента путем воздушной эмболии 7 мл/кг в краевую вену уха под наркозом. Полученные данные изучали в программе Statistica 10.0. Распределение данных исследовали тестами Shapiro–Wilk и Lilliefors, в зависимых выборках применяли t-критерий Wilcoxon, в независимых – Mann–Whitney. Для выявления взаимосвязи между двумя количественными показателями использовали коэффициент ранговой корреляции rxy Spearman. Исходя из полученного значения rxy определяли тесноту связи по шкале Чеддока и ее направление (прямая или обратная). Отличия считали достоверными при p<0,05.
|
|
|
|
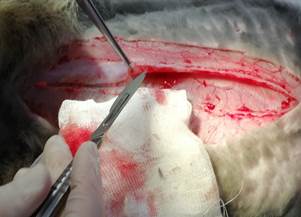
Рис. 1. Ретромускулярная диссекция |
Рис. 2. Препаровка между поперечными мышцей и фасцией |
|
|
|
|
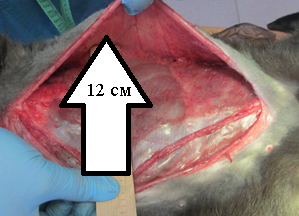
Рис. 3. Модель грыжевого дефекта брюшной стенки |
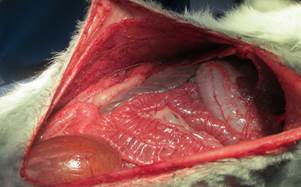
Рис. 4. Восстановленный задний отсепарованный листок |
|
|
|
|
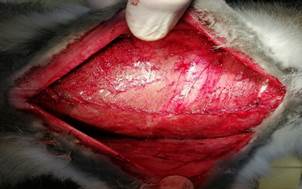
Рис. 5. Ушивание передних листков влагалищ прямых мышц живота |
Результаты исследования и их обсуждение. Применение задней сепарационной пластики на выбранной модели оказалось исключительно трудным в техническом отношении, что связано с минимальной толщиной слоев брюшной стенки у кролика. Особенно сложным представлялось избежать формирования дефектов в заднем отсепарированном слое, проникающих в брюшную полость. По мере накопления опыта и совершенствования техники стало возможным провести адекватное пересечение поперечной мышцы, выполнить TAR без нарушения целостности подлежащих слоев брюшной стенки и избежать контакта с полостью живота. Установили, что предельная ширина грыжевых ворот для кролика, позволяющая восстановить задний листок, составляла 10 см, так как более широкий дефект оказалось сложнее технически закрыть из-за высокого риска прорезывания швов. Среднее значение массы животного составляло 3,57±0,11 кг, 95%-ный доверительный интервал (ДИ) 3,35–3,79 кг. Длина грыжевого дефекта была равна 15±0,19 см, 95%-ный ДИ 14,62–15,38 см, ширина – 10,47±0,36 см, 95%-ный ДИ 9,75–11,19 см. Продолжительность оперативного вмешательства составляла 120,21±2,85 мин, 95%-ный ДИ 114,51–125,91 мин. Данные отражены в таблице и на диаграмме (рис. 6).
Анализ параметров измерений
|
Название измерения |
Min |
Q1 |
Median |
Mean |
SD |
Q3 |
Max |
|
Масса животного, кг |
2,5 |
3,4 |
3,5 |
3,57 |
0,5 |
4 |
4,5 |
|
Исходная окружность талии, см |
31 |
34 |
35 |
35,47 |
2,41 |
38 |
40 |
|
Окружность талии после операции, см |
29 |
30 |
32 |
32,63 |
2,24 |
35 |
36 |
|
Уменьшение объема талии в см |
1 |
2 |
3 |
2,84 |
1,01 |
4 |
4 |
|
Площадь брюшной стенки, см2 |
237 |
255 |
265,5 |
266,92 |
19,51 |
275 |
316 |
|
Площадь грыжевого дефекта, см2 |
94,2 |
117,75 |
117,75 |
123,08 |
17,86 |
131,88 |
176,63 |
|
Отношение площади дефекта к поверхности брюшной стенки, % |
33,76 |
43,13 |
44,72 |
46,36 |
7,6 |
49,77 |
66,53 |
|
Длина грыжевого дефекта, см |
14 |
15 |
15 |
15 |
0,82 |
15 |
18 |
|
Ширина грыжевого дефекта, см |
8 |
10 |
10 |
10,47 |
1,58 |
12 |
15 |
|
Длительность операции, минуты |
100 |
110 |
120 |
120,21 |
12,43 |
130 |
150 |
Примечание. Min – минимальное значение; Q1 – первый квартиль; Median – медиана; Mean – среднее арифметическое; SD – стандартное отклонение; Q3 – третий квартиль; Max – максимальное значение.
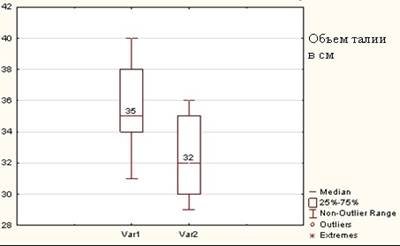
Рис. 6. Окружность талии животных до и после эксперимента.
По горизонтали: Var 1 – исходная длина окружности талии животного; Var 2 – тот же параметр после операции, по вертикали – шкала в сантиметрах
При сравнении окружности талии животного до операции медиана была равна 35 см, интерквартильный размах (ИКР) – 34–38 см, после закрытия дефекта медиана составила 32 см, ИКР – 30–35 см. Наблюдаемое уменьшение объема талии кролика было статистически значимым, р=0,000132 (t-критерий Wilcoxon). Связь между площадью грыжевого дефекта и уменьшением талии животного после операции была статистически незначимой, р=0,058169 (Spearman). Было установлено, что размер ширины грыжевого дефекта не определяет величину уменьшения талии после операции, р=0,643429 (Mann–Whitney). По шкале Чеддока выявлена умеренная прямая корреляция между массой животного и площадью передней брюшной стенки животного, r=0,479, р =0,0339 (Spearman).
Выполнение TAR у лабораторных животных следует признать технически сложной и трудоемкой процедурой, требующей постоянного внимания и совершенствования хирургической техники. Передние брюшные стенки кролика и человека имеют близкое анатомическое строение, однако необходимо отметить особенности переднебоковой стенки живота изучаемого животного, которые следует учитывать при выполнении задней сепарационной пластики. Обращает на себя внимание отсутствие предбрюшинной клетчатки, поэтому брюшина и поперечная фасция как единый слой припаяны к белой линии живота и достаточно плотно прилежат к поперечным мышцам живота. Мышечный каркас очень тонкий, всего около 3–4 мм. Толщина каждой косой мышцы чуть более 1 мм. Ретромускулярная диссекция ниже дугообразной линии весьма проблематична из-за минимальной толщины задней стенки влагалища прямой мышцы в этой зоне. С указанной особенностью встречаются многие хирурги при выполнении TAR в клинической практике [8]. В ходе работы при пересечении поперечной мышцы и осуществлении диссекции под ней часто возникали трудности, связанные с непреднамеренным проникновением в брюшную полость из-за небольшой толщины подлежащих фасции и брюшины. Данная проблема актуальна и активно обсуждается зарубежными исследователями [9]. Одни авторы предлагают ушивать перфорации в заднем слое викрилом, чтобы избежать осложнений, связанных как с контактом кишечника и сетки, так и с формированием внутренних грыж между данным слоем и эндопротезом [10]. Другие предлагают оригинальные подходы к осуществлению TAR, учитывающие особенности анатомического расположения предбрюшинной клетчатки, позволяющие избегать формирования дефектов брюшины [11]. Выполнение задней сепарации требует от хирурга особой тщательности и внимания, отличных знаний топографии передней брюшной стенки, умения идентифицировать ее слои, идеальных мануальных навыков. Освоение данной техники представляет собой весьма трудоемкий и длительный процесс. Данная точка зрения не противоречит сведениям, опубликованным зарубежными авторами [4]. Отработка сепарационных методик на лабораторных животных шаг за шагом дает реальное представление об особенностях работы с тканями, ответственности за живой организм и является важным подспорьем для обучения будущих хирургов.
Заключение. В рамках настоящего исследования удалось впервые осуществить заднюю сепарационную протезирующую пластику у кроликов. В остром эксперименте изучили возможность и исследовали особенности техники выполнения TAR step by step, получили определенный опыт диссекции в пространствах брюшной стенки, бережного обращения с живыми тканями, выполнения гемостаза, наблюдения и понимания собственных ошибок, способов их исправления и профилактики. Установлено, что изменение размера ширины грыжевого дефекта от 8 см до 15 см не связано с величиной уменьшения объема талии после операции, но выявлена умеренная прямая корреляционная взаимосвязь между массой животного и площадью его переднебоковой стенки живота. Показано, что передняя брюшная стенка кролика по ряду характеристик соответствует анатомическому строению человека, следовательно, данное животное может быть использовано для изучения задней сепарационной пластики.
Библиографическая ссылка
Паршиков В.В., Зарубенко П.А., Базаев А.В., Мухин А.С., Бояршинов А.А., Малашин И.С. РЕКОНСТРУКЦИЯ БРЮШНОЙ СТЕНКИ С ПОМОЩЬЮ ЗАДНЕЙ СЕПАРАЦИОННОЙ ПРОТЕЗИРУЮЩЕЙ ПЛАСТИКИ В ЭКСПЕРИМЕНТЕ // Современные проблемы науки и образования. – 2020. – № 2. ;URL: https://science-education.ru/ru/article/view?id=29627 (дата обращения: 16.04.2024).