В настоящее время большим признанием пользуется концепция иерархического строения ткани опухолей. Данная концепция гласит, что лишь небольшая субпопуляция медленно пролиферирующих клеток, - так называемые опухолевые стволовые клетки (ОСК), - обладающих способностью к самовозобновлению и дифференцировке в другие типы клеток, дает начало основной массе быстро пролиферирующих клеток опухоли и лежит в основе устойчивости опухоли к химио- и лучевой терапии [1]. Именно на исследование биологии опухолевых стволовых клеток возлагаются большие надежды в связи с поиском новых высокоэффективных средств борьбы против рака [2].
Опухолевые стволовые клетки впервые были описаны в 90-е годы ХХ века при исследовании лейкемии [3]. В последующее десятилетие ОСК были выделены также и из солидных опухолей, в том числе и из ткани рака молочной железы [4; 5]. На настоящий момент накоплен обширный объем знаний об особенностях метаболизма, взаимодействия с микроокружением и внеклеточным матриксом опухоли и других характерных чертах ОСК [1]. Тем не менее существует ряд препятствий, ограничивающих экспериментальную работу с ОСК. Основными проблемами по-прежнему остаются полнота и чистота выделения из ткани опухоли пациентов фракции клеток, обладающих стволовыми свойствами. Во-первых, в процессе дезагрегации ткани необходимо в достаточной мере произвести разрушение всех микрокомпартментов опухоли, в которых могут находиться ОСК: околососудистые ниши, участки десмопластической трансформации ткани опухоли, очаги воспалительной реакции и др. Так как механическая дезагрегация может привести к неполному высвобождению клеток из областей с повышенной плотностью внеклеточного матрикса, то ферментативное разрушение ткани является более предпочтительным. К тому же применение протеаз, расщепляющих белки внеклеточного матрикса, как правило, является более мягким воздействием и позволяет получить более высокий выход жизнеспособных клеток по сравнению с механическим измельчением ткани. Однако использование протеолитических ферментов может привести к разрушению внеклеточных эпитопов мембранных белков-маркеров стволовости, что, в свою очередь, снизит эффективность очистки искомой клеточной фракции методами иммуномагнитного или флуоресцентно активированного клеточного сортинга. Сохранность поверхностных эпитопов при ферментативной дезагрегации ткани зависит от специфичности используемых протеаз, их чистоты и режима инкубации. Таким образом, при разработке эксперимента с первичными культурами ОСК следует провести предварительные исследования по подбору оптимальных условий ферментативной диссоциации ткани опухоли для достижения оптимальных показателей чистоты и полноты выделения исследуемой фракции клеток из материала пациентов при сохранении их высокой жизнеспособности. На настоящий момент наиболее охарактеризованной клеточной субпопуляцией, обладающей свойствами ОСК в раке молочной железы, является фракция клеток, несущая фенотип CD24low/-CD44+ [6; 7], именно на ней мы и остановимся в своем исследовании.
Цель исследования: усовершенствовать протокол выделения ОСК из ткани рака молочной железы путем подбора оптимального режима культивирования ткани в растворе коллагеназы.
Материал и методы исследования. Материалом для исследования послужил образец ткани рака молочной железы, полученный во время радикальной операции по удалению опухоли. Работа была одобрена этическим комитетом ФГБУ «РНИОИ» Минздрава России, протокол № 33/1 от 29.11.2018 г. Донор подписал информированное согласие. Ткань опухоли помещали в стерильный раствор Хэнкса («Биолот», Россия) в операционной непосредственно после иссечения и обрабатывали в течение 2 часов. В первый день производили измельчение ткани опухоли на фрагменты до 1 мм в диаметре при помощи стерильных хирургических лезвий, предварительно из образца удаляли участки некроза и здоровой ткани. Полученные фрагменты ткани опухоли равномерно распределяли на 4 чашки Петри диаметром 6 см и помещали в среду DMEM (Gibco, США) в следующих вариантах: без коллагеназы и с добавлением коллагеназы, полученной из гепатопанкреаса краба («Биолот», Россия, арт. 1.4.8.1), до конечной концентрации 150, 300 и 450 ед./мл.
Далее образцы культивировали 48 часов при 37 °С и 5,5% СО2. Визуализацию и фотофиксацию образцов осуществляли через 24 и 48 часов. На вторые сутки производили выделение клеток из образцов опухоли с добавлением коллагеназы в соответствии со следующим протоколом.
1. К образцу добавляли 5 мл DMEM и производили энергичное пропускание размягченных фрагментов ткани через 10-мл наконечник (10 раз) и далее через 5-мл наконечник (10 раз).
2. Полученную суспензию, включая неразложившиеся остатки ткани опухоли, пропускали через нейлоновые фильтры с диаметром ячейки 70 мкм.
3. Трижды производили отмывку полученной клеточной суспензии в 5-кратном объеме буфера для сепарации клеток (MACS separation buffer, Miltenyi Biotech, Германия).
4. Подсчет клеток осуществляли в камере Горяева с 0,1% раствором трипанового синего под микроскопом инвертированным биологическим Leica DM IL LED.
Образец сравнения, который культивировали в отсутствие коллагеназы, измельчали в Medimachine (BD, США), и далее, начиная с п. 2, протокол выделения клеток не отличался от такового для образцов с коллагеназой.
Оценку влияния процесса ферментативной дезагрегации ткани на сохранность иммунофенотипа ОСК рака молочной железы (CD24low/-CD44+) производили на проточном цитометре BD FacsCanto II (BD, США) с антителами PE Mouse Anti-Human CD24 (клон ML5; BD, США) и FITC Mouse Anti-Human CD44 (клон G44-26; BD, США).
Результаты исследования и их обсуждение. По мере увеличения срока культивирования отмечалось постепенное размягчение образцов ткани опухоли молочной железы, находившихся в среде с добавлением коллагеназы, при этом увеличивалось количество переходящих в среду клеток, росла вязкость раствора и уменьшалась его прозрачность. На фотографиях образцов видно, что увеличение концентрации коллагеназы ведет к резкому росту количества перешедших в раствор клеток (рис. 1).
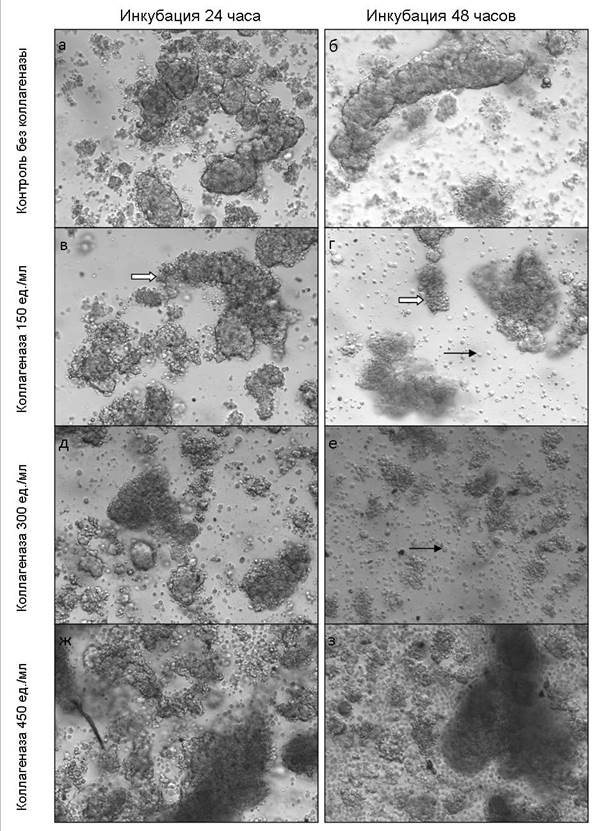
Рис. 1. Вид фрагментов ткани опухоли молочной железы в контроле и после инкубации с раствором коллагеназы в среде DMEM в трех концентрациях: а – контроль без коллагеназы, культивирование 24 часа; б – контроль без коллагеназы, культивирование 48 часов; в – концентрация коллагеназы 150 ед./мл, культивирование 24 часа; г - концентрация коллагеназы 150 ед./мл, культивирование 48 часов; д – концентрация коллагеназы 300 ед./мл, инкубация 24 часа; е - концентрация коллагеназы 300 ед./мл, культивирование 48 часов;
ж – концентрация коллагеназы 450 ед./мл, культивирование 24 часа; з - концентрация коллагеназы 450 ед./мл, культивирование 48 часов. Чёрными стрелками обозначены единичные клетки, белыми стрелками обозначены фрагменты ткани. Увеличение х100
Тем не менее полного разложения волокон коллагена на вторые сутки все же не произошло, и большая часть материала не поддалась дезагрегации даже при высоких концентрациях коллагеназы.
Подсчет клеток в камере Горяева показал, что общее количество выделенных клеток увеличивается с ростом концентрации коллагеназы почти экспоненциально. При этом по данным теста с трипановым синим жизнеспособность клеток с ростом концентрации коллагеназы существенно не меняется и составляет в среднем примерно 50%, что на порядок выше по сравнению с механической диссоциацией (4%) (табл.).
Результаты подсчета клеток в камере Горяева с применением 0,1% раствора трипанового синего через 48 часов культивирования с коллагеназой и без нее
|
Концентрация фермента |
Количество живых клеток, х106 |
Общее количество клеток, х106 |
Доля живых клеток, % |
|
Без коллагеназы (механическая диссоциация) |
0.34 |
8.51 |
4 |
|
Коллагеназа 150 ед./мл |
1.83 |
3.2 |
57 |
|
Коллагеназа 300 ед./мл |
2.83 |
6.06 |
47 |
|
Коллагеназа 450 ед./мл |
5.95 |
11.35 |
53 |
Увеличение количества выделяемых живых клеток тем не менее сопровождалось существенным уменьшением экспрессии маркеров ОСК рака молочной железы - трансмембранных гликопротеинов CD44 и CD24. По данным проточной цитометрии, спустя 48 часов после культивирования образцов ткани в растворе коллагеназы количество клеток, экспрессирующих CD44, уменьшается пропорционально концентрации фермента и в сравнении с контролем составляет от 3- до 10-кратного уменьшения в образцах с концентрацией коллагеназы 150 и 450 ед./мл соответственно (рис. 2а).
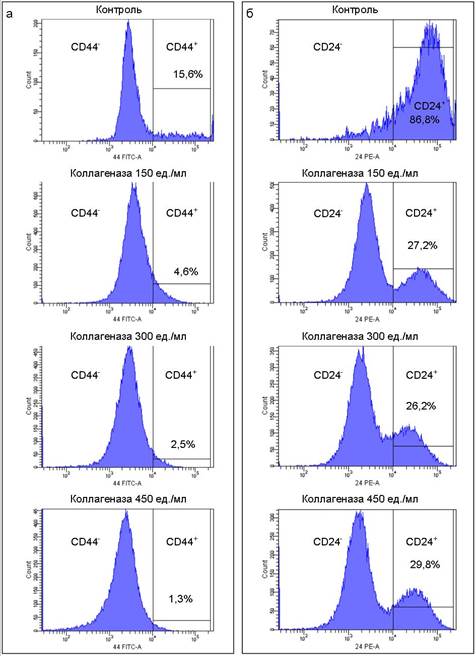
Рис. 2. Доля клеток опухоли, экспрессирующих поверхностные белки-маркеры ОСК после инкубации в течение 48 часов в растворах коллагеназы в сравнении с контролем. Данные приведены для клеточной субпопуляции отрицательной по CD45 (общий лейкоцитарный антиген): а – данные проточной цитометрии для CD44; б – данные проточной цитометрии для CD24
Полученные данные говорят о том, что длительное культивирование с исследуемой коллагеназой оказывает негативное влияние на полноту выделения из ткани рака молочной железы клеток, обладающих фенотипом CD44+. Учитывая, что уровень экспрессии этого маркера в ткани опухоли изначально довольно низкий, таргетная популяция клеток может быть полностью потеряна при слишком жестких режимах ферментативной диссоциации. Кроме того, в исследуемых образцах наблюдается угнетение экспрессии CD24 по сравнению с контролем, что неизбежно приведет к снижению чистоты выделения субпопуляции с фенотипом CD24low/-CD44+. На гистограмме видно, что после культивирования с коллагеназой единый пик в области положительной экспрессии данного маркера разбивается на два и появляется выраженный пик, соответствующий отрицательной по данному маркеру популяции клеток (рис. 2б). Таким образом, длительная обработка ткани исследуемой коллагеназой может привести к контаминации выделенной отрицательной по CD24 фракции клетками, в действительности несущими фенотип CD24+.
Заключение. По результатам проведенного исследования можно сделать ряд выводов. Во-первых, культивирование ткани в растворе коллагеназы из гепатопанкреаса краба («Биолот», Россия) является более эффективным методом получения жизнеспособных клеток из ткани рака молочной железы по сравнению с простой механической диссоциацией и может быть применено для решения широкого круга исследовательских задач, где требуется получение большого количества клеток из послеоперационного материала. Во-вторых, так как жизнеспособность получаемых клеток остается постоянной при различных режимах обработки коллагеназой в диапазоне концентрации от 150 до 450 ед./мл и при культивировании от 24 до 48 часов, то итоговый протокол может быть модифицирован в широких пределах для получения наилучшего результата с учетом плотности ткани опухоли и возможности для обработки материала в лаборатории. В-третьих, как оказалось, применение исследуемой коллагеназы при длительной инкубации приводит к изменению иммунофенотипа ОСК рака молочной железы, что может отразиться на чистоте и полноте выделения субпопуляции CD24low/-CD44+ методами иммуномагнитного или флуоресцентно активированного клеточного сортинга, и, как следствие, результаты последующих экспериментов с выделенными клетками опухоли могут быть скомпрометированы. Также мы предполагаем, что подобный тип ферментативной обработки с использованными нами реагентами и концентрациями, скорее всего, будет провоцировать слущивание и других поверхностных антигенов независимо от типа ткани. В качестве решения проблемы повышения клеточного выхода при сохранении поверхностных маркеров ОСК мы предлагаем применять укороченное культивирование ткани (до 12 часов) в растворе исследуемой коллагеназы в сочетании с низкоинтенсивной механической обработкой.
Библиографическая ссылка
Филиппова С.Ю., Ситковская А.О., Сагакянц А.Б., Бондаренко Е.С., Ващенко Л.Н., Кечеджиева Э.Э., Дашкова И.Р. ВЫДЕЛЕНИЕ ОПУХОЛЕВЫХ СТВОЛОВЫХ КЛЕТОК РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ С ПРИМЕНЕНИЕМ КОЛЛАГЕНАЗЫ // Современные проблемы науки и образования. – 2019. – № 6. ;URL: https://science-education.ru/ru/article/view?id=29367 (дата обращения: 19.04.2024).



