В структуре онкозаболеваемости России у женщин рак шейки матки (РШМ) занимает 5-е ранговое место, а прирост заболеваемости составляет 24,68% за последнее десятилетие [1]. Рост заболеваемости неуклонно растет, и стандартизованные показатели в 2007 г. составляли 12,5, в 2013 г. - 14,2, а в 2017 г. – 15,8 на 100 тыс. населения.
Основным методом лечения при местно-распространенном раке шейки матки (МРРШМ) является лучевая терапия [2]. Так, больные раком шейки матки II стадии в 69,5% подвергаются сочетанной лучевой терапии, а при III стадии - в 96,2% [3]. Применение комбинированного химиолучевого лечения МРРШМ сопряжено с непосредственными или отдаленными побочными эффектами со стороны различных систем организма [4].
Химиотерапевтическое лечение чаще проводится у больных метастатическим и рецидивирующим раком шейки матки, имеющих неблагоприятный прогноз [5]. Однако в исследованиях показано, что включение в схему комплексного лечения химиотерапии значительно улучшает результаты лечения больных МРРШМ, что выражается в уменьшении размеров опухоли и, следовательно, способствует онкологическому радикализму при хирургических вмешательствах и, как следствие, снижает процент рецидивирования и метастазирования РШМ [6]. Благодаря использованию химиотерапии в неоадъювантном варианте у больных МРРШМ возможно в дальнейшем сочетание ее с лучевой терапией и перевод неоперабельных пациентов в резектабельное состояние [7; 8]. Некоторые исследования продемонстрировали положительное влияние применения неоадъювантной химиотерапии МРРШМ на показатели общей и безрецидивной выживаемости [9; 10].
Противоопухолевый эффект бевацизумаба связан с его антиангиогенным воздействием на опухоли. Как известно, представитель семейства васкулоэндотелиальных ростовых факторов VEGF-А играет значительную роль в неопластическом ангиогенезе злокачественных опухолей [11], в том числе и при раке шейки матки [12]. Добавление к химиотерапии бевацизумаба улучшает отдаленные результаты лечения при использовании как платиносодержащих, так и бесплатиновых комбинаций [13]. Некоторые работы показывают, что бевацизумаб может улучшать перфузию и доставку лекарств в опухолевые ткани [14; 15].
Целью явилось изучить влияние неоадъювантной химиотерапии самостоятельно и в сочетании с бевацизумабом на экспрессию маркеров пролиферации и апоптоза в ткани плоскоклеточного местно-распространенного рака шейки матки.
Материал и методы исследования. В исследование были включены 74 больных с диагнозом местно-распространенный рак шейки матки (МРРШМ) Т1b2-T2bNxM0, проходивших обследование и лечение в ФГБУ «Ростовский научно-исследовательский онкологический институт» Министерства здравоохранения Российской Федерации (2015-2018 гг.). Средний возраст пациенток составил 32,5±0,8 года. Критерием включения в исследование был впервые выявленный плоскоклеточный (с ороговением и без) резектабельный рак шейки матки. Диагноз плоскоклеточного рака шейки матки был подтвержден при морфологическом исследовании. Все пациентки находились в репродуктивном периоде и не имели сопутствующей генитальной/соматической патологии. Наличие в анамнезе второй злокачественной опухоли любой локализации, иная гистологическая принадлежность опухоли были причиной исключения больных из исследования.
Всем пациенткам была проведена в неоадъювантном режиме химиотерапия (НАХТ) по схеме: паклитаксел 175 мг/м2, в/в 1-й; карбоплатин AUC5 каждые 3 недели (3 курса). Больные были рандомизированы на основную и контрольную группы.
Основная группа (n=49) - пациентки, которым в основную схему включали антиангиогенный таргетный препарат бевацизумаб в дозе 7,5 мг/кг в 1-й день 1 раз в 3 недели.
Контрольная группа (n=25) - пациентки, которым проводили неоадъювантную химиотерапию без дополнения.
На включение в схему неоадъювантной химиотерапии бевацизумаба было получено разрешение этического комитета ФГБУ «РНИОИ» МЗ РФ, и все больные подписали информирование согласие на проведение лечения. Спустя 3-4 недели после окончания химиотерапии больным проводили оперативное вмешательства в объеме расширенной экстирпации матки с придатками и с верхней третью влагалища с двухсторонней тазовой лимфаденэктомией III типа по классификации Piver.
Биоптаты опухоли, взятые на этапе обследования и после оперативного лечения для иммуногистохимического исследования, готовили стандартным способом. Иммуногистохимическое исследование проводили с использованием первичных антител для маркера пролиферации, ядерного белка Ki-67 (Spring Biosience, Германия), маркеров апоптоза - ядерного белка p53 (DAKO, Дания) и ингибитора апоптоза bcl-2 (Сеll Marque, США). Оценку исследованных маркеров производили подсчетом количества положительно окрашенных клеток на 1000 клеток в 10 репрезентативных полях зрения (при наличии окраски > 25% клеток опухоль считали позитивной по маркеру). Степень пролиферативной активности опухоли оценивали по параметрам: 0–20% – низкая, 21–50% – умеренная, 51–100% – высокая пролиферативная активность. Для определения эффективности примененной НАХТ изучали патоморфологический ответ опухоли на основании анализа характеристик опухолевых клеток: дистрофии, апоптоза и некроза. Лекарственный патоморфоз был представлен фиброзом и склерозом стромы опухоли с сохранением ее остатков в виде групп разрозненных опухолевых клеток (III степень) или с полным ее отсутствием (IV степень).
Статистический анализ результатов исследования проводился с помощью программы Statistica 10.0 (StatSoft Inc., США), MedCalc (версия 9.3.5.0). Различия считали статистически значимыми при p<0,05.
Результаты исследования и их обсуждение. При исследовании лекарственного патоморфоза опухоли после примененного НАХТ в различных группах пациенток получены результаты, представленные на рисунке. Нами выявлены межгрупповые различия патоморфологического ответа опухоли у пациенток МРРШМ. Так, показано, что в основной группе патоморфоз опухоли III–IV cтепени отмечался у пациенток в 65,3% наблюдений, тогда как в контрольной группе патоморфологический ответ такой степени выраженности встречался в 36% случаев.
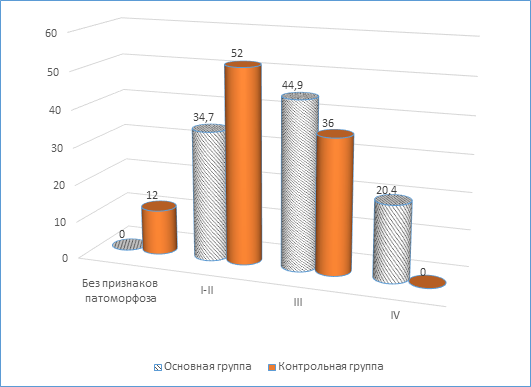
Степень опухолевого патоморфоза (%) пациенток МРРШМ основной и контрольной групп
Полный регресс опухоли наблюдался у 20,4% больных основной группы на фоне отсутствия такого ответа в контроле. У 12% больных контрольной группы, которым применялось НАХТ без дополнения, признаков морфологического ответа опухоли на лечение не было выявлено.
Оценка экспрессии Ki-67 в образцах опухолевой ткани, полученной до лечения, выявила превалирование умеренной пролиферативной активности опухолевых клеток, что превышало долю высокой пролиферативной активности в 1,9 раза и низкой – в 4,3 раза (табл. 1). Различия в группах имели статистическую значимость при р<0,05.
Анализ пролиферативной активности клеток рака шейки матки обнаружил различия в группах пациенток после лечения (табл. 1). В основной группе наиболее часто встречалась пролиферативная активность низкой степени, а опухолевые клетки с высоким уровнем пролиферативной активности вообще отсутствовали. В контрольной группе пациенток низкая ПА встречалась в 1,4 раза реже, чем в основной группе (р<0,05), однако также являлась преобладающей. При сравнении с показателями в тканях опухоли до лечения показано превышение доли опухолей пролиферативной активностью низкой степени в 5,4 раза (р<0,05) и 3,8 раза (р<0,01) в основной и контрольной группах соответственно. Умеренная ПА чаще наблюдалась в группе пациенток до лечения и была выше в 1,9 раза (р<0,05), чем в основной группе пациенток, и в 1,4 раза (р<0,05) в сравнении с контрольной группой.
Таблица 1
Распределение пролиферативной активности (ПА) рака шейки матки в зависимости от лечения
|
Группы |
ПА |
||||
|
Низкая |
Умеренная |
Высокая |
Всего |
||
|
До лечения |
Абс. |
4 |
17 |
9 |
30 |
|
% |
13,3 |
56,7 |
30 |
100 |
|
|
Контрольная |
Абс. |
13 |
10 |
2 |
25 |
|
% |
50 |
41 |
9 |
100 |
|
|
Основная |
Абс. |
34 |
25 |
- |
49 |
|
% |
70 |
30 |
- |
100 |
|
Оценка уровня экспрессии изученных нами маркеров пролиферации и апоптоза представлена в таблице 2.
Среднее значение показателя пролиферации ki-67 было статистически значимо ниже по сравнению с группой до лечения на 37,6 и 55% в контрольной и основной группах соответственно (во всех случаях р<0,01). Для экспрессии р53 опухолевых клеток были также характерны сниженные показатели в группах после лечения на 55% в контрольной (р<0,05) и 59% в основной группах (р<0,01). Однако межгрупповые различия экспрессии р53 при лечении МРРШМ не достигли статистической значимости.
Экспрессия bcl-2 была также ниже в группах с лечением на 45% (контрольная) и 65% (основная) в сравнении с интактной опухолью (во всех случаях р<0,05). Уровень bcl-2 между группами «контрольная – основная» достоверно не различался.
Таблица 2
Экспрессия маркеров пролиферации и апоптоза опухолевыми клетками больных раком шейки матки в зависимости от лечения
|
Исследуемые показатели |
Группы |
n |
Уровень экспрессии, M±m |
р |
|
Ki-67 |
До лечения |
30 |
41,8±5,6 |
|
|
Контрольная |
25 |
26,1±2,9 |
р1 <0,001 |
|
|
Основная |
49 |
18,8±2,1 |
р2<0,001, р3<0,001 |
|
|
p53 |
До лечения |
30 |
18,4±4,1 |
|
|
Контрольная |
25 |
8,3±2,4 |
р1<0,001 |
|
|
Основная |
49 |
7,6±1.2 |
р2<0,001 |
|
|
bcl-2 |
До лечения |
30 |
36,3±4,1 |
|
|
Контрольная |
25 |
19,8±5,7 |
р1<0,001 |
|
|
Основная |
49 |
12,7±3,8 |
р2<0,001 |
Примечание: p1 – уровень статистической значимости по показателю Ki-67 до лечения и после неоадъювантной химиотерапии; p2 – уровень статистической значимости по показателю Ki-67 до лечения и после неоадъювантной химиотерапии и бевацизумаба; p3 – уровень статистической значимости по показателю Ki-67 между основной и контрольной группами.
Характеристика экспрессии маркеров апоптоза в опухолях местно-распространенного рака шейки матки после примененного лечения представлена в таблицах 3 и 4.
Таблица 3
Характеристика экспрессии р53 в опухолевой ткани больных МРРШМ в зависимости от лечения
|
Группы |
Кол-во пациентов |
Положительная реакция |
Отрицательная реакция |
||
|
Абс. |
% |
Абс. |
% |
||
|
До лечения |
30 |
18 |
60 |
12 |
40 |
|
Контрольная |
25 |
8 |
25 |
17 |
75 |
|
р (c2) |
р<0,001 (c2=9,9 ) |
||||
|
Основная |
49 |
3 |
6 |
46 |
94 |
|
р (c2) |
р<0,001 (c2=28,5 ) |
||||
Положительная экспрессия маркера апоптоза р53 в ядрах клеток опухоли у больных после лечения обнаруживалась значительно реже по сравнению с группой пациенток до лечения: в основной группе - в 2,4 раза и в контрольной группе – в 2,2 раза (р<0,05) (табл. 3).
Оценка достоверности сопряжения применения неоадъювантной химиотерапии (для обеих групп) и экспрессии маркера р53 установила значительную ассоциацию (табл. 4). Критерий сопряжения Хи квадрат Пирсона для контрольной группы составил 9,9 при р<0,001, а для основной -28,5 при р<0,001, что свидетельствует о достоверном угнетении экспрессии ингибиторов апоптоза и проапоптотическом действии применяемой терапии. Положительная реакция bcl-2 цитоплазмы клеток опухоли у больных МРРШМ после лечения наблюдалась реже относительно показателя в опухолевой ткани до лечения в 2,9 раза в основной и в 1,8 раза в контрольной группах (р<0,05) (табл. 4).
Таблица 4
Характеристика экспрессии bcl-2 в опухолевой ткани больных МРРШМ в зависимости от лечения
|
Группы |
Кол-во пациентов |
Положительная реакция |
Отрицательная реакция |
||
|
Абс. |
% |
Абс. |
% |
||
|
До лечения |
30 |
21 |
70 |
9 |
30 |
|
Контрольная |
25 |
10 |
40 |
15 |
60 |
|
р (c2) |
р=0,0001 (c2=9,2) |
||||
|
Основная |
49 |
9 |
40 |
40 |
80 |
|
р (c2) |
р<0,001 (c2=19,7 ) |
||||
Таким образом, иммуногистохимическое исследование показателей биологического поведения местно-распространенного рака шейки матки под влиянием применения в неоадъювантном режиме традиционно используемой цитостатической терапии и комбинации ее с таргетной (дополнение бевацизумабом) показало преобладание доли опухолей с низкой пролиферативной активностью и снижение уровня экспрессии Ki-67, а также снижение экспрессии опухолевыми клетками ядерного белка р53 и ингибитора апоптоза bcl-2. Причем более выраженное уменьшение пролиферативного потенциала и повышение апоптотической активности опухолевых клеток отмечено в группе пациенток, которым применяли цитостатическую терапию в сочетании с бевацизумабом. Возможно, полученный эффект от сочетания химиотерапии с бевацизумабом связан не столько с его антиангиогенными свойствами, сколько с его способностью повышать биодоступность цитостатических препаратов для опухолевых тканей [14; 15]. Кроме того, полученные результаты позволяют рассмотреть возможность использования иммуногистохимического исследования экспрессии p53 и Ki-67 в тканях рака шейки матки как биомаркеров для оценки эффективности проводимого лечения [16]. Патоморфоз опухоли III–IV cтепени наблюдался у пациенток МРРШМ при сочетании НАХТ с бевацизумабом почти в 2 раза чаще, а также у части этой группы пациенток отмечен полный регресс опухоли, который не был обнаружен у пациенток, которым применяли НАХТ без дополнения бевацизумабом.
Выводы
1. При сочетании неоадъювантной химиотерапии с бевацизумабом у больных местно-распространенным раком шейки матки выявлено достоверное снижение пролиферативной активности опухоли и угнетение экспрессии апоптотических белков.
2. При морфологическом исследовании показано достоверное улучшение результатов лечения по критериям полного или почти полного регресса опухоли при сочетании неоадъювантной химиотерапии с бевацизумабом у больных местно-распространенным раком шейки матки.
3. Примененный лекарственный метод сочетания неоадъювантного лечения с бевацизумабом у больных местно-распространенным раком шейки матки эффективен для подавления опухолевого роста данной нозологии.
Библиографическая ссылка
Максимов А.Ю., Назаралиева Н.А., Комарова Е.Ф., Позднякова В.В., Комарова Е.Ю. НЕКОТОРЫЕ МОЛЕКУЛЯРНО-БИОЛОГИЧЕСКИЕ МЕХАНИЗМЫ ВЛИЯНИЯ НЕОАДЪЮВАНТНОЙ ХИМИОТЕРАПИИ С БЕВАЦИЗУМАБОМ ПРИ МЕСТНО-РАСПРОСТРАНЕННОМ РАКЕ ШЕЙКИ МАТКИ // Современные проблемы науки и образования. – 2019. – № 5. ;URL: https://science-education.ru/ru/article/view?id=29138 (дата обращения: 19.04.2024).



