В последнее время в России и за рубежом значительное развитие получила клиническая диагностика заболеваний человека при помощи введения в его организм радиоизотопов в индикаторных количествах [1-3].
Такие радиоизотопы называются радиофармпрепаратами (РФП). В США и странах Европы для выявления злокачественных новообразований в ходе оперативного вмешательства активно применяют радиоактивные и флюоресцентные препараты. Используются лишь РФП с низкой энергией (менее 250 кэВ) и малым временем полураспада, чтобы не вызвать у пациента осложнений, однако их энергии должно быть достаточно для получения необходимой диагностической информации. Подобные способы диагностики относятся к ядерной медицине [4; 5]. Ее методы являются уникальными, так как позволяют своевременно обнаружить функциональные изменения в работе внутренних органов. При злокачественных опухолях возможно попадание раковых клеток с током лимфы в лимфатический узел, что ведет к формированию нового очага, что приводит к лимфогенному метастазированию. Для того чтобы остановить дальнейшее распространение клеток опухоли по организму, проводится регионарная лимфаденэктомия - удаление группы лимфоузлов. Во время выполнения такой операции хирургу необходимо удалить оказавшиеся к обнаруженной опухоли наиболее близкими «сторожевые» лимфоузлы [1; 2; 6].
Вследствие сложности повторного хирургического вмешательства лимфоузлы удаляются без подтверждения их метастатического поражения. В то же время удаление всех лимфоузлов связано с ухудшением качества жизни пациента, неконтролируемым истечением лимфы (лимфорея), высокой вероятностью осложнений [7].
Методика интраоперационной биопсии лимфоузлов [1-3] для определения объёма диссекции получила одобрение западным научным сообществом и включена в рекомендации профессиональных сообществ: Европейским обществом медицинской радиологии (EANM), Европейским обществом хирургической онкологии (ESSO), Европейской организацией по исследованиям и лечению рака (EORTC), Обществом медицинской радиологии и молекулярной диагностики (SNMMI), Американским обществом медицинской онкологии (ASCO), международной группой по изучению рака молочной железы (IBCSG), Российским обществом онкомаммологов (РООМ).
После введения пациенту, через какое-то время РФП, в основной своей массе, накапливаются в пораженных органах. Затем пациента помещают под детектор гамма-камеры, где идентифицируются очаги накопления РФП [4; 5]. Очаги накопления РФП указывают на патологию того или иного органа или его части.
Бывают ситуации, когда непосредственно во время операции хирургу необходимо решить, какую часть органа следует считать больной или пораженной опухолью (в случае онкологических заболеваний это наиболее актуально). Проведение полного «сканирования» тела больного в такой ситуации невыполнимо, а результаты предварительного «сканирования» не дают возможности оценить концентрацию РФП в конкретной зоне того или иного органа, особенно когда часть его уже была удалена и нужно принять решение, было ли этого достаточно. Следовательно, необходимо в процессе операции оценить накопление РФП в ограниченном участке. Существующие установки для проведения такого вида диагностики отличаются большими размерами, высокой стоимостью или привязкой к источнику питания, и не применимы в ходе операции. В России сертифицирован и разрешен к применению только Gamma FinderII [1; 2], отличающийся высокой стоимостью и необходимостью технического обслуживания с подзарядкой.
Цель исследования. Разработка и доклинические испытания компактного, недорогого и простого в использовании и обслуживании гамма-детектора для поиска «сторожевых» лимфатических узлов в онкологической практике.
Материал и методы исследования. Разработан прибор – сцинтилляционный детектор, для проведения радионуклидной клинической диагностики, применяемый непосредственно во время операций и не требующий взаимодействия с громоздким стационарным оборудованием, позволяющий выявлять «сторожевые» лимфоузлы, что помогает хирургу определять объем лимфатической диссекции при хирургических вмешательствах.
Его достаточно поднести к предположительному месту расположения «сторожевого» лимфоузла и, исходя из показаний на дисплее прибора, судить о концентрации РФП в нем.
В основе сцинтилляционных детекторов лежат вещества, называемые сцинтилляторами, которые обладают способностью испускать свет при поглощении ионизирующего излучения (рис. 1а). Световое излучение, испускаемое сцинтиллятором, улавливается фотоэлектронным умножителем (ФЭУ), преобразующим свет в электрический ток, который может быть детектирован внешней цепью (рис. 1б).


Рис. 1а. Кристалл сцинтиллятора Рис. 1б. ФЭУ
Кристалл сцинтиллятора был выбран и приобретён при содействии Научно?исследовательского института физики Южного федерального университета.
Итогом первого этапа испытаний послужило создание макета диагностического устройства (рис. 2). Получен патент № 173164 [8].


Рис. 2. Макет детектора Гамма 2
Ввиду неудобства использования (размеры, необходимость доступа к кнопкам управления) и сборки макета было принято решение делать корпус из двух симметричных половинок, собирающихся в единый корпус путём склеивания. Торцевая часть устройства закрывается лицевой панелью с прорезью для кнопок и экрана. Финальный вид опытного образца представлен на рисунке 3.

Рис. 3а. Образец «Гамма-3»
 Рис. 3б. Образец в сборе в демонстрационном кейсе с зарядным устройством
Рис. 3б. Образец в сборе в демонстрационном кейсе с зарядным устройством
Испытания образца «Гамма-3»
Целью данных испытаний была проверка соответствия образца медицинских приборов под серийными номерами 1302 и 1303 по своему прямому назначению и выявление количественных характеристик измерений прибора в условиях реального применения.
Испытания проводились в период со 2 октября 2017 г. по 13 октября 2017 г. в радиоизотопной лаборатории РНИОИ, г. Ростов-на-Дону.
Эксперименты производились с применением радиофармпрепарата, приготовленного на основе Технеция 99m (99Tcm) и набора к нему «Технефит», используемого в радионуклидных исследованиях при диагностике онкологических заболеваний. Для исследования спектральных и амплитудных характеристик нам был предоставлен шприц с препаратом, разведённый в концентрации, используемой при диагностике. Данный шприц был помещён в специальный свинцовый контейнер («фантом») для уменьшения воздействия на окружающих в процессе проведения измерений (рис. 4) и обеспечения точечности источника.

Рис. 4. Фантом с источником излучения («Технифит», технеций-99)
Измерения производились приборами с серийными номерами 1302 и 1303. Результаты измерений приведены на рисунках 5 и 6.
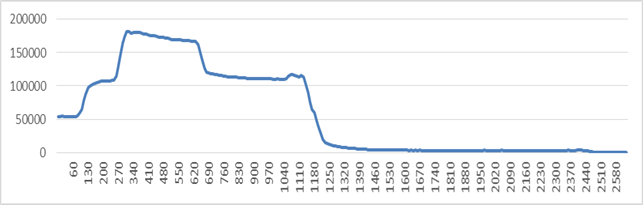
Рис. 5. Количество импульсов в зависимости от порога компаратора
(прибор 1303, полный спектр)
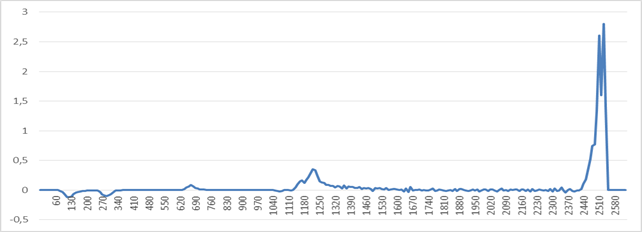
Рис. 6. Первая производная количества импульсов в зависимости
от порога компаратора (прибор 1303)
Из произведённых измерений видно, что до уровня ~1200 условных единиц (1 единица – минимальный шаг порога АЦП срабатывания прерывания по превышению уровня) очень велико значение собственных шумов прибора, вызванных работой высоковольтной (>1000В) схемы питания лампового ФЭУ, расположенной в непосредственной близости от счётчика импульсов. После повышения порога до ~1200 видна зона с ярко выраженной спектральной линией, предположительно соответствующая спектральной линии излучения технеция-99. При этом количество импульсов в «рабочей зоне» прибора примерно равно 3000.
Исходя из данных результатов, можно сделать вывод, что используемая схема регистрации и подсчёта гамма-излучения применима для использования, поскольку обеспечивает регистрацию гамма-частиц на уровне, значительно превышающем уровень шума схемы измерений.
Результаты исследования и их обсуждение. Проведенные испытания однозначно демонстрируют возможность детектора регистрировать повышенный радиационный фон, исходящий от областей тела пациента, пораженных той или иной патологией.
В рамках проведённого экспериментального исследования было выявлено, что прибор обладает малой диаграммой направленности, за счёт чего может быть затруднено точное обнаружение поражённых лимфоузлов. Рекомендовано увеличить диаграмму направленности.
Также был выявлен эффект «боковой засветки» блока сцинтиллятора, из-за которого «зашумляются» показания прибора, что приводит к ухудшению диаграммы направленности, за счёт чего появляются существенные шумовые боковые лепестки. Рекомендовано усовершенствовать блок сцинтиллятора с целью уменьшения влияния эффекта «боковой засветки».
Выводы. В результате проведённых исследований было выявлено, что прибор позволяет определить степень накопления радиофармпрепарата.
Однако также было отмечено, что прибор под номером 1302 обладает гораздо меньшей чувствительностью, чем прибор под номером 1303. Таким образом, рекомендовано использовать приборы с чувствительностью на уровне прибора 1303.
Итогом испытаний и консультаций с клиницистами, имеющими опыт работы с зарубежными аналогами (Gamma-Finder II), послужила разработка нового гамма-детектора «Гамма-5» (рис. 7), в котором учтены все рекомендации клиницистов. А по некоторым показателям (стоимость, функциональность, обслуживание и др.) «Гамма-5» в разы превосходит зарубежные аналоги.
Рис. 7. Гамма-детектор «Гамма-5»
Библиографическая ссылка
Кит О.И., Полупанов Н.С., Максимов А.Ю., Ващенко Л.Н., Касьяненко В.Н., Шатова Ю.С., Максимова Н.А., Босенко Е.С., Луганская Р.Г., Мамай В.И., Чурилов С.А. РАЗРАБОТКА ПОРТАТИВНОГО ПРИБОРА РАДИОНУКЛИДНОЙ ДИАГНОСТИКИ В ОНКОЛОГИИ // Современные проблемы науки и образования. – 2019. – № 1. ;URL: https://science-education.ru/ru/article/view?id=28444 (дата обращения: 20.04.2024).



