С развитием технологий для выполнения травматологических операций возрастает и число возможных методик, которые травматолог-ортопед может применить при коррекции той или иной патологии.
Использование металлоконструкций при восстановлении суставов давно зарекомендовало себя как надежный, эффективный метод [1, 2]. Доказаны их безопасность и эффективность для хрящевой ткани на примере пациентов с одномыщелковым протезированием коленного сустава. Однако при их использовании может наблюдаться ряд нежелательных явлений, связанных с «чужеродностью» материала, таких как: металлоз, гнойно-воспалительные осложнения, аллергические реакции (нумулярная экзема, нейродермит, эпидермодермит, генерализованный аллергический васкулит, буллезный дерматит, экссудативная эритема) [1-3].
Еще недавно прорывом в области хирургии стало широкое внедрение биодеградируемых конструкций. Они показали себя с хорошей стороны при оценке отдаленных результатов лечения, используются даже в детской ортопедии. Биосовместимость таких конструкций подтверждена множеством авторов, как в экспериментах in vivo, так и клинически [4-6]. Тем не менее результаты применения конструкций различны, имеют место такие осложнения, как местная воспалительная реакция в области проведения биодеградируемой конструкции (свищ, абсцесс), аллергические реакции (детритный синовит, гранулома), остеолиз кистозного типа вокруг имплантата, его разрушение, артрофиброз и связанные с ним состояния [1, 6, 7].
Проблема особенно выражена при использовании конструкций при операциях на суставах, таких как фиксация остеохондральных фрагментов, возникших вследствие травмы или заболевания. Так, например, у пациентов с болезнью Кенига субхондрально в области образовавшегося дефекта уже имеется зона асептического некроза при наличии живого остеохондрального фрагмента, отделившегося от суставной поверхности вместе с участком кости, существует возможность его рефиксации с сохранением анатомии сустава [2-4, 6].
Сравнение результатов лечения после фиксации тем или иным материалом различными авторами проводилось в основном для костной ткани. Данные о влиянии материалов на хондроциты не обобщены. Авторы исследований, затронувших взаимодействие хрящевой ткани с металлом и поликапролактоном, разделились на 2 группы. Первые, они же большинство, на основе анализа отдаленных результатов лечения и экспериментов in vivo предполагают, что разница между используемыми материалами несущественна, хотя при этом они говорят о необходимости увеличения выборки для большей достоверности [4-6]. Вторые же заметили, что на поверхность хряща металл оказывает меньшее влияние, нежели биодеградируемая конструкция, что проявлялось в снижении постоперационных осложнений у группы пациентов [2, 6]. Предлагается также применять фиксаторы, изготовленные тем или иным путем из материалов, имеющих в своем составе керамику [7], однако данные о ее цитотоксичности в отношении хондроцитов отсутствуют.
За последние годы появилось множество исследований относительно восстановления хрящевой поверхности с помощью 3D-печати участка необходимой площади и формы биочернилами, которые представляют собой комплекс из мезенхимальных стволовых клеток и наполнителя (к примеру, хитозана, альгината) [8]. Однако применение тканеинженерных конструкций требует тестирования их цитотоксичности и изучения влияния на пролиферацию хондроцитов, поскольку от этого зависит их эффективность в клинике [9, 10].
Исследования на животных дают возможность оценить влияние непосредственно в живом организме, т.е. с учетом влияния таких факторов, как иммунный ответ, что может усиливать деградацию биоразлагаемых конструкций гистотоксический эффект.
Влияние биодеградируемых материалов и металла непосредственно на хондроциты до конца не изучено, что и объясняет актуальность данного исследования.
Цель работы: проведение пилотного исследования для оценки и сравнения влияния биодеградируемого материала и металла на адгезию и пролиферацию хондроцитов в культуре.
Материалы и методы исследования
Материалом для настоящего исследования in vitro являлась первичная адгезионная культура клеток хрящевой ткани коленного сустава двух мини-поросят, выращенных в хозяйстве экспериментальных животных ИЦиГ СО РАН. Поскольку культура хондроцитов, полученных из колена мини-свиньи, растет быстрее, чем полученная из хряща человека, использование хондроцитов мини-поросят сокращает время эксперимента и затраты на него.
Хондроциты мини-свиньи получали лизированием фрагментов хряща размером около 1 мм3 в 0,2%-ном растворе коллагеназы из гепатопанкреаса краба («Биолот», Россия) на полной среде, включавшей в себя ростовую среду RPMI («Биолот», Россия) с добавлением 15% FBS («Gibco», Россия), 42,19 ед./мл пенициллина, 0,042 мг/мл стрептомицина («Биолот», Россия), 0,053 мг/мл амфотерицина В («Biowest», Франция) в конечных концентрациях. В эксперименте использовали хондроциты 1-го пассажа, высеянные в 6-луночные планшеты («ТРР», Швейцария). Для культивирования использовали 2,4 мл полной среды. До момента эксперимента смену среды проводили каждые 3–4 суток. К началу эксперимента возраст культуры составил 6 недель. В ходе эксперимента смены среды не проводилось, чтобы исключить положительное ее влияние, которое могло нивелировать возможное отрицательное влияние материалов на хондроциты.
Для оценки влияния материалов конструкций, используемых при стандартных операциях, в планшеты с монослоем хондроцитов были помещены фрагмент биодеградируемого винта, состоящий из полимолочной-когликолевой кислоты, и фрагмент металлоконструкции из медицинской стали. Фрагменты биодеградируемого материала представляли собой круглые пластинки диаметром 4 мм и высотой 2 мм (объем составил 25,12 мм3), полученные при циркулярном опиле стерильного биодеградируемого винта скальпелем. Объем фрагментов металлоконструкции из медицинской нержавеющей стали составил 235,5 мм3 каждый.
Культуры хондроцитов разделили на 3 группы: группа 1 – хондроциты, на которые воздействовала полимолочная-когликолевая кислота; группа 2 – хондроциты, на которые воздействовало присутствие медицинской стали; группа 3 – контрольная группа, не подвергавшаяся какому-либо воздействию. Динамику влияния материалов оценивали путем подсчета хондроцитов в 3 фракциях культуры. Фракция 1 – неприкрепленные клетки хряща, свободно плавающие в среде. Фракция 2 – слабо прикрепленные к поверхности клетки, собранные после промывания культуры PBS (натрий-фосфатным буферным раствором) перед трипсинизацией. Фракция 3 – хорошо прикрепившиеся клетки, открепление которых с поверхности с целью подсчета произвели в ходе трипсинизации культуры в инкубаторе при температуре +37°С в течение 5 минут. Хондроциты подсчитывали в гемоцитометре под микроскопом MC 700 («Micros», Австрия).
Фракция 1 содержит свободно взвешенные в культуральной среде хондроциты, которые, судя по данным Н.М. Астаховой, являются потомками клеток, недавно претерпевших митоз и, вероятно, мигрирующих [11]. Фракция 2 содержит слабо прикрепленные клетки, только что разделившиеся, готовящиеся к делению. Во фракции 3 представлены активно функционирующие, вероятно, находящиеся в синтетической фазе клеточного цикла, хондроциты.
Количество хондроцитов оценивали в каждой фракции через 24 часа для определения ранней реакции клеток хрящевой ткани; через 3 суток, через 7 суток и через 10 суток после помещения на клеточной покров тестируемого материала (таблица).
Для оценки статистической значимости полученных результатов был применен критерий χ2 Пирсона. Для каждой группы исследования оценивалась взаимосвязь с контрольной группой. За действующий фактор принято наличие инородного тела, а в качестве значения результативного признака считалось наличие хондроцитов с определяющей характеристикой для каждой фракции. Пороговый уровень значимости был принят р=0,01. Значения р <0,01 признавались статистически значимыми.
Количество клеток в различных группах через 24 часа, через 3 суток, через 7 суток
и через 10 суток после помещения на клеточной покров тестируемого материала
(тыс. клеток/лунку)
|
Экспериментальная группа |
24 часа |
3 суток |
7 суток |
10 суток |
|
|
Группа 1 |
Фракция 1 |
264 |
60 |
228 |
96 |
|
Фракция 2 |
120 |
180 |
84 |
120 |
|
|
Фракция 3 |
96 |
48 |
12 |
108 |
|
|
Группа 2 |
Фракция 1 |
192 |
24 |
72 |
36 |
|
Фракция 2 |
84 |
36 |
108 |
36 |
|
|
Фракция 3 |
216 |
324 |
60 |
228 |
|
|
Группа 3 |
Фракция 1 |
12 |
12 |
24 |
12 |
|
Фракция 2 |
72 |
12 |
156 |
72 |
|
|
Фракция 3 |
216 |
576 |
108 |
468 |
|
Результаты исследования и их обсуждение
На рисунке 1 показана общая численность хондроцитов в зависимости от влияния на клетки материалов конструкций в динамике. На примере контрольной группы отображены естественные фазы роста клеточной популяции, что важно при оценке результатов. Выражена цикличность роста культуры хондроцитов: периоды пролиферации сменяются периодами гибели клеток. Время удвоения популяции хондроцитов составляет 2 суток. Вероятно, к 8-й неделе культивирования рост культуры вышел на плато, поэтому чередование циклов роста с циклами гибели хондроцитов является естественным для данного возраста культуры. И сталь, и комплекс из полимолочной-когликолевой кислоты, судя по снижению численности хондроцитов в культуре, отрицательно влияли на пролиферацию хондроцитов.
Подсчет хондроцитов во фракциях контрольной группы показал, что количество клеток во фракции неприкрепленных хондроцитов, свободно взвешенных в культуральной среде, не изменялось на протяжении эксперимента (рис. 2). Выявлено, что циклы нарастания и спада количества клеток во фракции слабо прикрепленных (Фракция 2) и фракции хорошо прикрепленных клеток (Фракция 3) происходят в противофазах (рис. 3, 4). Учитывая, что динамика количества хондроцитов во фракции хорошо прикрепленных клеток (Фракция 3) совпадает с общим количеством хондроцитов в культуре (рис. 2, 4), можно предположить, что во фракцию слабо прикрепленных клеток входят большей часть не пролиферирующие хондроциты, а погибающие в фазе роста культуры, которой она достигла за 8–10 недель.
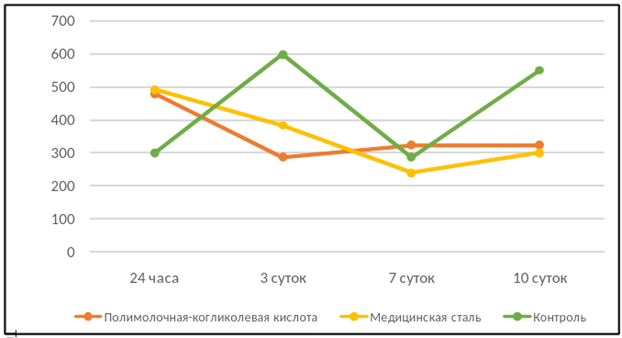
Рис. 1. Общее количество хондроцитов в зависимости от экспериментальных воздействий за весь период исследования
В опытных группах отчетливо видно, что через 24 часа после помещения в среду фрагментов исследуемых материалов образцы культур хондроцитов резко (р<0,01) отреагировали массивным откреплением клеток от поверхности культуральной посуды (рис. 2). Это свидетельствует о создании неблагоприятной, возможно, закисленной среды для их пролиферации.
Клиническое значение. Можно предположить, что in vivo механизм будет иметь схожий характер, т.е. при фиксации живого костно-хрящевого фрагмента каким-либо методом в первые сутки будет инициирована местная тканевая реакция на инородное тело [3, 4].
В отличие от контрольной группы, которая характеризовалась одинаковой долей неприкрепленных клеток в культуре на протяжении эксперимента (Фракция 1), опытные группы характеризовались: увеличенным числом клеток в этой фракции, выраженной динамикой изменения численности клеток (рис. 2). При этом пики и минимумы открепившихся хондроцитов (Фракция 1) совпадали в культурах независимо от помещенного в них материала (рис. 2). Так, через 3 суток выявлено значительное снижение количества взвешенных в культуральной среде клеток, что может быть связано не только с адаптацией хондроцитов, но и с общим снижением их популяции (рис. 1) в опытных группах.
По прошествии 7 суток от начала эксперимента количество открепившихся клеток (Фракция 1) в группе с биодеградируемым материалом вновь возросло и значительно превышало таковое в других группах.
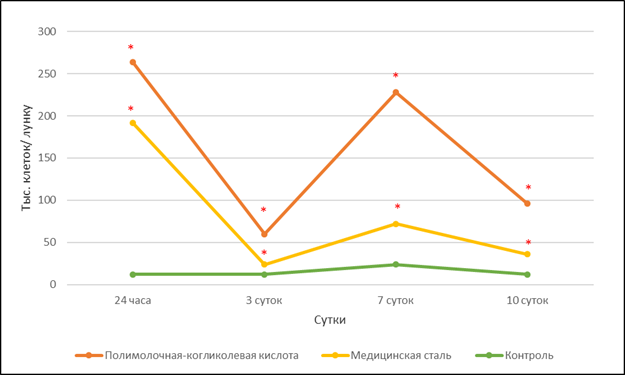
Рис. 2. Количество неприкрепленных хондроцитов (Фракция 1) в зависимости от экспериментальных воздействий
Примечание: * – р<0,01 по отношению к контрольной группе
Во второй группе исследования, несмотря на отрицательный эффект присутствия медицинской стали на культуру хондроцитов, проявившийся снижением их общей численности (рис. 1), воздействие материала было более мягким по сравнению с воздействием биодеградируемого материала. Это выражалось в совпадении фаз динамики числа хондроцитов контрольной группы и второй группы во фракциях слабо прикрепленных (рис. 3) и хорошо прикрепленных (рис. 4) клеток. Так, в них наблюдалось снижение слабо прикрепленных клеток в периоды с 24 ч по 3-и сутки и с 7-е по 10-е сутки. Увеличение доли этих клеток происходило с 3-и по 7-е сутки.
Влияние материла биодеградируемого винта приводило к увеличению доли слабо прикрепленных клеток в культуре в периоды с 24 часов по 3-и сутки и с 7-е по 10-е сутки. Уменьшение доли слабо прикрепленных клеток происходило между 3-ми и 7-ми сутками, т.е. в противофазе к контрольной группе и группе хондроцитов, на которые воздействовала медицинская сталь (рис. 3). Таким образом, снижение доли слабо прикрепленных клеток в культурах, подвергавшихся воздействию полимолочной-когликолевой кислоты, происходило не за счет прикрепления клеток, а за счет открепления и перехода во фракцию клеток, взвешенных в культуральной среде (рис. 2), с последующей их гибелью.
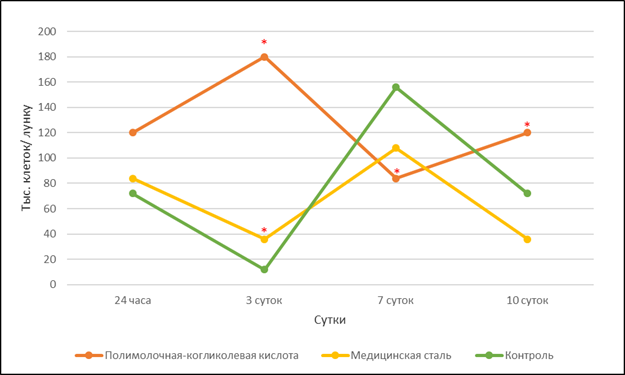
Рис. 3. Количество слабо прикрепленных хондроцитов (Фракция 2) в культуре в зависимости от экспериментальных воздействий
Примечание: * – р<0,01 по отношению к контрольной группе
На рисунке 4 отображено количество хондроцитов, хорошо прикрепленных к поверхности планшета с питательной средой. Чем выше значения этой фракции, тем лучше и скорее происходит регенерация хрящевой ткани при трансплантации хондроцитов in vivo. Различия между контрольной группой и группой с биодеградируемым материалом были оценены как значимые (р<0,01) – пролиферативная активность культуры из контрольной группы, выраженная в количестве клеток на одну лунку, была в 4,9 раза выше. Взаимосвязь между группой с материалом из металла и контрольной группой выявлена как незначимая (р>0,01).
К 10-м суткам снизилось количество неприкрепленных (рис. 2) и слабо прикрепленных клеток во всех (рис. 3) и наблюдалось увеличение фракции прикрепленных клеток. Полученные данные могут свидетельствовать о начале процесса адаптации хондроцитов к присутствию инородного материала, активизации их пролиферации.
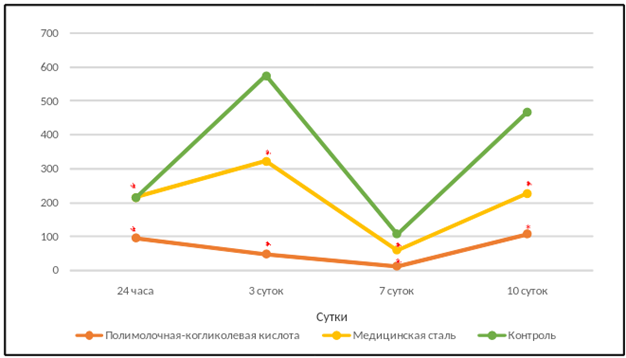
Рис. 4. Количество хорошо прикрепленных хондроцитов (Фракция 3) в культуре в зависимости от экспериментальных воздействий
Примечание: * – р<0,01 по отношению к контрольной группе
В случае, если активизация деления в контрольной группе связана с гибелью клеток в ходе насыщения культуры с последующим возобновлением пролиферации, о чем свидетельствует неизмененный период удвоения популяции хондроцитов – 2 суток (рис. 1), то в экспериментальных группах период удвоения популяции хондроцитов определить не удалось. Это может быть связано как с цитотоксичностью тестируемых материалов, так и с тем, что хондроциты опытных групп к 10-м суткам эксперимента вернулись к лаг-фазе роста культуры, и в это время возможны как их адаптация, так и еще больший регресс. Поэтому при разработке дизайна следующего эксперимента необходимо увеличить сроки наблюдения за культурами хондроцитов. Кроме того, для повышения адекватности моделирования влияния материалов на хондроциты планируется изменить режим смены культуральной среды и учесть водоизмещение при помещении в культуру фрагментов металлоконструкций, поскольку высота слоя культуральной среды влияет на пролиферацию хондроцитов in vitro [12].
Несмотря на то что вышеописанные факторы не были учтены в ходе настоящего пилотного исследования, было выявлено, что и металл, и полимолочная-когликолевая кислота токсичны для хондроцитов. In vivo, вероятно, степень цитотоксичности будет варьировать в зависимости от качества матрикса хряща, который может замедлять диффузию веществ; реактивности иммунной системы; наличия сопутствующей патологии.
Выводы
Результаты, полученные в ходе данного эксперимента, показали целесообразность проведения дальнейших исследований в данной области как in vitro, так и in vivo.
В настоящем эксперименте, судя по пролиферации, реакция культуры хондроцитов на металл оказалась значительно лучше по сравнению с реакцией на биодеградируемую конструкцию (р<0,01). Важно отметить, что любое инородное тело как in vivo, так и in vitro будет иметь хондротоксическое воздействие. Этот факт обусловливает необходимость поиска материалов, более биосовместимых с хрящевой тканью сустава. Оценивая токсичность in vitro, следует понимать, что в случае с реальным пациентом воздействие металла на хондроциты прекращается через гораздо более короткое время после удаления металлоконструкции. Оно определяется как диффузией частиц металла внутри матрикса хрящевой ткани, так и тем, что отделение частиц металла происходит медленнее и менее массивно, чем отделение частиц биодеградируемого материала. Токсичность металла обусловливается участием железа в свободнорадикальной реакции Фентона, являющейся причиной запуска окислительного стресса в клетках и тканях организма [13-15]. Возможная токсичность материала винта может быть обусловлена закислением рН, снижающим жизнеспособность клеток, а также усиливающим действием экскретируемых во внеклеточное пространство кислых лизосомальных гидролаз: разрушающего коллаген катепсина К и гексаминидазы А и В, которые расщепляют гликопротеины и протеогликаны.
Результаты данного исследования имеют значение в клинической практике для дифференцированного подхода к выбору тактики хирургического лечения. При рефиксации живого остеохондрального фрагмента к зоне дефекта эффективными мерами по снижению токсического влияния инородных материалов могут быть модификации стандартных хирургических методик установки имеющихся металлических или биодеградируемых фиксаторов. При этом следует учитывать, что в дальнейшем потребуется удаление установленной металлической конструкции.
Перспективным является внедрение в практику более биосовместимых материалов. Представляют интерес исследования по оценке влияния керамики на хрящевую ткань. Применение же современных методов 3D-печати и клеточных технологий в хирургии суставов в условиях подтвержденной их эффективности может стать революционной методикой лечения пациентов с остеохондральными дефектами.
Библиографическая ссылка
Анастасиева Е.А., Кирилова И.А., Симагаев Р.О., Пахомов И.А., Щелкунова Е.И., Воропаева А.А. ОЦЕНКА ВЛИЯНИЯ БИОДЕГРАДИРУЕМЫХ МАТЕРИАЛОВ И МЕТАЛЛОКОНСТРУКЦИЙ НА ХОНДРОЦИТЫ: ПИЛОТНОЕ ИССЛЕДОВАНИЕ // Современные проблемы науки и образования. – 2018. – № 6. ;URL: https://science-education.ru/ru/article/view?id=28337 (дата обращения: 20.04.2024).



