Сегодня около 150 миллионов взрослых в мире страдают от потери зубов, и, по прогнозам, в течение текущего десятилетия будет зарегистрировано более 10 миллионов новых случаев эдентулизма [1; 2]. В течение жизни большинство взрослых сталкивается с проблемами потери зуба(ов) вследствие генетических нарушений или заболеваний бактериального происхождения, воздействия ятрогенных, травматических или терапевтических факторов, а также недостаточной гигиены полости рта [1-3]. В настоящее время в качестве методов лечения / замены зубов активно используются такие стоматологические клинические процедуры, как лечение корневых каналов и имплантация зубов, однако это со временем ведет к снижению чувствительности зубов и потере жизнеспособности, а также нарушениям распределения механической нагрузки при жевании и движению альвеолярных костей [4-7]. Несомненно, эти недостатки обусловливают постоянный поиск альтернативных методов лечения и восстановления утраченных зубов. В последнее время все более активно обсуждаются возможности создания биоинженерных конструктов – зубов с применением биоинженерных скэффолдов, стимуляции формирования третичного дентина, клеточной терапии, гибридных тканеинженерных систем, генноопосредованной регенерации зуба [2; 7-9].
Несомненно, подходы тканевой инженерии и клеточных методов лечения способствуют регенерации более предсказуемым образом и позволяют расширить терапевтические границы регенеративной терапии. В последние годы получено достаточное количество данных о возможности выделения стволовых клеток из пульпы зубов как детей (молочные зубы), так и взрослых [10-12]. Эти данные имеют существенное значение, поскольку возможность получения стволовых клеток из зубов не несет никаких этических противоречий в отличие от эмбриональных стволовых клеток, является неинвазивной и гораздо более экономически выгодной процедурой, возможной к выполнению в течение всей жизни человека [13; 14]. Также, по данным последних проведенных исследований, выживать и сохранять свой регенеративный потенциал могут даже стволовые клетки, выделенные из зубов с пульпитом [15]. Основная популяция клеток, которые могут быть получены из пульпы зуба, - мезенхимальные стволовые клетки (МСК). В качестве возможных источников взрослых МСК для регенерации зубов сегодня рассматриваются несколько типов клеток - это МСК зуба [10], а также МСК из незубных интраоральных источников, прежде всего – слизистой оболочки щеки, десны, надкостницы, и МСК из других источников: костного мозга, жировой ткани, пупочного канатика [11; 12]. Эти клетки способны к самообновлению и мультилинейной дифференцировке, характеризуются высокой способностью к пролиферации и сегодня рассматриваются как перспективные возможные источники для применения в регенеративной стоматологии.
Цель исследования: разработка протокола выделения МСК из пульпы удаленных по ортодонтическим показаниям третьих моляров, сравнение дифференцировочного потенциала и фенотипа поверхностных антигенов с характеристиками МСК, полученных из других источников и охарактеризованных согласно существующим паспортам клеточных линий (данные Российской коллекции клеточных культур (РККК)).
Материалы и методы
В исследовании были использованы удаленные по ортодонтическим показаниям третьи моляры (n=20) пациентов обоего пола в возрасте 16-35 лет, без видимых кариозных поражений и признаков воспаления. Получено информированное согласие пациентов в письменной форме на удаление зубов и последующее выделение из них МСК для исследовательских целей.
Выделение МСК
Удаленный хирургическим путем зуб помещался в стерильный пластиковый контейнер, содержащий 5 мл стерильного физиологического раствора с 0,02% антибиотика (пенициллин-стрептомицин). Контейнер осторожно запечатывался и помещался в транспортный сосуд с заданной температурой +2+4 °С. Время от забора до поступления образца в лабораторию не превышало 2 часов.
В лаборатории поверхность зуба трижды очищалась и промывалась стерильным физиологическим раствором комнатной температуры. Выделение клеток из пульпы зуба проводилось ферментативным способом. Для этого зуб помещался в чашку Петри диаметром 60 мм, где проводилось предварительное промывание пульпарной камеры зуба 2 мл 0,5%-ного раствора коллагеназы II типа, после чего зуб находился в 2 мл 0,5%-ного раствора коллагеназы II типа в течение 1 часа при 37 °C. Затем выделенные клетки в 2 мл раствора коллагеназы II типа были собраны в пробирку объемом 15 мл, куда для остановки процесса ферментации было добавлено 3 мл рабочей питательной среды - DMEM/F12 в соотношении 1:1 (ПанЭко). Полученная клеточная суспензия центрифугировалась в течение 5 мин на 1000 об/мин при комнатной температуре. Супернатант тщательно отбирался, после чего клеточный осадок был ресуспендирован в 1 мл полной питательной среды, содержащей DMEM/F12 в соотношении 1:1, 10% FBS, 100 мкМ L-аскорбиновой кислоты,2 mM L-глутамина, 100 U/мл пенициллина, 100 мг/мл стрептомицина и 0,25 мг/мл амфотерицина B [16-19]. Полученная суспензия клеток пульпы зуба помещалась на культуральные планшеты 25 см2, содержащие полную питательную среду, и в дальнейшем инкубировалась при 37 °C и 5% CO2.
Культивирование
Замена культуральной среды проводилась 1 раз в 2-3 дня до достижения конфлюентности 80%. Пересев культур проводился согласно стандартному протоколу пересева монослойных культур в соотношении 1:3 1 раз в 7-8 дней. Для дальнейшего анализа использованы клетки на 2-3 пассажах.
Анализ характеристик клеточной популяции
Для определения соответствия выделенных клеток фенотипическим маркерам МСК оценивали ряд критериев: морфологический критерий, экспрессия типичных поверхностно-клеточных маркеров, способность к дифференцировке в определенные типы клеток. Оценка формы клеток выполнялась методом световой микроскопии. Анализ характерных для МСК маркеров (наличие CD73, CD90, CD105, отсутствие CD14, CD20, CD34, CD45) выполнен методом проточной цитофлуориметрии (проточный цитофлуориметр Beckman Coulter, FC500; набор для анализа MSC phenotyping kit, human, #130-095-198, Miltenyi Biotec) согласно инструкции производителя.
Проанализирована способность выделенных клеток дифференцироваться в остео- и хондрогенном направлении, а также способность дифференцироваться в специфические клетки – одонтобласты. С целью определения свойственной МСК способности дифференцироваться в остео- и хондрогенном направлении выделенные клетки в концентрации 1 × 104 клеток/см2 внесены в два культуральных флакона 25 см2 (Corning-Costar, #430372) с добавлением стандартных дифференцирующих сред (StemPrо, Chondrogenesis Differentiation Kit, #A1007101, Gibco; StemPro, Osteogenesis Differentiation Kit, #A1007201, Gibco) и помещены в СО2-инкубатор (37 °С, 5%СО2) в соответствии с инструкцией производителя и с заменой дифференцирующей среды каждые 3 дня, пересевом культуры 1 раз в 7-8 дней. Продолжительность культивирования клеток в данных условиях составляла 30 дней. По завершении периода дифференцировки анализировалась морфология дифференцированных клеток (световая микроскопия), проведена гистохимическая окраска (по Фон Коссу, с использованием железного гематоксилина и метахроматического красителя). Анализ экспрессии маркеров одонтобластов выполнен иммуноцитохимическим методом (стандартный протокол) с оценкой экспрессии характерного маркера – дентального сиалофосфопротеина (DSPP) [17; 20] в популяции МСК, дифференцированных используемой при остеогенной дифференцировке стандартной дифференцирующей средой (флуоресцентный имэджер ZOE, BioRad; первичные антитела anti-DSPP, Abcam, ab216892; вторичные антитела – антитела козы к IgG, IgA, IgM кролика с ФИТЦ (f-GAR Iss), Имтек).
Статистический анализ
Непрерывные переменные представлены в виде средних значений стандартного отклонения для числа наблюдений (среднее ± стандартное отклонение). Все данные проверены на нормальность распределения и равенства стандартного отклонения перед анализом. Сравнение непрерывных переменных выполнялось с использованием теста Стьюдента. Критерием достоверности является 95%-ный доверительный интервал (ДИ). Статистический анализ проводился с использованием программы Statistica, ver 11.0.
Результаты
Выделение МСК
Протокол выделения клеток составлен на основе собственного опыта работы с культурой МСК и разработан для источника – зуб человека с учетом современных данных [16-19; 21; 22]. Все процедуры выделения (n=20) клеток из удаленных зубов выполнены успешно. При динамическом наблюдении за культурами клеток к концу 1-х суток культивирования отмечено формирование колоний клеток. Большая часть клеток приобретала характерную для МСК [18; 22] фибробластоподобную форму (рис. 1А). При последующих заменах питательной среды все клетки имели характерную фибробластоподобную форму (рис. 1Б).
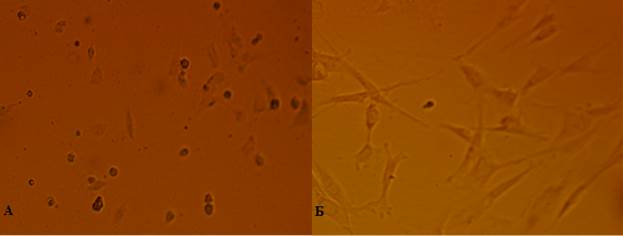
Рис. 1. А – клетки, выделенные из пульпы зуба через 24 часа культивирования. Б - клетки, выделенные из пульпы зуба, 10-е сутки культивирования
Анализ характеристик клеточной популяции
При определении принадлежности выделенных клеток к МСК проанализирована экспрессия характерных для МСК маркеров методом проточной цитофлуориметрии. Установлено, что выделенные из пульпы удаленных зубов культуры характеризуются высоким уровнем экспрессии характерных для МСК маркеров – CD90 и CD105, что составило 98,5 ± 3,8% и 96,8 ± 2,9% соответственно, и отсутствием экспрессии маркеров CD14, CD20, CD34 и CD45. Полученные результаты в сравнении с имеющимися паспортами клеток МСК из различных незубных источников (данные РККК, Российская коллекция клеточных культур позвоночных, Санкт-Петербург, ИНЦ РАН, 2016, составители Полянская Г.Г., Сакута Г.А., Еропкин М.Ю., Смирнова Т.Д., Подчерняева Р.Я., Михайлова Г.Р., Дьяконов Л.П., Гальнбек Т.В., Глинских Н.П., Бахарев А.А.) – костный мозг эмбриона, эмбриональные стволовые клетки, мышца конечности эмбриона, кожа век взрослого донора, позволяют достоверно отнести выделенные из пульпы зуба клетки к пулу МСК (таблица, рис. 2).
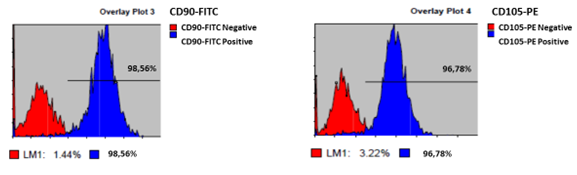
Рис. 2. Экспрессия маркеров CD90, CD105 МСК, выделенными из пульпы удаленных третьих моляров
Сравнительные характеристики МСК из различных источников (на основании данных паспортов клеточных линий РККК)
|
Тип культуры |
Форма клеток |
CD 90 |
CD 105 |
CD 34 |
CD 45 |
Остеогенная дифф-ка |
Хондрогенная дифф-ка |
|
Костный мозг эмбриона |
Фибробластоподобная |
+ |
+ |
- |
Нет данных |
Да |
Да |
|
Эмбриональные стволовые клетки |
Фибробластоподобная |
+ |
+ |
- |
Нет данных |
Да |
Да |
|
Мышца конечности эмбриона |
Фибробластоподобная |
+ |
+ |
- |
Нет данных |
Да |
Да |
|
Кожа век взрослого донора |
Фибробластоподобная |
+ |
+ |
- |
- |
Да |
Да |
|
Пульпа зуба |
Фибробластоподобная |
+ |
+ |
- |
- |
Да |
Да |
Анализ способности выделенных клеток дифференцироваться в различные клеточные типы включал дифференцировку в остео- и хондрогенном направлении (рис. 3, 4). Также проанализирована способность дифференцировки клеток в одонтогенном направлении при применении стандартной дифференцирующей остеогенной среды.
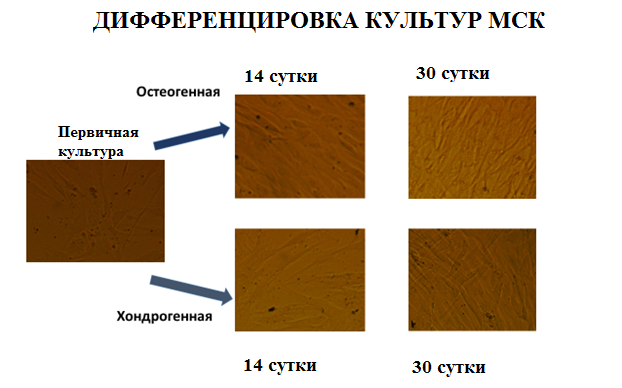
Рис. 3. Дифференцировка МСК из пульпы зуба в остео- и хондрогенном направлении
Успешность дифференцировки была подтверждена гистохимической окраской препаратов.
Анализ дифференцировки выделенных культур МСК в одонтобласты подтвердил возможность применения стандартной дифференцирующей остеогенной среды для получения специфических клеток зуба (рис. 4).
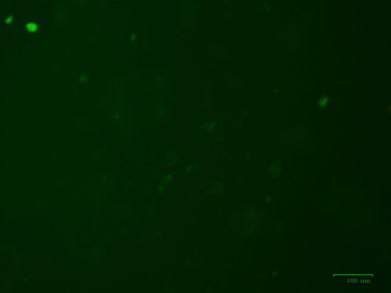
Рис. 4. Экспрессия DSPP МСК, дифференцированными стандартной остеогенной средой в специфические клетки – одонтобласты
Обсуждение
Использование стволовых клеток сегодня составляет основу активно развивающегося нового направления в медицине – клеточной заместительной терапии – направления, обеспечивающего возможности успешной регенерации тканей и органов человека. Проблема потери зубов в любом возрасте и по разным причинам, несмотря на успехи протезирования и имплантирования, до сих пор остается актуальной как для врачей-стоматологов, так и для пациентов [23]. Использование стволовых клеток и технологий тканевой инженерии в сочетании с возможностью использования биодеградируемых скэффолдов и биоактивных агентов в настоящее время составляют основу регенеративной стоматологии [24-26]. Учитывая особенности морфогенеза зуба, для регенерации его структур, за исключением эмали, необходимы мезенхимальные стволовые клетки. Несомненно, при трансляции экспериментальных моделей в клиническую практику существенное значение приобретает возможность работы с МСК, полученными у взрослых людей, что позволит избежать целого ряда этических вопросов, связанных с работой с эмбриональными клетками. Особое значение в качестве возможного источника взрослых МСК для регенерации зубов приобретают эпигенетически родственные источники, прежде всего непосредственно зуб.
Разработанная в результате проведенных экспериментов методика выделения стволовых клеток из пульпы третьих моляров взрослых пациентов позволяет получить пул стволовых клеток, отвечающий основным характеристикам пула мезенхимальных стволовых клеток, выделенных из иных источников [27]. Проанализирован ряд базовых характеристик, включающих морфологию клеток, их способность к мультилинейной дифференцировке, и имеющая существенный интерес способность дифференцироваться в клетки-предшественники дентина – одонтобласты, а также экспрессия целого ряда типичных для МСК поверхностно-клеточных маркеров.
Установлено, что полученный согласно разработанной методике пул клеток полностью соответствует морфологически паспортам МСК, полученных и охарактеризованных в РККК [27]. Экспрессия основных поверхностно-клеточных маркеров (CD90, CD105) клетками линии, полученной в ходе предлагаемой методики, также согласуется с представленными данными об уровне средней экспрессии данных маркеров в паспорте МСК, полученных из костного мозга эмбриона: 98,5% ± 3,8% vs 87,4±4,6% и 96,8% ± 2,9% vs 95,4±2,5% соответственно [27]. Доказана способность полученных клеток к дифференцировке в остеогенном и хондрогенном направлениях, что полностью отвечает свойствам МСК, выделенных из других источников (таблица). Кроме того, проведенный иммуноцитохимический анализ показал способность дифференцированных клеток к экспрессии сиалофосфопротеина дентина (DSPP), что дает основания к разработке методики дифференцировки МСК в клетки-предшественники дентина и подтверждает одонтогенный потенциал выделенного пула МСК.
Заключение
Таким образом, выделенный в соответствии с разработанной методикой пул клеток из третьих моляров взрослых пациентов характеризуется основными чертами, свойственными мезенхимальным стволовым клеткам, выделенным из других источников - способностью к самообновлению и мультилинейной дифференцировке, обладает остео-одонтогенным и хондрогенным потенциалом, что позволяет рассматривать данный источник клеток в качестве перспективного для инженерии зуба.
Библиографическая ссылка
Лямина С.В., Калиш С.В., Рунова Г.С., Малышев И.Ю. ВЫДЕЛЕНИЕ МЕЗЕНХИМАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК ИЗ ПУЛЬПЫ ЗУБА И ИХ ХАРАКТЕРИСТИКА // Современные проблемы науки и образования. – 2017. – № 5. ;URL: https://science-education.ru/ru/article/view?id=27056 (дата обращения: 25.04.2024).



