Высокоэффективная жидкостная хроматография с масс-спектрометрическим детектированием является одним из наиболее перспективных методов для идентификации и количественного определения лекарственных веществ в различных биологических объектах. Метод отличается высокой специфичностью, точностью и возможностью определения веществ в минимальных концентрациях, что позволяет использовать его для количественного определения лекарственных веществ при проведении фармакокинетических исследований и лекарственного мониторинга, что является значимым для клинической лабораторной диагностики. С этой целью необходима разработка и валидация методик количественного определения различных лекарственных веществ, в том числе инновационных, на основе ВЭЖХ-МС/МС-метода.
Оригинальным лекарственным веществом из группы нестероидных противовоспалительных средств является ацексазоламид – новое производное амида 1,3,4-тиадиазола и ацексамовой кислоты. Существенным преимуществом данного соединения является невысокая токсичность и низкая ульцерогенность [5, 6]. Для проведения фармакокинетических исследований и оценки биодоступности данного лекарственного вещества при различных путях введения необходима разработка надежной методики его количественного определения в биологических жидкостях.
Целью настоящего исследования явилась разработка методики идентификации и количественного определения нового нестероидного противовоспалительного средства из группы производных тиадиазола с помощью ВЭЖХ-МС/МС.
Материалы и методы
Объектом исследования явилось новое производное тиадиазола с лабораторным шифром ЛХТ7-09, синтезированное в ОАО «ВНЦ БАВ» (г. Старая Купавна) проф. С.Я. Скачиловой (рис. 1).
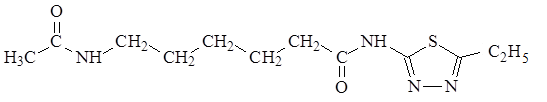
2-(5-этил-1,3,4-тиадиазолил)амид 2-ацетиламиногексановой кислоты
Рис. 1. Химическая структура ЛХТ7-09 (брутто формула: С12Н20N4О2S; молярная масса 284,4 г/моль)
Соединение ЛХТ7-09 по внешнему виду представляет собой порошок белого цвета, который практически не растворим в воде, растворим в спирте, легко растворим в ацетонитриле.
Для идентификации и количественного определения ЛХТ7-09 использовали валидированный метод высокоэффективной жидкостной хроматографии с масс-спектрометрическим детектированием (ВЭЖХ-МС/МС).
Хроматографию осуществляли с помощью высокоэффективного жидкостного хроматографаAgilent 1260 InfinityII(AgilentTechnologies, ФРГ). В исследовании использовали аналитическую колонку AgilentPoroshell 120 EC-C18 2,7 мкм 2,1×10 мм. Для выделения исследуемого соединения нами был разработан градиентный режим хроматографии. В качестве элюента применяли ацетонитрил, воду деионизированную и аммония ацетат в различных соотношениях.
Для масс-спектрометрии использовали тройной квадрупольный масс-спектрометр ABSciexQTrap 3200 MD(ABSciex, Сингапур) с электрораспылительным источником ионов (TurboV с зондом TurboIonSpray). Калибровку масс-спектрометра проводили с помощью тестового раствора резерпина в концентрации 6,1×10–2 мг/л.
Масс-спектрометрический анализ исследуемых образцов проводили в режиме электрораспыления при прямом вводе образца и элюата, подаваемого хроматографом. Прямой ввод исследуемых образцов в масс-хроматограф осуществляли с помощью шприцевого насоса диаметром 4,61 мм со скоростью 10 мкл/мин.
При разработке методики идентификации и количественного определения нового производного тиадиазола подбирали оптимальные условия высокоэффективной жидкостной хроматографии и масс-детектирования. Учитывали время выхода вещества из хроматографической колонки и MRM-переход (осуществляли регистрациюm/z иона-предшественника на первом аналитическом квадруполе Q1 и m/z ионов-продуктов на втором аналитическом квадруполе Q3). Для количественного определения ЛХТ7-09 проводили построение калибровочного графика в диапазоне концентраций от 0,397 до 397 нг/мл.
В качестве программного обеспечения использовали AnalystMD 1.6.2.Software (ABSciex).
Результаты и обсуждение
На первом этапе экспериментального исследования осуществляли масс-детектирование исследуемого образца путем его прямого ввода в масс-детектор с помощью шприцевого насоса. На этапе пробоподготовки получали раствор ЛХТ7-09(500 нг/мл) в смеси ацетонитрила и воды ионизированной в соотношении 2:1 с добавлением аммония ацетата (0,1%).
Предварительные эксперименты показали, что в режиме регистрации положительных ионов чувствительность определения ЛХТ7-09 была выше, а масс-спектр интенсивнее и информативнее, чем в режиме регистрации отрицательных ионов. В связи с этим в дальнейших исследованиях использовали только режим положительной ионизации.
Для получения интенсивного пика были подобраны следующие условия масс-детектирования: положительная поляризация, напряжение электроспрея 5500,0 В, потенциал декластеризации и потенциал ввода – соответственно 36,0 и 6,5 В при давлении газа завесы 20,0 psi и газа распыления 40,0 psi, скорость 10 мкл/мин. Диапазон сканирования составлял 270–300 Да.
Анализ полученного масс-спектрана первом аналитическом квадруполе Q1 показал, что в данных условиях за счет присоединения протона водорода образуется протонированная молекула исследованного соединения [M+H]+ со значением m/z285,2 Да (рис. 2).
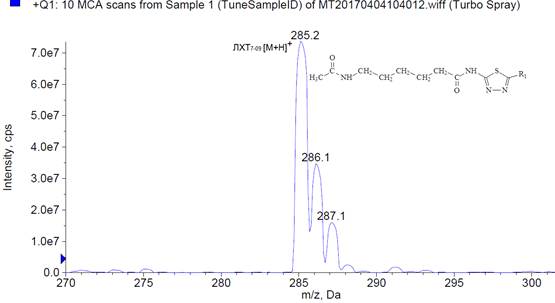
Рис. 2. Масс-спектр протонированной молекулы ЛХТ7-09(в режиме сканирования положительных ионов [M+H]+)
На втором аналитическом квадруполе Q3 осуществляли регистрацию ионов-продуктов для иона-предшественника со значением m/z285,2 Да. Анализ масс-спектра 2 порядка показал наличие множества пиков, из которых 3 были наиболее интенсивными – m/z 114,2 Дa, m/z 130,2 Дa и m/z 75,1 Дa (рис. 3).
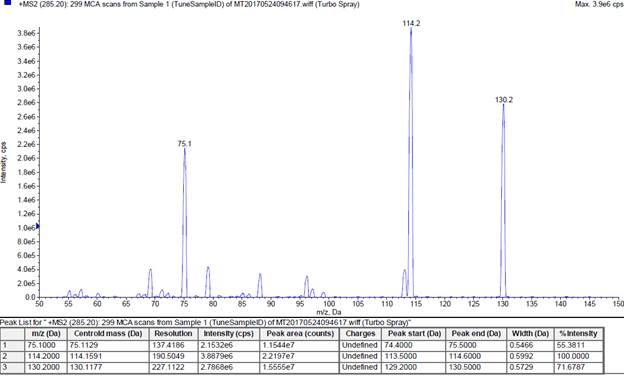
Рис. 3. Масс-спектр ионов-продуктов (в режиме сканирования положительных ионов, ион-предшественник m/z 285,2 Да)
Для получения ионного сигнала высокой интенсивности были подобраны оптимальные значения энергии в ячейке соударения Q2 (рассмотрен диапазон энергий от 0 до 400 В). Для ионов-продуктов со значениями m/z114,2 Дa, 130,2 Дa и 75,1 Дaоптимальная энергия в соударительной ячейке составила соответственно 27 В; 23 В и 49 В.
Предполагается, что ион-продукт со значением m/z114,2 Дa является фрагментом 5-амино-2-этил-1,3,4-тиадиазола, так как при фрагментации других производных 1,3,4-тиадиазола также выявляется ион-продукт с таким же значением m/z. Ион-продукт со значением m/z 130,2 Да, вероятно, является протонированным фрагментом ацексамовой кислоты. Таким образом, результаты проведенного масс-детектирования исследуемого образца подтвердили химическую структуру нового производного 1,3,4-тиадиазола.
На следующем этапе экспериментального исследования осуществляли анализ исследуемого соединения методом ВЭЖХ-масс-спектрометрии.
В режиме ВЭЖХ-МС/МС использовали следующие условия ионизации: напряжение электроспрея 5500,0 В, скорость потока подвижной фазы 400 мкл/мин, температура азота 400 °С, давление газа завесы и распыляющего потока 20,0 и 50,0 psi соответственно. Скорость регистрации единичных масс-спектров составила 100 спектров в секунду. Для получения суммированного масс-спектра на хроматограмме выделяли временной промежуток 10,5–11,5 мин; по интенсивности сигнала ионов-продуктов строили кривые временной зависимости ионного тока и площади пиков отдельных сигналов, соответствующих исследуемому соединению. Объем вводимой пробы в аналитическую колонку составил 10 мкл.
Для выделения исследуемого соединения был использован градиентный режим высокоэффективной жидкостной хроматографии, который обеспечивался изменением состава элюента на входе в аналитическую колонку. В качестве элюента применяли ацетонитрил, воду деионизированную и аммония ацетат в различных соотношениях. Выбор градиентного режима хроматографии был связан с тем, что в условиях изократического режима элюирования (в том числе при использовании разных концентраций ацетонитрила) не удавалось получить пик исследуемого вещества симметричной формы с пригодным для анализа временем удерживания. По данным проведенного исследования оптимальным был следующий режим подачи элюента: с 0 до 4 мин концентрация ацетонитрила 1%; с 4 по 8 мин линейное увеличение концентрации ацетонитрила до 99 %; с 8 по 12 минуту – изократический участок (1% ацетонитрила). По завершении исследования осуществляли промывку хроматографической колонки 30 % раствором ацетонитрила в течение 5 минут.
При использовании описанного режима хроматографии для исследованного соединения был получен симметричный пик достаточной интенсивности (рис. 4).
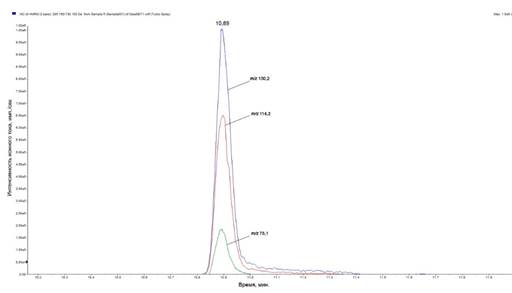
Рис. 4. Хроматограмма ЛХТ 7-09 (аналитическая колонка Agilent Poroshell 120 EC-C18 2,7 мкм 2,1×10 мм; градиентный режим хроматографии)
Анализ полученных хроматограмм для растворов ЛХТ 7-09 разной концентрации показал, что время удерживания (tR) при данных условиях элюирования составило 11 минут и не зависело от концентрации исследуемого вещества. В связи с этим значение времени удерживания можно использовать в качестве дополнительного критерия подтверждения подлинности ЛХТ 7-09 в составе многокомпонентных смесей. Обращает на себя внимание тот факт, что данные параметры хроматографии можно использовать для идентификации ЛХТ 7-09 не только с помощью масс-детектора, но и других детекторов, в том числе фотометрического.
Для количественного определения нового производного тиадиазола осуществляли построение калибровочного графика в диапазоне концентраций от 0,397 нг/мл до 397 нг/мл (рис. 5).
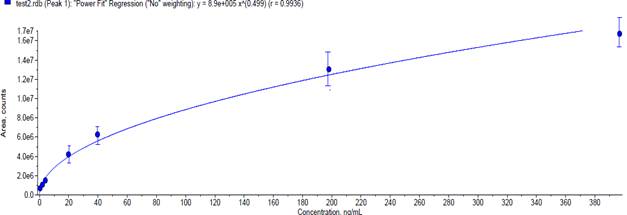
Рис. 5. Калибровочный график для определения концентрацииЛХТ7-09 (по оси абсцисс – концентрация ЛХТ7-09 в нг/мл, по оси ординат – площадь пика в импульсах)
Для разработки градуировочного решения использовали растворы ЛХТ7-09 в концентрациях 0,397; 1,980; 3,970; 19,8; 39,7; 198,0; 397,0 нг/мл. Зависимость площади пика от концентрации исследованного соединения описывалось следующим уравнением регрессии:
y= 8,9e5·x0,499, значение коэффициента регрессии составило r=0,9936.
Следует отметить, что разработанное градуировочное решение позволяет с высокой точностью осуществлять количественное определение исследованного соединения в широком диапазоне концентраций, что позволяет использовать данный метод для оценки качества лекарственного вещества и для проведения фармакокинетических исследований.
Таким образом, результатом проведенного исследования явилась разработка метода идентификации и количественного определения нового аминокислотного производного тиадиазола с помощью ВЭЖХ-МС/МС.
Выводы
- ВЭЖХ-МС/МС позволяет с высокой точностью осуществлять идентификацию и количественное определение нового аминокислотного производного тиадиазола.
- Масс-детектирование нового производного тиадиазола ЛХТ 7-09 целесообразно проводить в режиме сканирования положительных ионов (МRM-переход – ион-предшественник Q1 m/z285,2 Да; ионы-продукты Q3m/z 114,2 Дa, m/z 130,2 Дa и m/z 75,1 Дa).
- Для выделения ЛХТ 7-09 из многокомпонентных смесей разработана методика высокоэффективной жидкостной хроматографии (аналитическая колонка Agilent Poroshell 120 EC-C18 2,7 мкм 2,1×10 мм; элюент ацетонитрил: вода деионизированная: аммония ацетат; градиентный режим).
Библиографическая ссылка
Попов Н.С., Малыгин А.С., Демидова М.А. РАЗРАБОТКА ВЭЖХ-МС/МС-МЕТОДА ДЛЯ ИДЕНТИФИКАЦИИ И КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ НОВОГО ПРОИЗВОДНОГО ТИАДИАЗОЛА // Современные проблемы науки и образования. – 2017. – № 5. ;URL: https://science-education.ru/ru/article/view?id=26988 (дата обращения: 20.04.2024).



