Проблема загрязнения окружающей среды тяжелыми металлами остается актуальной и в настоящее время. Экономический кризис последних лет поставил в жесткие условия техногенную и производственную деятельность человека, что отрицательно отражается на его здоровье [3,6]. Регуляторная роль иммунной системы, находящейся в эволюционной связи с нервной и эндокринной системами, в поддержании внутреннего гомеостаза организма неоценима. Между тем последствием тяжелой антропогенной нагрузки на организм человека и животных может стать развитие иммунодепрессии [1,2,4,10]. Справедливости ради следует отметить, что механизмы токсического влияния многих ксенобиотиков, в том числе солей тяжелых металлов, достаточно изучены. Однако продолжающиеся воздействия перекрестных антропогенных вариаций могут вызывать изменения в организме, выходящие за рамки обычного понимания их патогенеза.
Хром и ванадий – два широко распространенных переходных металла-загрязнителя, вызывающие влияние на санитарное состояние окружающей среды в промышленно развитых и развивающихся странах. Люди могут подвергаться воздействию хрома и ванадия из различных источников: в результате антропогенной деятельности (промышленных выбросов, автомобильных выхлопных газов, сжигание ископаемого топлива, металлургии и загрязнения моря), курения, продуктов питания. Тяжелое воздействие металла является вредным из-за острого отравления, с одной стороны, и долгосрочной токсичности (за счет накопления), с другой стороны [5,8,9]. Тем не менее мало известно о влиянии подострого воздействия хрома и ванадия на жизнедеятельность организма. Поэтому мы попытались определить, являются ли эти два металла потенциальными факторами риска развития иммунодепрессии.
Известно, что тяжелые металлы могут вызывать окислительное повреждение иммунной системы [7]. Источниками генерации активных форм кислорода становятся нейтрофилы, моноциты, дендритные клетки – главные участники оборонительной реакции организма. Производство АФК в митохондриях фагоцитирующих клеток необходимо для реакции респираторного взрыва. Между тем повышение проницаемости мембран митохондрий, приводящее к высвобождению АФК, снижение концентрации К+ в клетках, разрушение ядра, модифицированные липиды, кристаллы холестерина, вызываемые тяжелыми металлами, приводят к опасным для жизнедеятельности клеток повреждениям. Молекулы, высвобождаемые при повреждении клеток, называются DAMPs (damage-associated molecular patterns) – молекулярные структуры, ассоциированные с повреждением. Они активируют инфламасомы, выполняющие роль защиты организма-хозяина от вторжения патогенов. Важную роль в механизмах активации инфламасом отводят цитокинам [10].
В связи с вышеизложенным, целью настоящей работы явилось исследование сывороточных цитокинов у крыс, подвергавшихся двухнедельной интоксикации соединениями ванадия и хрома и поиск новых способов коррекции выявленных нарушений.
Материал и методы исследования
Работа выполнена в рамках проекта «Молекулярно-биологические особенности течения асептического воспаления, ассоциированного с экологенной иммунодепрессией» (сроки реализации: 2015–2017 гг.) при финансовой поддержке Министерства образования и науки Республики Казахстан.
Исследования проводились с соблюдением норм и правил проведения экспериментов с участием животных (заявка №166, решение ЛЭК КазНМУ им. С.Д. Асфендиярова, протокол № 3 от 01.04.2015).
Эксперименты выполнены на белых беспородных крысах-самцах массой 180–240 г, содержавшихся в стандартных условиях вивария на обычном пищевом рационе. Животных случайным образом разделили на 5 групп по 30 особей в каждой. Проведены 5 серий экспериментов: 1 серия – контроль; 2 серия – крысы, получавшие ванадат аммония (ВА) и бихромат калия (БК); 3 серия – ВА+БК+Полиоксидоний (ПО); 4 серия – ВА+БК+Оксифосфонат (ОФ); 5 серия – ВА+БК+Рувимин (Р). ВА и БК вводили перорально в течение двух недель в дозе по 5 мг/кг м.т. Контрольная группа животных получала равнозначный объем физиологического раствора для имитации тех же условий, как и у экспериментальных крыс. Через 1, 7 и 14 суток после окончания двухнедельной затравки животных ВА и БК у животных под хлороформовым наркозом проводили забор крови.
Определение сывороточных цитокинов проводили в лаборатории молекулярной иммунологии и иммунобиотехнологии Института молекулярной биологии и биохимии им. М.А. Айтхожина.
Статистическая обработка данных. Все эксперименты проводили в 3-4-кратной повторности. При этом высчитывали среднее арифметическое значение (M) и стандартное отклонение (СО). Достоверность различия Р рассчитывали по Манну – Уитни, считали достоверным при уровне значимости Р≤0,05.
Результаты и обсуждение
В свете важности роли цитокиновых взаимодействий при интоксикациях солями тяжелых металлов нами были исследованы концентрации сывороточных цитокинов (рисунок). По результатам проведенных исследований статистически значимых колебаний концентрации цитокинов в сыворотке периферической крови опытных крыс по сравнению с контролем не установлено.
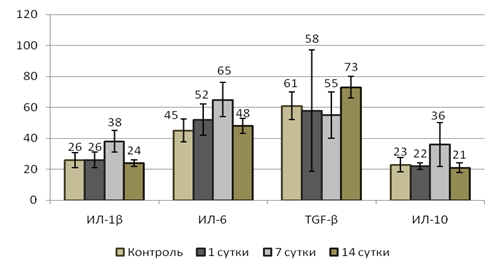
Содержание цитокинов в сыворотке периферической крови опытных крыс в сравнении с контролем
Отмечался лишь незначительный прирост на 7 сутки исследования концентрации ИЛ-6, ИЛ-1β и ИЛ-10 на 44,4 %, 52 % и 56,5 % соответственно. Содержание TGF-β на 14 сутки превышало контрольный уровень лишь на 20 %.
По результатам наших собственных исследований, а также литературным данным [9] было сделано заключение, что подобная незначительная цитокиновая реакция, по-видимому, является следствием слабовыраженного лейкоцитарного реагирования на белковые и небелковые модификаторы иммунного ответа (соли тяжелых металлов, продукты повреждения тканей, АФК и т.д.) вследствие высокой подверженности лейкоцитов к апоптозу. Наши результаты исследований согласуются со сведениями Mounira Т. et al, 2015, где было установлено, что вдыхание метаванадата аммония у крыс вызывало снижение экспрессии провоспалительных цитокинов ИЛ-1α, TNF-α, что существенно уменьшало приток полиморфноядерных нейтрофилов и альвеолярных макрофагов [9].
Иммунотоксическое действие исследованных солей тяжелых металлов подтверждалось нарушением активности сывороточных цитокинов, уровни которых несущественно отличались от значений контрольных крыс.
Результаты исследований, представленные в таблице, показывают, что при использовании препаратов в качестве иммуномодуляторов последовали наибольшие сдвиги показателей некоторых сывороточных цитокинов при отравлении солями ванадия и хрома.
Через 1 сутки после начала лечения ПО и ОФ наибольший пик концентрации наблюдали у ИЛ-6, значения которых на 105,8 % (р=0,0183) и 73,6 % (р=0,060) превышали показатели опытных крыс соответственно. Через 7 суток концентрация ИЛ-6 под влиянием этих препаратов продолжала нарастать, превышая аналогичные показатели нелеченных крыс на 154 % (р=0,0107) и 100,9 % (р=0,0044) соответственно.
Показатели крови опытных крыс, затравленных ВА и БК на фоне лечения полиоксидонием, оксифосфонатом и рувимином, в сравнении с нелеченной группой животных, М (СО)
|
Показатель |
N |
ВА+БК (опыт),(n=10) |
Опыт+ПО, (n=10) |
Опыт+ОФ, (n=10) |
Опыт+Р, (n=10) |
|
Через 1 сутки |
|||||
|
ИЛ-6 |
10 |
52,0 (0) |
107,0 (13,1)а |
90,3 (17,0)а |
76,3 (15,0)b |
|
ИЛ-1β |
10 |
25,7 (7,4) |
29,3 (2,3) |
28,7 (8,6) |
28,0 (1,7) |
|
TGF-β |
10 |
58,0 (11,0) |
49,3 (13,1) |
55,7 (10,0) |
64,7 (24,7) |
|
ИЛ-10 |
10 |
22,0 (5,2) |
21,0 (2,6) |
31,0 (6,1) |
24,0 (9,5) |
|
Через 7 суток |
|||||
|
ИЛ-6 |
10 |
64,7 (39,3) |
164,3 (27,0)а |
130,0 (9,2)а |
104,7 (10,5)a,b,c |
|
ИЛ-1β |
10 |
38,0 (8,9) |
33,3 (10,0) |
35,3 (8,5) |
31,0 (9,0) |
|
TGF-β |
10 |
55,0 (14,8) |
58,7 (12,0) |
49,3 (18,6) |
89,7 (10,1)a,b,c |
|
ИЛ-10 |
10 |
36,0 (6,9) |
28,3 (13,5) |
36,3 (15,7) |
20,0 (6,2)a,c |
|
Через 14 суток |
|||||
|
ИЛ-6 |
10 |
48,0 (2,3) |
82,0 (15,1)а |
162,0 (29,5)а,b |
117,3 (15,6)a,b |
|
ИЛ-1β |
10 |
24,0 (4,6) |
26,3 (4,7) |
30,0 (1,0) |
29,3 (0,6) |
|
TGF-β |
10 |
73,3 (14,3) |
65,0 (16,1) |
54,3 (9,5) |
70,3 (21,5) |
|
ИЛ-10 |
10 |
20,7 (2,9) |
19,7 (1,2) |
54,0 (13,1)a,b |
23,3 (2,9) |
|
Примечание: * – по Mann – Whitney U-test достигнутый уровень статистической значимости по отношению: а – к опыту; b – к ПО; с – к ОФ. |
|||||
Под влиянием рувимина концентрация ИЛ-6 к этому сроку исследования возрастала на 61,8 % (р=0,0201) по сравнению с показателями опыта без лечения, однако отставала от показателей «опыт+ПО» на 36,3 % (р=0,0475). Наряду с ИЛ-6 отмечалось двукратное статистически значимое увеличение противовоспалительного цитокина – TGF-β по сравнению с опытной группой и группой животных, леченных ПО и ОФ. Между тем концентрация ИЛ-10, также обладающего противовоспалительным действием, на столько же снижалась по сравнению с опытом и ОФ.
14 сутки исследования для ПО охарактеризовались снижением провоспалительной активности ИЛ-6 по сравнению с предыдущим сроком, уровень которого оставался выше уровня опытных крыс в 2 раза (р=0,0581).
Всплеск провоспалительной активности ИЛ-6 под влиянием ОФ и рувимина продолжался, превышая показатели опыта в 3,4 (р=0,0212) и 2,4 (р-0,0155) раза соответственно. Под влиянием ОФ к этому сроку исследования последовало трехкратное статистически значимое повышение концентрации ИЛ-10 в сыворотке крови по сравнению с опытом и «опыт+ПО».
Изменение активности цитокинов сыворотки крови под влиянием солей тяжелых металлов может быть результатом их повреждающего действия на мембранносвязанные рецепторы, улавливающие и передающие сигналы через клеточные мембраны. Классически провоспалительная активность (повышение) ИЛ-6 связана с мембранносвязанным рецептором IL-6R, который служит как датчик, отражающий сигналы первоначального повреждения от нейтрофилов [11]. Поэтому повышение провоспалительной активности ИЛ-6 под влиянием препаратов, возможно, связано с восстановлением трансмембранной сигнализации.
Заключение
На основании приведенных экспериментальных данных можно заключить, что выявленные нарушения у крыс, подвергавшихся двухнедельному воздействию ВА и БК, соответствовали картине иммуносупрессии, развившейся в результате цитотоксического действия солей ванадия и хрома, что нарушило взаимодействие между макрофагами и лимфоцитами. Предполагаемой молекулярной мишенью подобного рода нарушений является срыв сигнальных цитокиновых каскадов. Оценка иммунологической реактивности по исследованным показателям неспецифической резистентности позволила сделать вывод о развитии вторичного иммунодефицитного состояния у крыс, подвергавшихся двухнедельному воздействию ВА и БК.
Все препараты модулируют провоспалительную активность ИЛ-6. Вместе с тем рувимин модулирует противовоспалительную активность TGF-β на ранних этапах эксперимента, ОФ модулирует активность ИЛ-10 на поздних.
Библиографическая ссылка
Балабекова М.К. ИЗУЧЕНИЕ МЕТАЛЛИНДУЦИРОВАННОЙ ИММУНОДЕПРЕССИИ В ЭКСПЕРИМЕНТЕ // Современные проблемы науки и образования. – 2017. – № 5. ;URL: https://science-education.ru/ru/article/view?id=26926 (дата обращения: 25.04.2024).



