Ключевым вопросом понимания патофизиологии среднего отита является то, каким образом полость среднего уха, непосредственно контактирующая с носоглоткой, заселенной микроорганизмами, включая этиологические агенты среднего отита, сохраняется стерильной у здоровых людей [1, 2]. Механизмы, лежащие в основе полимикробной природы среднего отита, не вполне ясны. Тем не менее имеются свидетельства, указывающие на то, что вирус-опосредованные повреждения эпителия, выстилающего слизистую оболочку верхних дыхательных путей, снижение мукоцилиарного клиренса и повышенная экспрессия клетками организма молекул, которые способствуют адгезии бактерий, вносят вклад в патогенез среднего отита [3].
Систему механизмов врожденного иммунитета считают неотъемлемой частью защиты среднего уха от инфекций. Респираторный эпителий слизистых оболочек, в том числе среднего уха и слуховой трубы, секретирует антимикробные молекулы (белки – лизоцим, лактоферрин и катионные пептиды – дефенсины и кателицидины). Антимикробные пептиды (бета-дефенсины (hBD), кателицидин) играют основную роль в защите поверхности слизистых от широкого набора микроорганизмов (грамположительных и грамотрицательных бактерий, грибков, простейших и оболочечных вирусов), включая сочетанные вирусные и бактериальные патогены полимикробного заболевания – среднего отита, в том числе хронического среднего отита, рецидивирующего среднего отита и экссудативного среднего отита [4]. Пептиды обладают прямой и непрямой антимикробной активностью, могут выступать в качестве хемокинов, а также индуцировать продукцию хемокинов, приводящую к рекрутированию лейкоцитов в очаг инфекции, способствуют заживлению ран и способны модулировать адаптивный иммунный ответ.
Тестирование клинических изолятов респираторных патогенов среднего отита выявило бактерицидную активность hBD-2 в отношении грамотрицательных Moraxella catarrhalis, нетипируемого Haemophilus influenzae (NTHi) и грамположительного Streptococcus pneumoniae, а также бактерицидную активность hBD-1 в отношении M. catarrhalis и умеренный ингибирующий эффект на рост S. pneumoniae [5]. Кателицидин LL-37 и hBD-3 также действуют в туботимпануме и в микромолярных концентрациях убивают этиологические агенты среднего отита [4].
Многофакторная природа патогенеза хронического среднего отита включает в себя сложные взаимодействия микробных факторов, факторов риска окружающей среды и генетических факторов организма. Реакции организма на вирусные и бактериальные патогены при среднем отите определяются, по большей части, экспрессией генов во время взаимодействия организм-патоген [6]. В отношении иммунитета в медико-биологических исследованиях упрочиваются позиции заимствованной из эволюционной биологии концепции, согласно которой существуют две альтернативные стратегии защиты от инфекции: стратегия резистентности, направленная на детекцию и элиминацию внедряющихся патогенов; и стратегия толерантности, как способность допускать (терпеть) присутствие патогена [7]. Изменения этих двух фундаментальных механизмов защиты часто участвуют в других формах хронических воспалительных заболеваний и могут быть связаны также со склонностью к среднему отиту.
Целью работы явилась оценка состояния молекулярно-генетических основ активации элиминационных механизмов врожденного иммунитета путем исследования экспрессии генов антибиотических пептидов кателицидина LL-37 и бета-дефенсинов-1, -2, -3 человека в эпителии слизистой оболочки среднего уха при хронических воспалительных заболеваниях на основе определения мРНК.
Материал и методы
Материалом для исследования служили 92 образца слизистой оболочки ЛОР-органов полученные во время планового хирургического вмешательства в условиях общей анестезии. Образцы тканей немедленно помещали в стабилизирующий раствор RNAlater. Исследованы образцы слизистой оболочки барабанной и мастоидальной полости при разных формах хронического среднего отита и отосклерозе, в качестве контрольной ткани служили образцы слизистой нижних носовых раковин больных с искривлением перегородки носа, обычно используемые по данным литературы с этой целью. Вторым контролем служили образцы здоровой ткани слизистой оболочки среднего носового хода, полученные попутно в ходе операций. Образцы слизистой оболочки мастоидальной полости получены в случаях, когда объем операции требовал вскрытия клеток сосцевидного отростка.
Молекулярно-генетические исследования включали: выделение общей РНК из операционного материала, включающего поверхностный эпителий; синтез комплементарной к ДНК в реакции обратной транскрипции; амплификацию с использованием специфических праймеров и флюорофора SYBR Green (Bio-Rad) методом полимеразной цепной реакции (ПЦР) в режиме реального времени. Уровень экспрессии мРНК стандартизировали относительно экспрессии гена бета-актина [8, 9]. Последовательности праймеров, использованных для ПЦР амплификации: LL-37: прямой 5' tcaccagaggattgtgacttcaa 3' и обратный 5' tgagggtcactgtccccatac 3'; hBD-1: прямой 5' tgctgtttactctctgcttacttttgt 3' и обратный 5' ccaaggcctgtgagaaagttacc 3'; hBD-2: прямой 5' tgatgcctcttccaggtgttt 3' и обратный 5' ggatgacatatggctccactctt 3'; hBD-3: прямой 5' tatcttctgtttgctttgctcttcc 3' и обратный 5' cctctgactctgcaataatatttctgtaat 3'; бета-актин человека: прямой 5' gggtcagaaggattcctatg 3' и обратный 5' ggtctcaaacatgatctggg 3'.
Статистическую обработку данных проводили с помощью программы GraphPad Prism 5 методами описательной статистики с использованием непараметрических критериев различия (тест Манна – Уитни). Значения p<0,05 рассматривали как статистически значимые.
Результаты исследования и их обсуждение
Экспрессия генов LL-37 и hBD-1, -2, -3 детектирована в эпителии всех обследованных групп операционного материала (таблица, рисунок). Самая высокая частота детекции экспрессии генов индуцибельных бета-дефенсинов в полости среднего уха обнаружена при отите с холестеатомой: мРНК hBD-2: группа 4 и контроль 1, группы 4 и 6 отношение шансов (ОШ) 8,80 (95 % доверительный интервал 1,35÷57,43), группы 4 и 3 ОШ=19,20 (1,88÷196,55), группы 4 и 5 ОШ=5,87 (1,08÷32,00); группа 4 и контроль 1, группы 4 и 6 отношение рисков (ОР) 4,00 (1,05÷15,36), группы 4 и 3 ОР=8,00 (1,16÷55,20); мРНК hBD-3: группы 4 и 6 ОШ=14,00 (1,39÷141,49) (таблица). Экспрессия гена LL-37 в контрольных группах эпителия носа детектирована в 100 % случаев, тогда как в эпителии барабанной полости реже всего мРНК LL-37 выявлена при отосклерозе (стерильный процесс) и отите с холестеатомой: группа 6 и контроли 1, 2 ОШ=31,15 (1,53÷633,17), ОР=3,17 (1,63÷6,14); группа 4 и контроли 1, 2 ОШ=23,40 (1,15÷477,59), ОР=2,86 (1,57÷5,19).
Частота детекции экспрессии генов кателицидина LL-37 и бета-дефенсинов-1, -2, -3 в эпителии слизистой оболочки среднего уха при хронических воспалительных заболеваниях
|
№ группы |
Образцы слизистой оболочки |
Частота детекции экспрессии генов |
|||||||
|
hBD-1 |
hBD-2 |
hBD-3 |
LL-37 |
||||||
|
Абс.ч. |
% |
Абс.ч. |
% |
Абс.ч. |
% |
Абс.ч. |
% |
||
|
1 |
Нижние носовые раковины (контроль 1) |
13/13 |
100 |
2/13 |
15,38 |
2/13 |
15,38 |
13/13 |
100 |
|
2 |
Слизистая оболочка барабанной полости при хроническом туботимпанальном среднем отите, центральная перфорация |
13/13 |
100 |
5/13 |
38,46 |
6/13 |
46,15 |
9/13 |
69,23 |
|
3 |
Слизистая оболочка барабанной полости при хроническом туботимпанальном среднем отите, тимпаносклерозе |
13/13 |
100 |
1/13 |
7,69 |
5/13 |
38,46 |
9/13 |
69,23 |
|
4 |
Слизистая оболочка барабанной полости при хроническом гнойном эпиантральном среднем отите, холестеатоме |
13/13 |
100 |
8/13 |
61,54 |
7/13 |
53,85 |
7/13 |
53,85 |
|
5 |
Слизистая оболочка мастоидальной полости при хроническом гнойном эпиантральном среднем отите, холестеатоме |
14/14 |
100 |
3/14 |
21,43 |
4/14 |
28,57 |
10/14 |
71,43 |
|
6 |
Слизистая оболочка суперструктур стремени при отосклерозе, тугоухости |
13/13 |
100 |
2/13 |
15,38 |
1/13 |
7,69 |
6/13 |
46,15 |
|
7 |
Слизистая оболочка среднего носового хода при кисте лобной пазухи / сфеноидите / кисте верхнечелюстной пазухи / искривлении перегородки носа / эпифоре / ликворее / дакриоцистите/ инородном теле верхнечелюстной пазухи (контроль 2) |
13/13 |
100 |
3/13 |
23,08 |
4/13 |
30,77 |
13/13 |
100 |
Уровни экспрессии гена LL-37 в эпителии среднего уха снижены по сравнению с полостью носа: контроль 1 и группы 2, 4, 6 (p<0,001), 3, 5 (p<0,01); контроль 2 и группы 2, 4 (p<0,001), 5, 6 (p=0,001) и 3 (p<0,01). В барабанной полости самая высокая экспрессия гена LL-37 детектирована при отосклерозе. Уровни конститутивной экспрессии гена hBD-1 в эпителии барабанной полости, за исключением тимпаносклероза, выше, чем в контроле: контроль 1 и группы 2, 6 (p<0,05), 4 (p<0,01); контроль 2 и группа 4 (p<0,05), наиболее высокие при отите с холестеатомой. Уровни экспрессии гена hBD-2 повышены при отите с холестеатомой по сравнению с контролем: контроль 1 и группа 4 (p<0,01); контроль 2 и группа 4 (p<0,05) и по сравнению с тимпаносклерозом и отосклерозом: группы 4 и 3, 6 (p<0,01). Наиболее высокие уровни экспрессии гена hBD-3 выявлены при отите с холестеатомой, самые низкие – при отосклерозе: контроль 1 и группа 4 (p<0,05); группы 2 и 6 (p<0,05); группы 4 и 6 (p<0,02) (рисунок).
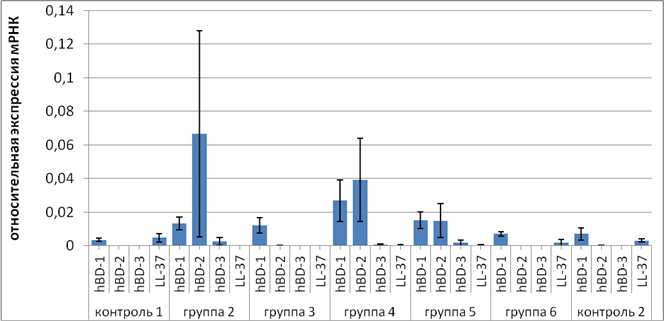
Относительная экспрессия мРНК кателицидина LL-37 и бета-дефенсинов-1, -2, -3 человека в поверхностном эпителии слизистой оболочки среднего уха при хронических воспалительных заболеваниях (среднее±ошибка среднего). Достоверность различий приведена в тексте статьи. Номера групп соответствуют группам в таблице
И в моделях среднего отита у животных, и в моделях культуры эпителиальных клеток среднего уха человека [2] продукция бета-дефенсинов сильно возрастает и формирует молекулярную базу эффективной инактивации обычных распространенных патогенов, ассоциированных со средним отитом. В литературе описана конститутивная экспрессия гена бета-дефенсина мыши mBD-1 в нормальной слизистой среднего уха и слуховой трубы (полуколичественная ПЦР) и возрастающая регуляция индуцибельной экспрессии генов и пептидов mBD-2, mBD-3 и mBD-4 (полуколичественная ПЦР и иммуноблот) при экспериментальном среднем отите, тогда как нормальный туботимпанум мышей их не экспрессировал [10]. Быстрое (4 часа после инокуляции в ухо мышам NTHi) повышение уровней mBD-2 расценивали как свидетельство того, что единственным источником мРНК mBD-2 были эпителиальные клетки среднего уха, а не воспалительные клетки, т.к. моноциты за это время еще не инфильтрировали полость среднего уха [2].
Методами гибридизации in situ показана продукция мРНК гомолога кателицидина c CRAMP в эпителии слуховой трубы, методом ПЦР в реальном времени – в других отделах верхних дыхательных путей шиншиллы [4]. Инкубация эпителиальных клеток среднего уха шиншиллы с вирусными (вирус гриппа A, аденовирус или респираторно-синцитиальный вирус (RSV)) или бактериальными (NTHi, M. catarrhalis или S. pneumoniae) патогенами, ассоциированными со средним отитом, показала различные специфичные для микробов паттерны изменения экспрессии (ПЦР в реальном времени) мРНК cCRAMP [4]. Интраназальное заражение шиншилл RSV снижало экспрессию бета-дефенсина-1 шиншиллы cBD-1 (соответствует hBD-3) на уровнях мРНК (ПЦР в реальном времени) и белка в гомогенатах слизистой оболочки носоглотки, носовой раковины, перегородки носа и слуховой трубы, особенно в носоглоточном устье (участке с самой большой экспрессией мРНК cBD-1), что приводило к образованию очагов вирусной репродукции на всем протяжении верхних дыхательных путей, включая слуховую трубу, и усиленной колонизации носоглотки NTHi. Этот процесс был обратим при введении шиншиллам либо рекомбинантного cBD-1, либо рекомбинантного hBD-3 [3].
При исследовании связи между экспрессией бета-дефенсинов и образованием холестеатомы в нехолестеатомных контрольных образцах слизистой оболочки среднего уха человека показана конститутивная экспрессия мРНК hBD-1 (11/18) и индуцибельная экспрессия мРНК hBD-2 (37,5 %) при хронических инфекциях среднего уха и холестеатоме [11]. В нашей работе экспрессия генов LL-37 и hBD-1, -2, -3 детектирована в эпителии слизистой оболочки барабанной и мастоидальной полостей при разных формах хронического среднего отита и отосклерозе.
В качестве преобладающего этиологического агента хронического среднего отита, рецидивирующего среднего отита и экссудативного среднего отита признают NTHi [12]. Хронический средний отит и рецидивирующий средний отит включают в себя компонент биопленок, которые обычно содержат S. pneumoniae, NTHi, коагулазо-негативные стафилококки или Staphylococcus aureus [13]. Наиболее частыми патогенами хронического гнойного среднего отита и отита с холестеатомой считают Pseudomonas aeruginosa и S. aureus [13]. Известно также, что hBD-2 проявляет мощную антимикробную активность в отношении грамотрицательных бактерий и Candida, однако менее эффективен в отношении грамположительного S. aureus [2]. По-видимому, различия колонизирующих патогенов обусловили выявленную нами максимальную частоту детекции и уровни экспрессии индуцибельных генов пептидов hBD-2 и hBD-3 в слизистой оболочке барабанной полости при отите с холестеатомой. С этим наблюдением согласуются данные, полученные при изучении бактериальных инфекций других локализаций. Например, при экспериментальном бактериальном кератите показано, что для резистентности мышей к индуцированной P. aeruginosa инфекции роговицы необходим mBD-2, а не mBD-1 [14].
Измененная экспрессия даже единственного антимикробного пептида может влиять на способность бактерий колонизировать организм. Часть авторов считают hBD-3 решающим антимикробным пептидом защиты среднего уха [3, 4]. Другие отводят hBD-2 центральную роль среди антимикробных молекул, роль в защите от главных патогенов среднего отита, который индуцируется множеством агентов, включая цитокины, NTHi и его молекулы/компоненты [2, 5, 12], и считают его главным эффектором с точки зрения хронических воспалительных реакций эпителия. Трансдукция аденовирусным вектором Ad-DEFB4 гена hBD-2 в барабанную полость мышей с экспериментальным средним отитом стимулировала выработку пептида, снижение индуцированной NTHi экссудации и усиленный клиренс (удаление) NTHi из полости среднего уха; in vitro угнетала адгезию NTHi к эпителиальным клеткам среднего уха человека [12].
Показано in vitro, что инкубация эпителиальных клеток среднего уха шиншиллы с NTHi умеренно снижает относительное содержание мРНК cBD-1 [5], инкубация клеток респираторного эпителия шиншиллы с RSV приводит к сниженной экспрессии cBD-1 на уровнях мРНК и белка [3]. Анионная внеклеточная ДНК биопленок NTHi связывает hBD-3 и снижает его антимикробную активность [14]. Индуцированное NTHi и/или RSV снижение относительного содержания мРНК и пептида hBD-3, вероятно, также встречается в верхних дыхательных путях человека, способствуя усиленной бактериальной колонизации, которая, как известно, предшествует развитию среднего отита.
По мере созревания биопленок NTHi повышение относительного содержания внеклеточной ДНК может минимизировать способность вновь выработанных внутри среднего уха катионных антимикробных пептидов hBD-3, hBD-2 и LL-37 эффективно уничтожать биопленки [15]. Признано, что инфекции среднего уха инициируют гиперплазию слизистой оболочки путем метаплазии/гиперплазии мукоидных клеток, что вызывает повышенную секрецию слизи [8]. В частности, NTHi усиливает выработку клетками респираторного эпителия шиншиллы муцинов, которые, как известно, ингибируют антибактериальную активность LL-37 [15]. Аналогичные изменения могут иметь место при хронических заболеваниях среднего уха человека. В исследованных нами образцах слизистой оболочки барабанной полости при хроническом туботимпанальном среднем отите, центральная перфорация, макроскопически в 53,8 % случаев наблюдали утолщение и полипоз. Детектированные нами уровни экспрессии мРНК LL-37 во всех образцах слизистой оболочки среднего уха снижены по сравнению с контролями.
Заключение
В работе показано, что в эпителии среднего уха экспрессированы гены антимикробных молекул кателицидина LL-37 и бета-дефенсинов-1, -2, -3 человека, подавляющих жизнеспособность распространенных отопатогенов. По-видимому, при наличии перфорации барабанной перепонки в полости среднего уха формируется биоценоз (микробиом), характерный для нормального функционирования бактериально колонизированной полости носа, содержащий в своем составе условно патогенные этиологические агенты среднего отита. Различия частоты детекции генов индуцибельных антимикробных пептидов в эпителии среднего уха могут быть обусловлены характером колонизирующих патогенов, поступающих из носоглотки. Отличия экспрессии генов при хроническом среднем отите с холестеатомой, вероятно, связаны с поступлением отопатогенов также из наружного слухового прохода, при отосклерозе – с сохранением стерильности полости среднего уха. В условиях ремиссии хронических воспалительных заболеваний ведущую роль в антимикробной защите среднего уха среди антибиотических пептидов барьерного эпителия, по-видимому, играет бета-дефенсин-1 человека, в полости носа – бета-дефенсин-1 человека и кателицидин LL-37. По-видимому, доминирующей стратегией двухкомпонентной иммунной защиты на уровне эпителия среднего уха в условиях планового хирургического лечения хронических воспалительных заболеваний является стратегия относительной толерантности (снижение иммунопатологического воздействия данной патогенной нагрузки), а не резистентности (снижение патогенной нагрузки).
Библиографическая ссылка
Тырнова Е.В., Алешина Г.М., Янов Ю.К., Кокряков В.Н. ОЦЕНКА ЭКСПРЕССИИ ГЕНОВ КАТЕЛИЦИДИНА LL-37 И БЕТА-ДЕФЕНСИНОВ-1, -2, -3 ЧЕЛОВЕКА В СЛИЗИСТОЙ ОБОЛОЧКЕ СРЕДНЕГО УХА ПРИ ХРОНИЧЕСКИХ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЯХ // Современные проблемы науки и образования. – 2017. – № 5. ;URL: https://science-education.ru/ru/article/view?id=26906 (дата обращения: 26.04.2024).



