Транскраниальная электростимуляция (ТЭС-терапия) оказывает системное стресс-лимитирующее воздействие на нейроиммуноэндокринную регуляцию, связанное с усилением синтеза и секреции β-эндорфина, а также модуляцией работы серотонинергического, дофаминергического и холинергического механизмов [1-4]. В единичных работах показана возможность ТЭС-терапии подавлять гиперактивацию нейронов стресс-респонсивных структур мозга (отражающуюся в усилении экспрессии гена c-fos) [1]. Однако существует необходимость расширить и дополнить представления об этом аспекте антистрессорного эффекта данного метода. А именно, изучить характер активации нейронов медиальной префронтальной коры (мПФК), важнейшего координатора высокоорганизованной обработки информации о психогенных стрессорах, на модели комбинированного стресса (чрезвычайно часто имеющего место in natura) и влияние ТЭС-терапии на этот процесс.
Целью нашей работы является изучение возможности коррекции ТЭС-терапией выраженности индуцированной комбинированным стрессом экспрессии c-fos нейронами медиальной префронтальной коры крыс.
Материалы и методы исследования
Исследование было произведено на 50 взрослых белых нелинейных крысах-самцах массой 200-250 г. Содержание животных и постановка экспериментов проводились в соответствии с требованиями Приказа № 199н МЗ РФ от 01.04.2016 г. и Международными рекомендациями по проведению медико-биологических исследований с использованием лабораторных животных (1985).
Период адаптации перед экспериментом для всех крыс составлял 7 дней. Животные интактной группы не включались в эксперимент, забор материала производился в первый день после адаптации. Оценка выносливости, работоспособности и стрессоустойчивости остальных крыс производилась в первый день после адаптации при помощи модифицированного НЦБМТ РАМН (Научный центр биомедицинских технологий) теста вынужденного плавания (плавательного теста) [5]. Для этого стеклянный аквариум, квадратный в сечении (длина стороны 30 см), заполнялся водой (высота водного столба 40 см, температура воды 28 °C). К хвосту животного прикреплялся груз (10% от массы тела). Животное погружалось в аквариум и после утомления извлекалось из воды. Критериями утомления являлись отказ от плавания, невозможность всплытия на поверхность и адинамия более 10 секунд [3]. Оценка стрессоустойчивости осуществлялась по времени плавания до утомления. В эксперимент включались крысы, длительность плавания которых не отклонялась от среднего времени более чем на 35% [5]. После этого животные случайным образом разделялись на две группы: основную (ТЭС-терапия со 2-го по 6-й день, n=20) и группу сравнения (без ТЭС-терапии, n=20). За исключением ТЭС-терапии, все релевантные условия содержания, манипуляции и процедуры, производимые над животными основной группы и группы сравнения, были идентичны. ТЭС-терапия проводилась по методике, описанной нами ранее [2].
На 7-й и 8-й дни моделировался комбинированный стресс. Для этого использовались тест вынужденного плавания в модификации НЦБМТ РАМН, производимый на 7-й день, и ортостатический стресс на 8-й день. Ортостатический стресс (ОС) включал в себя фиксацию крыс в специальных футлярах из оргстекла (объем 0,75×10-3 м3) вниз головой под прямым углом к горизонтальной поверхности. ОС сочетался, таким образом, с иммобилизацией. Время пребывания в антиортостатическом положении составляло 45 минут. Через 2 часа после ОС производился забор материала. Перед этим животное наркотизировали, используя золетил 0,8 мг на 100 г веса крысы в/м (Virbac, Франция), ксиланит 0,8 мг на 100 г веса крысы в/м (ЗАО «НИТА-ФАРМ», Россия, Саратов) [2]. Глубину наркоза верифицировали по угнетению роговичного рефлекса и исчезновению реакции на болевые раздражители.
Оценка экспрессии c-fos в префронтальной коре производилась иммуногистохимическим методом. После извлечения головной мозг фиксировался иммерсионным методом в 10%-ном нейтральном забуференном формалине. Дегидратация и заключение в парафин осуществлялись по стандартной методике при помощи гистопроцессора TP1020 (Leica, Germany) и модульной установки EG1150H (Leica, Germany). Cрезы толщиной 5 мкм, изготовленные с помощью ротационного микротома RM2235 (Leica, Germany), подвергались депарафинизации и регидратации. Эндогенная пероксидазная активность блокировалась добавлением 3%-ного раствора H2O2. Температурное восстановление эпитопа осуществлялось экспозицией в растворе Access Rodent (Menarine diagnostics, Italy) при температуре 95 °C (40 минут). Неспецифическая иммунореактивность блокировалась добавлением раствора Rat Background Block (Menarine diagnostics, Italy). Срезы инкубировались при комнатной температуре в течение 1 часа с первичными поликлональными кроличьими анти-Fos антителами (1:100, ab209794, Abcam, UK). Для отрицательного контроля вместо первичных антител добавлялся фосфатный буферный раствор. Детекция белка интереса осуществлялась по системе ABC (avidin-biotin complex). После инкубации с биотинилированными козьими антителами (ab64261, Abcam, UK) в течение 10 минут при комнатной температуре, и четырехкратной отмывки фосфатным буферным раствором добавлялся стрептавидин, конъюгированный с пероксидазой хрена (ab64261, Abcam, UK) на 10 минут при комнатной температуре. Затем срезы промывались 4 раза, и добавлением DAB хромогена на 5 минут выявлялся белок интереса. После этого производились четырехкратная отмывка фосфатным буферным раствором, контрастирующее окрашивание, дегидратация в спиртах восходящей концентрации и ксилоле и заключение срезов в монтирующую среду ConsulMount (Thermo Fisher Scientific, USA). Реакция считалась положительной при появлении коричневой окраски.
Идентификация уровней срезов и границ анатомических структур осуществлялась при помощи стереотаксических атласов мозга крысы [6]. Изучение срезов и получение фотографий проводилось с помощью микроскопа Olympus IX51 (Olympus, Japan). Изображения, имеющие одинаковые увеличение и разрешение, сохранялись в виде отдельных файлов в формате tiff без сжатия. Посредством графического редактора GNU Image Manipulation Program (Free Software Foundation, USA) производилось выравнивание экспозиции и нормализация по балансу белого. Подсчет иммунореактивных клеток производился в симметричных отделах коры обоих полушарий. В каждом полушарии изучались 6 фиксированных областей площадью 0,0625 мм2 (0,25×0,25 мм), включавших в себя поверхностные (прилежащие срединным структурам) и глубокие слои (прилежащие forceps minor corporis callosi) передней цингулярной коры (АС), инфралимбической коры (IL) и прелимбической коры (PL). В качестве ориентира использовался уровень, удаленный в переднезаднем направлении от брегмы на 3 мм (рис. 1). Для морфометрического анализа изображения использовалась программа ImageJ 1.50i (National Institutes of Health, USA). После преобразования (Treshold) 8-битовых изображений в маски производился автоматический подсчет частиц (Analyze Particles). Учитывались частицы размером более 4 пикселей (соответствовавших 8,9 мкм2 на реальном препарате). Автоматический анализ дополнялся ручным методом. Исследователь, производивший подсчет, не имел информации о принадлежности крысы к той или иной группе.
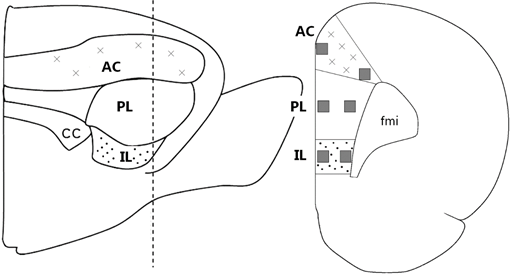
Рис. 1. Анализируемые области медиальной префронтальной коры (обозначены серыми прямоугольниками); СС - corpus callosum, fmi - forceps minor corporis callosi (из [6] и [7] с изменениями)
Статистическая обработка полученных данных проводилась с помощью пакета программ STATISTICA (StatSoft, USA). Гипотеза о виде распределения проверялась посредством критерия Шапиро-Уилка. Поскольку закон распределения полученных значений отличался от нормального, данные представлялись в виде медианы (Me), верхнего (75%) и нижнего (25%) квартилей (Q1-Q3), а для выполнения задачи сравнения двух независимых групп использовался непараметрический U-критерий Манна-Уитни. Критический уровень значимости нулевой статистической гипотезы в соответствии с принятыми в медико-биологических исследованиях критериями принимался равным 0,05.
Результаты исследования и их обсуждение
Как следует из таблицы, количество Fos-позитивных клеток во всех исследуемых регионах префронтальной коры животных группы сравнения превышало таковое в основной группе, что отражает способность ТЭС-терапии предупреждать и уменьшать стресс-индуцированную гиперактивацию исследуемых структур.
Количество иммунореактивных клеток в исследуемых областях префронтальной коры

По сравнению с основной группой: * - p=0,002 , ** - p=0,0008, *** - p=0,0005, # - p=0,001, ## - p=0,004, ### - p=0,0003.
На рисунке 2 представлены примеры изображений поверхностных и глубоких слоев AC, PL и IL.
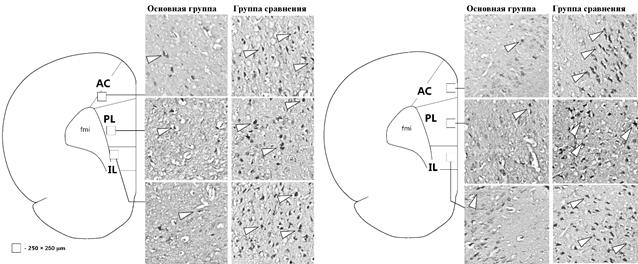
Рис. 2. Примеры изображений поверхностных (справа) и глубоких (слева) слоев АС, PL и IL. Белыми треугольниками обозначены примеры Fos-позитивных клеток, fmi - forceps minor corporis callosi
Медиальная префронтальная кора является важнейшим координатором стрессовых реакций [7]. Анатомически мПФК крысы подразделяется на три региона, отличных по цитоархитектонике, связям с другими центрами и функциям: переднюю цингулярную (AC), прелимбическую (PL) и инфралибическую (IL) кору, которые гомологичны полям Бродмана 24b, 32 и 25 соответственно. Большинство клеток мПФК (80–90%) – глутаматергические пирамидальные нейроны, которые связаны с важнейшими стресс-реализующими системами: автономной нервной системой (АНС) и гипоталамо-гипофизарно надпочечниковой осью (ГГН). Передняя цингулярная кора вовлечена в регуляцию процессов пространственной ориентировки, движения и восприятия боли. Прелимбическая кора имеет связи с гипоталамическими структурами, ядрами шва, полосатым телом, опорным ядром терминального тяжа и участвует в когнитивном процессинге информации о стрессовых стимулах, системе вознаграждений и пр. Прелимбическая кора, подобно гиппокампу, оказывает преимущественно ингибирующее действие на активацию ГГН оси и симпатической нервной системы при психоэмоциональном стрессе и действует в большей степени на длительность, чем на интенсивность продукции глюкокортикоидов. Билатеральное повреждение данного региона, равно как и передней цингулярной коры, сопряжено с гиперактивацией ПВЯ при иммобилизации, но не при ингаляции эфира (физический стресс). Инфралимбическая кора связана с вентролатеральными регионами продолговатого мозга, ядром одиночного пути, центральным амигдалярным ядром и оказывает стимулирующее действие на стресс-реализующие системы.
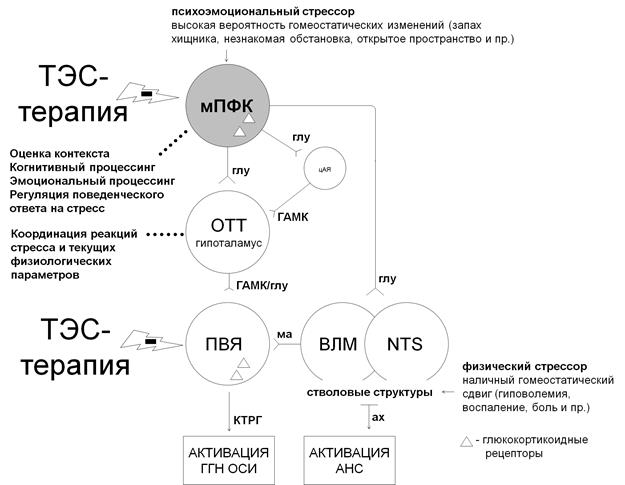
Рис. 3. Место медиальной префронтальной коры в реализации реакций стресса.
Ах – ацетилхолин, ВЛМ – вентролатеральные отделы продолговатого мозга,
ГАМК - гаммааминомасляная кислота, глу – глутамат, КТРГ – кортикотропный рилизинг-гормон, ма – моноамины, мПФК – медиальная префронтальная кора, ОТТ – опорное ядро терминального тяжа, ПВЯ – паравентрикулярное ядро гипоталамуса, цАЯ – центральное амигдалярное ядро, NTS – nucleus tracti solitarii
Медиальная префронтальная кора связана с ГГН осью не напрямую, а через ряд структур, например прелимбическая кора - через опорное ядро терминального тяжа, нейроны которого, в свою очередь, посылают ГАМК-ергические проекции кортиколиберин-продуцирующим клеткам паравентрикулярного ядра гипоталамуса. Структура, связывающая инфралимбическую кору и ГГН ось, не известна; существуют доказательства, что данную роль могут исполнять опорное ядро терминального тяжа, задний гипоталамус и ядро одиночного пути [7]. Клетки префронтальной коры имеют многочисленные глюкокортикоидные и минералокортикоидные рецепторы и принимают участие в ограничении реакций стресса по принципу отрицательной обратной связи. Имплантация ГК в префронтальную кору угнетает активность ГГН оси (данный эффект также имеет место только при психоэмоциональном стрессе). Медиальная префронтальная кора (вместе с гиппокампом и миндалевидным телом) является важнейшим координирующим центром в иерархии обработки информации о психогенных стрессорах, принятия решений и регуляции поведенческого ответа на стресс и составляет часть так называемого социального мозга (рис. 3). Нарушения работы мПФК лежат в основе многих форм стресс-ассоциированных расстройств, включая большое депрессивное расстройство (БДД) и посттравматическое стрессовое расстройство (ПТСР). Известно, что нейроны 25 поля Бродмана метаболически гиперактивны при БДД, а глубокая стимуляция данного региона связана с уменьшением выраженности симптомов у пациентов с депрессией, стимуляция же гомологичных участков префронтальной коры крыс благоприятно сказывается на показателях в тесте вынужденного плавания.
Заключение
Результаты настоящего исследования указывают на то, что ТЭС-терапия предупреждает и уменьшает гиперактивацию передней цингулярной, прелимбической и инфралимбической коры при комбинированном стрессе. Это соотносится с данными предшествующих работ и закладывает теоретический фундамент клинического изучения эффективности ТЭС-терапии при БДД и ПТСР.
Библиографическая ссылка
Каде А.Х., Поляков П.П., Липатова А.С., Сотниченко А.С., Куевда Е.В., Губарева Е.А. ХАРАКТЕР ЭКСПРЕССИИ C-FOS НЕЙРОНАМИ МЕДИАЛЬНОЙ ПРЕФРОНТАЛЬНОЙ КОРЫ В УСЛОВИЯХ КОМБИНИРОВАННОГО СТРЕССА И ВЛИЯНИЯ ТЭС-ТЕРАПИИ // Современные проблемы науки и образования. – 2017. – № 5. ;URL: https://science-education.ru/ru/article/view?id=26877 (дата обращения: 18.04.2024).



