Ишемический инсульт головного мозга (ИИ) – многофакторное заболевание, основным патогенетическим фактором которого является атеросклероз магистральных сосудов и сосудов головного мозга.
Существует много методов диагностики и профилактики атеросклероза. В качестве диагностики применяют: допплерографическое сканирование сосудов, магнитно-резонансную томографию, компьютерная томография и т. д. Для профилактики рекомендуют избегать воздействия факторов риска атерообразования, применять статины, а в роли категорического решения – реконструктивные сосудистые операции. Также существуют и прогностические методики, определяющие вероятность возникновения инсульта в группах риска. Одна из них была разработана авторами статьи [1]. В данной работе приведены материалы, полученные в рамках выполнения диссертационной работы И.А. Кадыровой [2].
На наш взгляд, группой, сочетающей в себе многие факторы риска, являются пациенты с метаболическим синдромом (МС). Им присущи следующие характеристики: повышенное артериальное давление, инсуллинорезистентность и/или повышенный уровень глюкозы крови, абдоминальное ожирение, дислипидемии. Зачастую у таких пациентов повышен уровень мочевой кислоты, С-реактивного белка, изменен гормональный профиль. Все эти факторы запускают и поддерживают формирование атеросклероза.
Согласно изданиям «Diabetes Care» и «Stroke» у пациентов с метаболическим синдромом обнаружено бессимптомное ишемическое повреждение головного мозга [3,4]. Это показано при помощи магнито-резонансной томографии. В последнее время широко используют нейроспецифические маркеры: нейрон-специфическую енолазу (NSE), глиальный фибриллярный кислый протеин (GFAP), матриксную металлопротеиназу-9 (ММP-9) для определения повреждения нейрональной и глиальной ткани головного мозга [5, 6]. Но сведений о применении этих маркеров у пациентов с МС до манифестации острого нарушения мозгового кровообращения найдено не было.
Целью нашего исследования явилось определение у пациентов с МС маркеров повреждения головного мозга: NSE, GFAP, ММP-9, чтобы описать их концентрацию и прогностическую ценность в развитии острого нарушения мозгового кровообращения.
Научной новизной нашего исследования явилось определение концентраций NSE, GFAP, ММP-9 в сыворотке крови у пациентов с МС. Данное исследование призвано изучить состояние головного мозга у пациентов с МС с точки зрения концентраций нейроспецифических белков и рассмотреть изменение концентраций как прогностический критерий острого нарушения мозгового кровообращения по ишемическому типу [2].
Материалы и методы исследования. В исследование было включено 157 участников в возрасте от 50 до 80 лет с равным включением мужчин и женщин.
Первую группу (контрольную) составили 38 практически здоровых людей. Критериями включения в контрольную группу явились: возраст от 50–80 лет, индекс массы тела (ИМТ) в пределах 18,5–25,0, нормальное артериальное давление, показатели биохимического анализа крови, соответствующие норме [2]. Вторую группу представили пациенты с МС в количестве 39 человек. Диагностирование метаболического синдрома проводилось по критериям International Diabet Federation (IDF 2005). В третью группу вошли 44 пациента с ИИ в возрасте от 50–80 лет, обоих полов. Четвертую группу составили 36 пациентов с ИИ и МС.
Пациенты, испытавшие ишемический инсульт, наблюдались в первые 12–72 часа после манифестации события. Забор крови для определения NSE производился в первые 12 часов, для определения GFAP и ММР-9 – в первые 24–72 часа, согласно рекомендациям к наборам реагентов.
Исследование включало в себя: анкетирование, измерение антропометрических данных, окружности талии, лабораторное обследование и клинико-инструментальное обследование. В анкете были представлены вопросы на выявление факторов риска. Для исследования использовалась следующая информация: пол, возраст, этническая принадлежность, данные о возможной симптоматике нарушения мозгового кровообращения, результаты антропометрических, лабораторных и клинико-инструментальных исследований, необходимых для определения метаболического синдрома и маркеров NSE, GFAP и ММР-9.
Биохимические исследования показателей липидного спектра крови включали определение общего холестерина, триглицеридов (ТГ), холестерина липопротеидов высокой и низкой плотности (хЛПВП и хЛПНП) стандартными методами на биохимическом анализаторе. Результаты оценивали в ммоль/л. Определение глюкозы крови проводилось путем забора капиллярной крови из пальца после 12-часового голодания. Результаты оценивались в ммоль/л. Концентрацию фибриногена оценивали в г/л. Забор проб крови на лабораторные анализы проводился у всех больных из локтевой вены натощак в стандартных условиях. Биохимические исследования крови проводились в лаборатории Центра Первичной Медико-Санитарной Помощи № 2 с обязательным внешним и внутренним контролем. Анализ крови проводился на биохимическом анализаторе BioSystemA-15 с использованием реагентов фирмы Vital [2].
Определение маркеров NSE, GFAP и ММР-9 проводилось в Лаборатории Коллективного Пользования (ЛКП) Карагандинского государственного медицинского университета. Кровь собиралась вакуумными системами Vacutainer с гелем для отделения сыворотки. После забора кровь в первый час центрифугировалась и транспортировалась в ЛКП для дальнейшего исследования. Лизированные образцы исключались из исследования. Для определения маркеров использовались следующие наборы реагентов: NSE ELISA (Fujirebio), Human GFAP ELISA (BioVendor), Human MMP-9 ELISA (Bender MedSystems). Иммуноферментный анализ проводился на роботе Tecan Evolizer 100. Результаты оценивались: для NSE в мкг/л, для GFAPи ММР-9 в нг/мл.
Диагностирование метаболического синдрома осуществлялось по критериям IDF (2005): абдоминальное ожирение (окружность талии у мужчин > 94 см, у женщин > 80 см) и любые два из нижеперечисленных признаков: 1) ТГ≥ 1,7 ммоль/л; 2) хЛПВП у мужчин < 1,03 ммоль/л, у женщин < 1,29 ммоль/л или гиполипидемическая терапия; 3) систолическое артериальное давление (САД) ≥ 130 или диастолическое артериальное давление (ДАД) ≥ 85 мм рт. ст. или антигипертензивная терапия; 4) гликемия натощак ≥ 5,6 ммоль/л [7].
Цветное допплерографическое картирование брахиоцефального ствола проводилось сканером Medison sonoace X8 (линейный датчик 5–12 мГц).
Статистическая обработка осуществлялась при помощи программы IBMSPSS 20. В качестве методов анализа использовались: дисперсионный анализ Краскелла – Уоллиса, определение критерия t-Стьюдента и U-критерия Манна – Уитни.
Результаты и обсуждение. Следующим этапом работы явилась статистическая обработка полученных данных с определением коэффициентов корреляции [2]. Так как выборка разделена на 4 группы, и распределение изучаемых признаков NSE, GFAP и ММР-9 не во всех группах является нормальным, то для сравнения этих групп без инфляции ошибки второго рода использовался непараметрический H-test с определением критерия Краскелла –Уоллиса [8]. Результаты анализа приведены в таблице 1.
Таблица 1
Результаты сравнения маркеров NSE, GFAP и ММР-9 в четырех группах
|
Изучаемый маркер |
Критерий Краскелла – Уоллиса |
|
Степень свободы |
р |
|
NSE |
88,498 |
83,861 |
3 |
<0,001 |
|
GFAP |
81,962 |
82,687 |
3 |
<0,001 |
|
ММР-9 |
58,843 |
59,987 |
3 |
<0,001 |
На рисунке 1 представлена диаграмма размаха NSE в четырех группах.
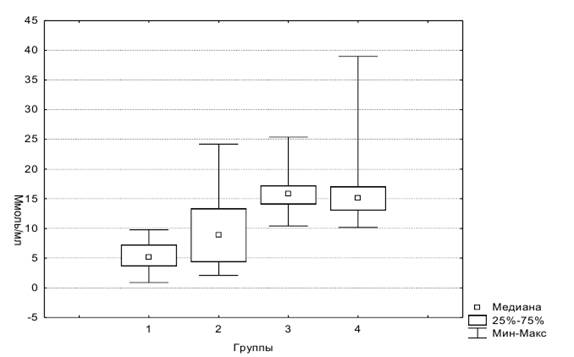
Рис. 1. Диаграмма размаха NSE в четырех группах
Также на рисунке 2 представлена диаграмма размаха GFAP в исследуемых группах.
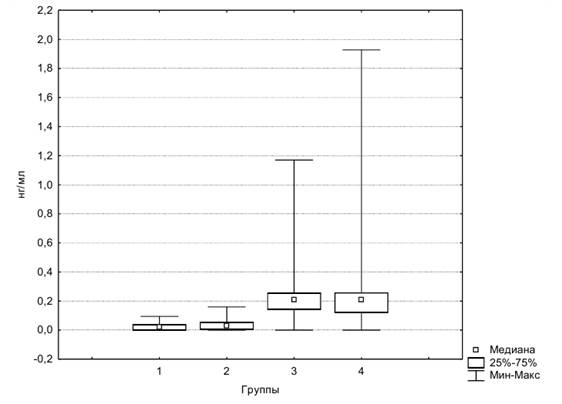
Рис. 2. Диаграмма размаха GFAP в четырех группах
Для маркера ММP-9 диаграмма размаха представлена на рисунке 3.
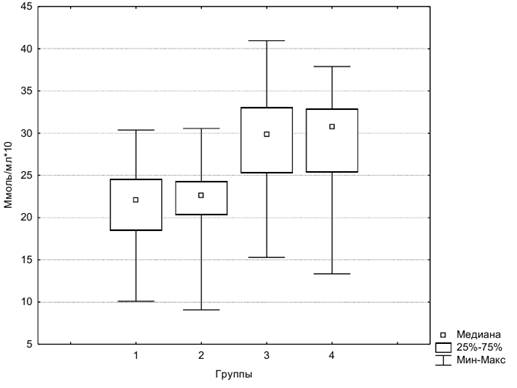
Рис. 3. Диаграмма размаха ММP-9 в четырех группах
По результатам проведенного Н-теста сделан вывод о различии показателей в 4-х группах. Наибольший интерес представляет сравнение 1–2, 2–3, 3–4 групп. Это было необходимо для оценки влияния МС на концентрацию маркеров. Н-тест, так же как и дисперсионный анализ, не показывает, между какими именно группами присутствуют различия, поэтому проведено сравнение с помощью t-критерия Стьюдента и критерия Манна – Уитни (в соответствии с законом распределения величины в группе) [9]. Результаты проведенных тестов приведены в таблице 2.
Таблица 2
Значения t-критерия Стьюдента* и U-критерия Манна – Уитни** для 1, 2, 3 и 4 групп в соответствии с распределением признака в группах
|
Признак |
1 и 2 группы |
2 и 3 группы |
3 и 4 группы |
|
НСЕ |
469,5, р=0,005** |
-6,718, р<0,01* |
761,5,р=0,76** |
|
GFAP |
590,0, р=0,13** |
106,5, р<0,01** |
787,5,р=0,96** |
|
ММР-9 |
-0,501, р=0,518* |
236,0, р<0,01** |
657,5,р=0,19** |
Из данных Таблицы 2 следует: 1) в 1 и 2 группах есть статистически значимые различия концентраций NSE, в то время как различия концентраций GFAP и ММР-9 не значимы; 2) между 2 и 3 группами статистически значимы различия концентраций GFAP и ММР-9, в то время как концентрации NSE не имеют статистически значимых различий, т.е. у пациентов с МС уровень NSE выше, чем у здоровых людей, и соответствует уровню NSE у пациентов с инсультом; 3) значимых различий концентраций маркеров между 3 и 4 группами нет.
Маркеры GFAP и ММР-9 не показали различий у пациентов с МС и участников контрольной группы. Различия были значимы между парами групп, где произошел инсульт (3 и 4 группы) и где не было острого нарушения мозгового кровообращения (1 и 2 группы).
Полученные нами результаты у пациентов с МС имеют следующее объяснение. Компоненты МС (артериальная гипертензия, дислипидемия, абдоминальное ожирение инсулинорезистентность) приводят к хроническому провоспалительному статусу и постоянной циркуляции цитокинов, в том числе и фактора некроза опухоли (TNFα). Это приводит к эндотелиальной дисфункции и патологической проницаемости гемато-энцефалического барьера (ГЭБ). Артериальная гипертензия и дислипидемия поражают артерии малого калибра головного мозга, что ведет к нарушению метаболических процессов в ближайших астроцитах и нейронах. Атеросклеротическое изменение сосудов приводит к хронической гипоксии. Помимо этого, плазма с большими количествами цитокинов просачивается через поврежденный ГЭБ, основную роль среди которых играет TNFα. TNFα индуцирует повышенный выброс глутамата, что приводит к эксайтотоксичности и нарушению кальциевого тока в нейронах. Помимо этого, запущенные гипоксией процессы перекисного окисления липидов, митохондриальные дисфункции, нарушение энергетического метаболизма запускают нейрональный апоптоз. Это приводит к разрушению нейрона и выходу NSE в кровоток [2]. При острых ишемических поражениях головного мозга развивается некроз клеток, но при «мягкой» ишемии клетки погибают за счет апоптоза [2]. При этом количество клеток в состоянии апоптоза максимально увеличивается через 24–48 часов после ишемии, и процессы апоптоза поддерживаются еще около 4 недель [2]. Этим объясняется примерно «постоянная» концентрация NSE у пациентов с МС.
В ответ на ишемию астроциты отвечают синтезом hypoxiafactor 1, что повышает их резистентность к ишемии и предотвращает апоптоз и выход GFAP в кровоток. Однако у пациентов с МС присутствует глиоз головного мозга в ответ на дислипидемию и высокую концентрацию холестерина. Глиоз и постоянное рективное состояние глии в ответ на дислипидемию ведут к истощению астроцитов. Поэтому они не запускают воспалительный каскад и не повышают концентрацию ММР-9. Также высокие концентрации TNF α подавляют запуск ММР-9. Активные воспалительные реакции могут отсутствовать ввиду отсутствия очага некроза, а диффузный апоптоз таковых не вызывает [2].
Заключение. Из результатов нашего исследования следует вывод о бессимптомном ишемическом повреждении церебральных нейронов и нарушении целостности ГЭБ у пациентов с МС [2]. Значительный выход NSE через поврежденные плазматические мембраны клеток мозга свидетельствует об интенсивности нейрональной деструкции. Отсутствие повышения уровня GFAP у участников 2 группы мы связываем с угнетающим действием хронической ишемии и нарушением липидного обмена на астроцитарные клетки и отсутствием некротического очага. Значимые различия ММР-9 у пациентов с МС и пациентами с инсультом объясняются отсутствием острого процесса во 2 группе.
Нейроспецифические маркеры у пациентов с МС до манифестации острого нарушения мозгового кровообращения определялись впервые. Чтобы сопоставить полученные результаты с данными литературы, необходимо продолжить исследования, используя методы нейровизуализации и определение нейроспецифических маркеров.
Библиографическая ссылка
Кадырова И.А. НЕЙРОСПЕЦИФИЧЕСКИЕ СЫВОРОТОЧНЫЕ МАРКЕРЫ GFAP, MMP-9, NSE У ПАЦИЕНТОВ С МЕТАБОЛИЧЕСКИМ СИНДРОМОМ // Современные проблемы науки и образования. – 2017. – № 5. ;URL: https://science-education.ru/ru/article/view?id=26787 (дата обращения: 19.04.2024).