В текущем столетии бактериально-химическое выщелачивание металлов из сульфидных руд с помощью микроорганизмов обрело широкую значимость и развитие, стало экономически выгодным и экологически безопасным [1–3]. Благоприятной является внутрироссийская и экспортная конъюнктура на медь, кобальт и никель. В Российской Федерации Камчатская никеленосная провинция – третья по значимости [4]. В нее входят три рудных района: Шанучский, Дукукский и Колпаковский. В настоящий момент осуществляется разработка только Шанучского рудного района на медно-никелевом месторождении. Перспективным для последующей разработки является и Квинум-Кувалорогский рудный район [3]. Применение инновационных, малоотходных биогеотехнологических подходов показывает наиболее рациональный путь развития камчатской горноперерабатывающей промышленности.
Использование новых бактериально-химических способов извлечения ценных компонентов из сульфидных руд позволит гарантировать комплексность извлечения металлов и не потребует образования сложных горноперерабатывающих комплексов. Возможно целиком автоматизировать надлежащие технологические процессы, увеличить производительность работы и культуру производства, разрешить многочисленные трудности, связанные с охраной окружающей среды. Микробное выщелачивание является экономным методом для восстановления металлов из низкосортных минеральных руд [5].
В бактериально-химических технологиях выщелачивания ценных компонентов из медно-никелевых и золото-оловянных руд применяются автохтонные ацидофильные железо- и сероокисляющие бактерии. Уже после их отделения в элективную питательную среду следует осуществлять их разделение по наибольшей окисляющей возможности [5]. Здесь остро встаёт проблема идентификации ацидофильных хемолитотрофных микроорганизмов и исследования структуры бактериальной ассоциации, которую можно охарактеризовать как важный экологический нюанс использования ее в биотехнологиях извлечения металлов с помощью хемолитотрофов.
По нашему мнению, подход с использованием генодиагностики – единственный способ качественной и количественной оценки структуры сообществ микроорганизмов, участвующих в ходе биовыщелачивания. Такого рода исследования дают возможность увеличить представления о видовом составе сообществ, а также формируют посыл к цели решения проблемы формирования сообществ, обладающих наибольшей отдачей к способности окислять металлы, и подобным способом позволят рассмотреть ход промышленной технологии выщелачивания на принципиально новейшем уровне [6]. Существенное число современных анализов отдано исследованию проблемы генодиагностики микроорганизмов, входящих в структуру сообществ. В идентификации микробных культур в настоящее время в различных странах обширно применяются молекулярно-биологические подходы: 16sДНК-рестрикция ферментов, исследование спейсеров областей их рибосомальных оперонов, анализ филогении, DGGE (гель-электрофорез в градиенте денатурирующих агентов), t-RFLP (полиморфизм длин рестрикционных фрагментов), метод одноцепочечного конформационного полиморфизма, иммуноферментное исследование, флуоресцентная гибридизация in situ и другие [1; 5; 6].
Но стоимость данных технологий не дает возможность применять их при рутинном лабораторном исследовании. В мире появляется все больше видов использования технологии полимеразной цепной реакции в реальном времени [7]. Это говорит о том, что ПЦР в реальном времени имеет ряд положительных сторон в сопоставлении с иными методами. Качественная ПЦР – метод, способный реализовывать численное исследование нуклеиновых кислот (в отличие, к примеру, от RFLP и DGGE). Помимо этого, он простой в использовании, обладает большой специфичностью и воспроизводимостью и не потребует привлечения существенных материальных ресурсов [6]. Мы рекомендуем при идентификации бактерий в биовыщелачивающем растворе и инокуляте, при прогнозе динамики бактерий в ходе выщелачивания, применять способ полимеразной цепной реакции в реальном времени.
Поэтому целью нашей работы мы ставим разработку предпосылок к качественной и количественной идентификации микроорганизмов, предположительно входящих в состав аборигенных сообществ, населяющих сульфидную медно-никелевую руду месторождения Шануч. Общая схема исследования приведена на рисунке.
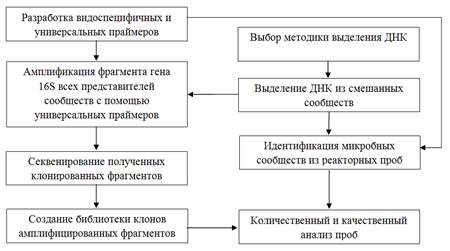
Общая схема исследования
Материал и методы
В работе использовались один из штаммов чистых линий культур Acidithiobacillus thiooxidans, Acidithiobacillus ferrooxidans, Sulfobacillus thermosulfidooxidans и Ferroplasma acidiphillum и 40 проб смешанных автохтонных сообществ хемолитотрофов, выделенных из сульфидной руды месторождения Шануч. Выделение микроорганизмов выполняли классическим методом, выращивали на среде Сильвермана-Люндгрена «9K» без железа и на той же среде с железом (с железоокисляющими) [5] в лабораторных реакторах. Очистка ДНК проведена по модифицированной методике [8]. Все исследования проводились в двух повторностях.
Полимеразная цепная реакция в реальном времени (qPCR с использованием красителя SybrGreen I) проводилась на приборе ДТ 96/4 производства ЗАО «НПФ ДНК-Технология» (Россия). При количественной оценке структуры сообществ нами были использованы разработанные ранее ПЦР-тест-системы [9]. Секвенирование проводили на базе Центра коллективного пользования «Геном» Института молекулярной биологии им. В.А. Энгельгардта Российской академии наук. Синтез олигонуклеотидов проводился на базе ООО «ДНК-Синтез», г. Москва. Последовательности гена 16S рРНК для каждого из исследованных микроорганизмов были получены из базы данных GenBank NCBI США и выровнены программой Seqman (DnaStar). Вариабельные участки были использованы при дизайне видоспецифичных праймеров, одинаковые участки использовались при разработке универсальных праймеров с помощью программы Oligo 6.0. Статистическую обработку проводили с помощью программного обеспечения Analytic Rarefaction [10].
Так как имеются сведения о небольших генетических различиях в границах исследуемого региона у представителей одних и тех же видов, живущих в разных биоценозах, нами был проведен контроль генетической гетерогенности чистых линий культур. Это стало возможным благодаря разработке видоспецифичных праймеров на определенный тип отсеквенированной последовательности нуклеотидов исследуемых микроорганизмов. При постановке полимеразной цепной реакции в реальном времени нами использовались праймеры, которые позволяют амплифицировать ген 16S рРНК большинства известных микроорганизмов. Для анализа библиотеки клонов нами были отобраны 100 колоний, содержащих вставку ПЦР-продукта, полученного с универсальных праймеров. ПЦР-продукт очищался на колонках Quiagen и был клонирован в клетки E. coli с использованием наборов «pGEM-T Vector Systems» (Promega). Затем были отобраны 16 колоний из расчета по 4 колонии на каждый тип образца культур. С ДНК колоний бактерий, содержащих вставку, было проведено определение нуклеотидной последовательности с помощью генетического анализатора ABI PRISM 3000.
Результаты и обсуждение
В результате секвенирования нами были получены нуклеотидные последовательности для культур A. thiooxidans, A. ferrooxidans, S. thermosulfidooxidans и F. acidiphilum. При сравнении с последовательностями, содержащимися в базе данных GenBank Национального центра биотехнологической информации США, было выявлено 97%-ное совпадение последовательностей, полученных нами в результате секвенирования, и последовательностей, описанных ранее как референсных для исследуемых видов. Это позволило использовать наши данные при разработке праймеров. Выравнивание полученных последовательностей позволило выявить вариабельные участки в геномах бактерий и использовать их впоследствии при написании видоспецифичных олигонуклеотидов.
Эффективность полимеразной цепной реакции была проверена методом построения стандартной кривой. Для этого использованы серии десятикратных разведений препаратов ДНК, полученных из чистых культур A. thiooxidans, A. ferrooxidans, S. thermosulfidooxidans и F. acidiphilum в качестве образцов. Четыре разведения каждого из образцов были протестированы в трех повторностях. Десятичные логарифмы относительных значений концентрации были нанесены на график против значений Ct (точка пересечения кривой накопления продукта ПЦР с произвольно установленным пороговым уровнем, превышающим уровень шумов). В данном случае эффективность ПЦР зависит только от угла наклона кривой, поэтому абсолютные значения концентрации ДНК не требуются [6]. Расчеты эффективности ПЦР с использованием программного обеспечения ДТ-96 показали, что эффективность составила ≥ 93%.
Разработанные нами тест-системы позволяют выявлять остатки ДНК вышеперечисленных бактерий. В том числе показана применимость разработанных тест-систем для количественного и качественного анализа смешанных сообществ. На сегодняшний день нами ведется разработка методики, позволяющей оценивать абсолютное количество исходной ДНК. Для подсчета отдельных типов 16S рДНК создается панель стандартных образцов с известной концентрацией ДНК. Эти образцы впоследствии будут использованы для построения стандартных кривых, подсчета копий геном-эквивалентов и оценки исходного количества клеток. Кроме того, нами разрабатывается протокол верификации полученных данных, который позволит оценить чувствительность и специфичность разработанных тест-систем.
При сопоставлении с методами классической диагностики микроорганизмов генодиагностика с применением амплификационных технологий различается бóльшей чувствительностью и дает возможность использовать образцы проб без активных клеток микроорганизмов, с помощью только одной единицы или фрагмента выделенной ДНК. Итоги генотипирования характеризуются наилучшей однозначностью по сравнению с морфологическими, биохимическими либо иммуногенетическими способами идентификации бактерий и дают, кроме того, непосредственные данные с целью выяснения и уточнения эволюционных взаимосвязей разных изолятов микроорганизмов.
В большинстве последних российских работ по процессам бактериально-химического выщелачивания не указывается качественная и численная структура культуральной ассоциации выщелачивающего раствора. Применяют автохтонную микрофлору, оказавшуюся в начальной пульпе, подразумевая, что автохтонная флора приспосабливается к обстоятельствам выщелачивающего раствора. На протяжении продолжительного периода считалось, что перколяция сульфидов проходит благодаря только лишь тионовым микроорганизмам A. ferrooxidans. Применение в качестве источника энергии обширной области окисляющих субстратов (сульфидов, серы и др.), стабильность микроорганизмов к ионам тяжелых металлов и невысоким значениям рН, а кроме того, широкий уровень изменчивости в сверхэкстремальных обстоятельствах среды показали основную роль A. ferrooxidans в биогеотехнологиях вскрытия золота либо выщелачивания других цветных металлов [2; 5]. Способы интенсификации биовыщелачивания таким образом ориентированы на получение высокоактивных штаммов A. ferrooxidans и оптимизацию среды их жизнедеятельности [11].
В Российской Федерации и за границей уже применяются запатентованные технологические процессы использования гибридных микробных культур. Например, в ЮАР на руднике Fairview используют смешанную ассоциацию состава A. ferrooxidans, A. thiooxidans и Leptospirillum ferrooxidans [12]; в Австралии на заводе Beaconsfield ассоциацию из A. caldus и L. ferrooxidans; в России на Олимпиадинском месторождении – ассоциацию из Sulfobacillus olimpiadicus, F. acidiphilum и L. ferrooxidans [5]; в Уганде на руднике Kilembe – ассоциацию из L. ferrooxidans, A. ferrooxidans, A. caldus и S. thermosulfidooxidans [13]; в Финляндии на руднике Sotkamo – ассоциацию из A. ferrooxidans, A. thiooxidans (или A. albertensis), A. caldus и L. ferrooxidans [5] и прочее. Заметно, что список применяемых бактерий достаточно ограничен и специфичен. Исследование практики использования бактерий в технологии обработки сульфидных руд выявил, что применение ассоциации бактерий, состоящих из штаммов умеренно термофильных и мезофильных бактерий, может считаться перспективным направлением интенсификации хода биологического выщелачивания. Итоги нашего исследования дают возможность предложить применение ассоциации микроорганизмов, включающих A. ferrooxidans, A. thiooxidans и F. acidiphilum, на Шанучском рудно-обогатительном заводе.
Определено, что главным представителем сообщества бактерий камчатского месторождения Шануч является A. ferrooxidans, а кроме того, разнообразные его штаммы, в отличие, к примеру, от бактерий родов Leptospirillum и Sulfobacillus, обширно используемых в биовыщелачивании на иных месторождениях. Но допустимо вовлечение в культуру сообществ, осуществляющих выщелачивание, иных микроорганизмов, прежде найденных в рудном теле месторождения: A. caldus, A. ferrivorans, L. ferrooxidans, L. thermoferrooxidans, L. ferriphillum, Alicyclobacillus disulfidooxidans, S. acidophilus, F. cupricumulans [3; 5]. Это допустимо для изменения состава ассоциации микроорганизмов с целью получения культуры, владеющей наиболее значительной окисляющей возможностью, нежели в настоящее время. Помимо этого, нами идентифицированы ключевые представители микробной ассоциации, участвующей в бактериальном выщелачивании, и проанализированы культуры, выделенные из медно-никелевых руд Шанучского месторождения и из реакторов разными способами: классической ПЦР, количественной ПЦР, гель-электрофорезом и другими (обработано 40 проб смешанных культур микроорганизмов и 4 чистые линии, проведено приблизительно 370 количественных и 60 качественных ПЦР, 200 сиквенс-реакций).
Согласно сведениям микроскопического анализа, проделанного с поддержкой ПЦР, нами определено, что на среде Сильвермана-Люндгрена (9К) доминирует A. ferrooxidans, на среде без железа – A. ferrooxidans и различные виды Sulfobacillus [3]. В микробных ассоциациях сульфидной руды и выращенных на среде Ваксмана тоже доминирует A. ferrooxidans. Возможно, штаммовый полиморфизм A. ferrooxidans весьма обширен, и дальнейшая наша деятельность продолжится непосредственно в исследовании штаммов A. ferrooxidans – активного агента биовыщелачивающих сообществ. Помимо этого, в составе смешанных микробных ассоциаций наличествуют археи, которые при температурах выше 60 °С обеспечивают более интенсивную скорость окисления сульфидных руд.
Заключение
Можно сделать вывод, что установленные с помощью молекулярно-биологических подходов результаты исследования доказывают и расширяют данные микробиологических анализов, а кроме того, могут служить базой для формирования сообществ бактерий, имеющих наибольшую окисляющую деятельность, и в последующем для разработки новейших действенных методов биовыщелачивания. Приобретенные в работе сведения о структуре сообществ представляются нам новым знанием в области экологии бактерий, а использованные в процессе исследования способы могут быть многоцелевым инструментом в сфере практической биогеотехнологии.
Библиографическая ссылка
Рогатых С.В., Мурадов С.В., Лепшин С.Л. МОЛЕКУЛЯРНО-БИОЛОГИЧЕСКИЕ ПОДХОДЫ К ИДЕНТИФИКАЦИИ ХЕМОЛИТОТРОФНЫХ МИКРООРГАНИЗМОВ МЕДНО-НИКЕЛЕВЫХ МЕСТОРОЖДЕНИЙ // Современные проблемы науки и образования. – 2017. – № 5. ;URL: https://science-education.ru/ru/article/view?id=26786 (дата обращения: 25.04.2024).



