Агрегометрия открыла новую эпоху в диагностике нарушения деятельности тромбоцитов. Преимуществом метода является то, что живые тромбоциты исследуются в условиях, приближающихся к физиологическим: при постоянной температуре, при постоянной скорости смешивания. Агрегация тромбоцитов ведет к образованию агрегатов с расстоянием между клетками в долях микрона. Интенсивность агрегации определяется многими индукторами [7], а также патологическими сдвигами. Наиболее изучены следующие индукторы агрегации: кальций, АДФ, адреналин, коллаген, серотонин, тромбин, арахидонат, фибриноген, фибронектин, тромбоспондин, фактор Виллебранда [4]. Исследования по оценке состояния тромбоцитарной функции у больных с нарушениями функции щитовидной железы являются противоречивыми, поэтому мы определили цель нашего исследования.
Цель исследования – установить особенности изменения агрегационной активности тромбоцитов у пациентов с многоузловым зобом с использованием разных индукторов агрегации. В исследование было включено 40 пациентов, находящихся на диспансерном наблюдении.
Материалы и методы исследования. Все больные имели нарушение функции щитовидной железы – многоузловой зоб, как результат приспособления к длительной йодной недостаточности или продолжительного приема антитиреоидных соединений. Диагноз устанавливался на основании жалоб, данных анамнеза заболевания, функциональных и клинико-лабораторных исследований [3, 6]. Агрегационные функции тромбоцитов спонтанную и индуцированную агрегацию изучали с помощью лазерного агрегометра “Биола”. В качестве индукторов агрегации использовали растворы фирмы-производителя «Технология – стандарт» (Россия), приготовленные согласно фирменной инструкции: АДФ в концентрациях 2,5 мкг/мл, 1,25 мкг/мл и коллаген 20 мг/мл (лиофильно высушенная фракция из богатой коллагеном ткани человека). Обогащенную тромбоцитами плазму для исследования получали центрифугированием 2000 g в течение 15 минут, бедную тромбоцитами плазму получали центрифугированием 4000 g в течение 20 минут. Агрегацию оценивали по динамике изменения светопропускания плазмы – классический метод, предложенный ранее, и по динамике изменения размеров образующихся агрегатов. Расшифровывая агрегатограммы, устанавливали: значение спонтанной агрегации, значения максимальной агрегации /МА/, максимальную скорость агрегации (максимальный тангенс угла наклона кривой агрегатограммы к оси абсцисс /tg α/). Максимальный размер тромбоцитарных агрегатов /МРА/ оценивали по результатам их динамического измерения (на агрегометре) [3, 9]. Цифровые результаты исследований обрабатывали методом вариационной статистики для малых рядов наблюдений с вычислением средней арифметической (М), ошибки средней арифметической (m). Для определения достоверности отличий вычисляли доверительный коэффициент Стьюдента (t) и величину вероятности (р). Различия оценивали как достоверные при значениях степени вероятности (р<0,05).
Результаты исследования и их обсуждение. Данные, характеризующие агрегацию тромбоцитов у больных, представлены в таблица.
Агрегационная активность тромбоцитов у пациентов многоузловым зобом при использовании разных индукторов агрегации
|
Показатели |
Коллаген |
АДФ 1,25 |
АДФ 2,5 |
СА |
|
1.Агрегационная активность тромбоцитов % |
33,35±10,57* |
22,37±9,17 |
19,15±8,04 |
11,50±2,86 |
|
2.Скорость достижения максимальной величины тромбоцитов tga, с MPAi |
1,08±0,22* |
1,14±0,34* |
1,87±0,34* |
1,38±0,36 |
|
3.Максимальный размер агрегатов MPAi |
1,27±0,11* |
1,56±0,20* |
1,92±0,19* |
1,36±0,15 |
|
4.Скорость достижения максимальной агрегации tga, cMPAi |
26,17±4,15 |
31,49±14,01* |
11,12±3,29* |
15,66±5,07 |
|
5.Время достижения максимальной агрегации с |
181,75±69,03 |
253,29±19,09 |
250,14±22,40 |
218,94±22,74 |
Примечание: СА – спонтанная агрегация, АДФ – АГ – АДФ-индуцированная агрегация, tga – скорость агрегации, MPAi – максимальный размер агрегатов, tga, cMPAi, у.е. – скорость достижения максимального значения агрегатов, знак * – достоверные отличия от исходного состояния.
По данным исследованиям установлено, что максимальная агрегация тромбоцитов, скорость достижения максимальной величины тромбоцитов наблюдается у коллаген индуцированной агрегации. Известно, что генетические типы коллагена различны по составу цепей и локализации. Для агрегации необходимо образование его мультимеров [1, 2]. Во всех формах коллагена более активны a-цепи [3]. Множественность взаимодействий коллаген-тромбоцит – обязательное условие реакции высвобождения и ее следствия – агрегации [9, 15]: денатурированный коллаген, не инициирует агрегацию [11]. Что касается АДФ-индуцированной агрегации, то показатели зависят от концентрации индуктора агрегации. При концентрации АДФ 2,5 мкг/мл наблюдается максимальный размер агрегатов, увеличивается скорость достижения максимального размера агрегатов, а время достижения максимальной агрегации не зависит от концентрации АДФ. АДФ – важнейший физиологический Са2+- зависимый индуктор агрегации, реализующий эффект фибриногена, альбумина и агрегсонов А и В. Агрегация обратима при малых концентрациях АДФ и необратима – при высоких, высвобождающих АДФ из клеток [5]. Кинетика превращения дисковидных тромбоцитов в сферические не зависит от концентрации АДФ и не коррелирует и с восстановлением их формы [12]. Агрегацию инициирует связывание АДФ с тромбоцитом, вызывающее деполяризацию плазматической мембраны [8], которая определяет потерю дисковидной формы и появление псевдоподий. Сопутствующее сокращение системы микротрубочек ведет к смещению гранул к центру клетки [12]. В этом не участвует внеклеточный Са2+ [10]. Выявлены две компоненты кривой первичной АДФ-агрегации: медленная – при минимальных концентрациях АДФ, быстрая – при концентрации 0,4-0,8 мкМ [1, 10, 13]. Агрегация при сдвиге напряжения опосредуется АДФ: в присутствии креатинфосфат-креатинфосфокиназной системы, утилизирующей АДФ, вызванная сдвигом агрегация ослаблена [6, 11]. Влияние АДФ на агрегации тромбоцитов зависит от рН, t°, концентрации гликоаминогликанов, двухвалентных ионов, особенно Са2+ и Mn и др. [8, 12], от сезона, гормонального фона, физической нагрузки, мало зависит от пола, возраста [10]. Изменена АДФ-агрегация при патологии [8, 14]. Первой ответной реакцией является изменение формы тромбоцитов, их дискоидная форма переходит в сферическую, в то же время появляются псевдоподии. За изменением формы тромбоцитов наступает первая фаза агрегации, вызываемая агрегационным средством. После окончания первичной агрегации крутизна агрегационной кривой понижается, за этот период из тромбоцитов освобождаются биологически активные соединения, вызывающие новую агрегационную волну. На рис. 1-4 приведены примеры агрегационных кривых больных многоузловым зобом с использованием разных индукторов агрегации.
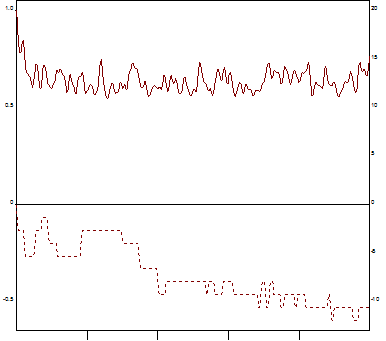
Рис. 1. Спонтанная агрегация. Левая шкала – размер агрегатов в образце плазмы в относительных единицах. Правая шкала – светопропускание плазмы в %. Средний радиус: максимальный размер агрегатов 1,00, скорость достижения максимального значения агрегатов 0,45. Светопропускание: максимальное светопропускание 0,00, скорость достижения максимального значения светопропускания 13,8
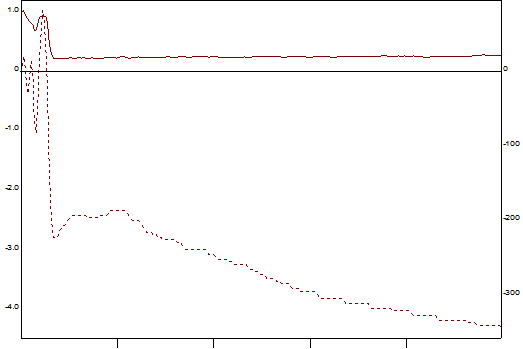
Рис. 2. АДФ – индуцированная агрегация (АДФ – 1, 25 мкг/мл).
Левая шкала – размер агрегатов в образце плазмы в относительных единицах.
Правая шкала – светопропускание плазмы в %.
Средний радиус: максимальный размер агрегатов 1,02, скорость достижения максимального значения агрегатов 0,07.
Светопропускание: максимальное светопропускание 81,60, скорость достижения максимального значения светопропускания 100,00
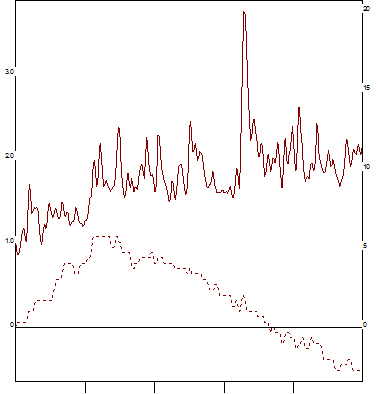
Рис. 3. АДФ – индуцированная агрегация. (АДФ – 2,5 мкг/мл). Левая шкала – размер агрегатов в образце плазмы в относительных единицах.
Правая шкала – светопропускание плазмы в %. Средний радиус: максимальный размер агрегатов 3,74, скорость достижения максимального значения агрегатов 6,26. Светопропускание: максимальное светопропускание 5,75, скорость достижения максимального значения светопропускания 8,80
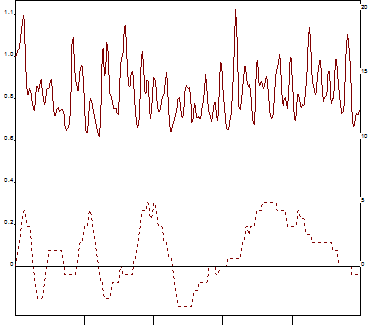
Рис. 4. Коллаген – индуцированная агрегация. (Коллаген – 2,5 мкг/мл).
Левая шкала – размер агрегатов в образце плазмы в относительных единицах. Правая шкала – светопропускание плазмы в %. Средний радиус: максимальный размер агрегатов 1,22, скорость достижения максимального значения агрегатов 1,02. Светопропускание: максимальное светопропускание 4,95, скорость достижения максимального значения светопропускания 20,70
Заключение
Таким образом, нарушения функции щитовидной железы (многоузловой зоб) приводят к характерным изменениям в агрегации, выявление и дифференциальная диагностика которых возможна на основании агрегационных кривых. Для ответа на диагностические вопросы достаточно применение АДФ и коллагена, как индукторов агрегации.
Библиографическая ссылка
Ральченко И.В., Чепис М.В., Ральченко Е.С., Книга М.Ю., Русакова О.А., Герберт И.Я. АГРЕГАЦИЯ ТРОМБОЦИТОВ У БОЛЬНЫХ МНОГОУЗЛОВЫМ ЗОБОМ С ИСПОЛЬЗОВАНИЕМ РАЗНЫХ ИНДУКТОРОВ АГРЕГАЦИИ // Современные проблемы науки и образования. – 2017. – № 3. ;URL: https://science-education.ru/ru/article/view?id=26510 (дата обращения: 18.04.2024).



