Пищевод Барретта (ПБ) представляет собой заболевание, развивающееся в результате замещения многослойного плоского эпителия пищевода специализированным цилиндрическим эпителием [1]. ПБ является грозным осложнением гастроэзофагельной-рефлюксной болезни и в большинстве случаев протекает на фоне грыжи пищеводного отверстия диафрагмы. Частота выявления пищевода Барретта составляет от 2,4 до 4 % в среднем по популяции [2,3]. Однако значительное число больных, имеющих симптомы гастроэзофагеального рефлюкса (ГЭР), самостоятельно бесконтрольно в течение продолжительного времени применяют различные медикаментозные средства, чаще широкодоступные антациды, не обращаясь к врачам [4], поэтому значительная часть больных с пищеводом Барретта остается невыявленной [5]. Прогрессирование пищевода Барретта может приводить к дисплазии слизистой оболочки до возможного развития рака пищевода [6]. По данным ряда авторов в России, США, странах Западной Европы, а также в ряде стран Азии за последние 10 лет отмечается резкий подъем заболеваемости аденокарциномой пищевода [7]. В диагностике ПБ решающее значение имеют эндоскопическое исследование с морфологической верификацией диагноза. Эндоскопически пищевод Барретта рассматривается как ярко-розовые патологические участки на фоне бледно-розовой слизистой пищевода, отходящие от слизистой оболочки выше кардиоэзофагеального перехода (КЭП) – “языки пламени”. Обязательным критерием диагноза является наличие кишечной метаплазии. На сегодняшний день рекомендованным методом взятия биопсийного материала при ПБ является прицельная биопсия с четырехквадрантным методом забора материала через каждые 2 см. С целью повышения эффективности визуализации очагов метаплазии при проведении эндоскопического исследования широко применяются: метод хромоскопии с использованием красителей (раствора Люголя, метиленового синего, уксусной кислоты, индигокармина), осмотр слизистой оболочки с использованием увеличительной и узкоспектральной эндоскопии (режим NBI), а также конфокальная лазерная эндомикроскопия. В 2004 году в Праге Международной Рабочей Группой по классификации эзофагитов выдвинуты критерии на основании максимальной длины языков пламени (М) и максимальной длины циркулярного сегмента пищевода Барретта (С). В Пражской классификации учитываются очаги пищевода Барретта протяженностью 1 см и более, находящиеся выше КЭП [4]. По длине сегмента пищевода Барретта выделяют: короткий сегмент – от 1 до 3 см и длинный сегмент – более 3 см. Что касается вопроса лечения ПБ, то обзор отечественной и зарубежной литературы показал, что не существует единых подходов к лечению ПБ. В последнее время широко применяются эндоскопические методики, такие как аргон-плазменная коагуляция (АПК), фотодинамическая терапия, криоабляция, лазерная коагуляция и др. [8]. Тем не менее требуются дальнейшие исследования для оптимизации методов диагностики и лечения ПБ.
Цель исследования
Улучшение результатов лечения пациентов с пищеводом Барретта.
Материалы и методы
В хирургическом отделении клиники Ростовского государственного медицинского университета проходили лечение 125 пациентов с диагнозом – осложненная грыжа пищеводного отверстия диафрагмы, среди них – 27 пациентов с подозрением на метаплазию эпителия. Основными жалобами пациентов являлись изжога, боль за грудиной, отрыжка, регургитация, обусловленные наличием ГЭР. Практически все пациенты отмечали длительный анамнез симптомов гастроэзофагельной-рефлюксной болезни.
Всем пациентам выполнялось эндоскопическое исследование с биопсией подозрительных участков (в том числе применялся метод хромоскопии раствором метиленового синего и использовался режим NBI). Протокол эндоскопического исследования составлялся на основании клинических рекомендаций, принятых на XVIII Съезде Общества Эндоскопических Хирургов России, проходившем в Москве 2015 году [9].
В 19 наблюдениях был подтвержден диагноз пищевод Барретта. Возраст больных колебался от 17 до 72 лет (средний возраст составил 49,9 ± 14,7 лет). Частота заболевания у мужчин составила 47,3 %, у женщин – 52,7 %.
Алгоритм лечения пищевода Барретта включал несколько составляющих (рис. 1).

Рис. 1. Схема лечения пищевода Барретта
В до- и послеоперационном периоде проводилась медикаментозная терапия, направленная на снижение кислотности желудочного сока, нейтрализацию выработанной соляной кислоты, ускорение эвакуации пищи из желудка. Использовались следующие группы препаратов:
- Ингибиторы протонной помпы.
- Антацидные препараты.
- Прокинетики.
Всем пациентам выполнена операция Ниссена или Ниссена – Розетти из лапароскопического доступа, заключающаяся в восстановлении функции кардиального сфинктера, устранение ГЭР и клинических проявлений.
Следующим этапом выполнялись сеансы АПК с использованием электрохирургической станции ERBEVIO 300 Dсо следующими параметрами:
- режим: FORСED APC,
- мощность: 30 – 32 Вт,
- расход аргона: 2 – 2,2 л/мин.
За 1 сеанс проводилась коагуляция пораженного участка площадью не более 4 см². Время манипуляции составляло около 5–7 мин. Всем пациентам сеансы АПК проводились в амбулаторных условиях под внутривенной седацией. После лечения осуществлялся эндоскопический контроль с биопсией.
Расчет статистических данных производился с помощью методов описательной статистики с использованием программного обеспечения «MicrosoftExcel 2016».
Результаты и их обсуждение
При эндоскопическом исследовании у 27 пациентов с подозрением на ПБ выявлены признаки метаплазии эпителия и рефлюкс-эзофагит различной степени тяжести. После патоморфологического заключения у 19 пациентов верифицирован эпителий кишечного типа (таблица). У 8 пациентов отмечалась желудочная метаплазия, данным пациентам выполнено хирургическое лечение по поводу грыжи пищеводного отверстия диафрагмы с медикаментозной коррекций и рекомендован эндоскопический контроль с биопсией каждые 3 года.
Распределение пациентов по патоморфологическому заключению
|
Патоморфологическое заключение |
Количество пациентов |
|
|
|
абс. |
% |
|
Желудочная метаплазия |
8 |
29,6 |
|
Кишечная метаплазия без дисплазии |
16 |
59,3 |
|
Дисплазия низкой степени |
3 |
11,1 |
|
Дисплазия высокой степени |
0 |
0 |
|
Аденокарцинома пищевода |
0 |
0 |
|
Всего |
27 |
100,0 |
Патоморфологическое исследование заключалось в фиксации биопсийного материала в забуференном 10 % растворе формалина в течение 24 часов от момента его поступления в патологоанатомическое отделение с последующей спиртовой проводкой по обычной методике. В последующем, фрагменты биопсийного материала заливались в парафин, проводилась микротомия с толщиной среза не более 3 мкм, после чего гистологические срезы окрашивались гематоксилином-эозином, пикрофуксином по Ван Гизон, по Хочкиссу (ШИК-реакция) с докраской альциановым – синим PH-2,0. Данные методики позволяли оценить степень секреторной активности клеток эпителия, накопление в нем кислых и нейтральных мукополисахаридов, состояние бокаловидных клеток при наличии метаплазии, дисплазии (высокой и низкой степени). Оценка морфологических изменений проводилась с использованием полуколичественных методов оценки.
Так как в настоящее время существуют разногласия в патоморфологической оценке степени выраженности дисплазии железистого эпителия при пищеводе Барретта в американских (европейских) и японских исследованиях, мы придерживались рекомендаций международной группы ученых [10].
Из 19 пациентов с ПБ в 12 случаях преобладал длинный сегмент метаплазии эпителия, у 7 пациентов – короткий сегмент. Для адекватной оценки длины сегмента метаплазированного эпителия при выполнении эндоскопического исследования особое внимание необходимо уделять определению истинной границы КЭП. Основными ориентирами КЭП принято считать дистальный край палисадных сосудов слизистой оболочки пищевода и проксимальный край складок кардиального отдела желудка. Наличие признаков рефлюкс-эзофагита, степень инсуффляции при исследовании, а также анатомические варианты сосудов пищевода могут приводить к трудностям в определении КЭП и требуют определенного навыка со стороны специалиста, проводимого исследование. Размеры сегментов ПБ необходимо определять с использованием Пражских критериев. Для лучшей визуализации патологических участков самыми оптимальными и простыми методами являются хромоскопия и осмотр слизистой оболочки пищевода в режиме NBI, не требующие дополнительных затрат и специального оборудования, но достаточно высокоэффективные. Таким образом, в комплекс диагностических мероприятий пациентов с подозрением на ПБ должны обязательно входить: эндоскопическое исследование в обычном режиме и с использованием узкоспектральной эндоскопии, биопсия подозрительных участков через каждые 2 см. С целью стандартизации описания изменений при ПБ необходимо вести протоколы эндоскопических исследований (рис. 2).
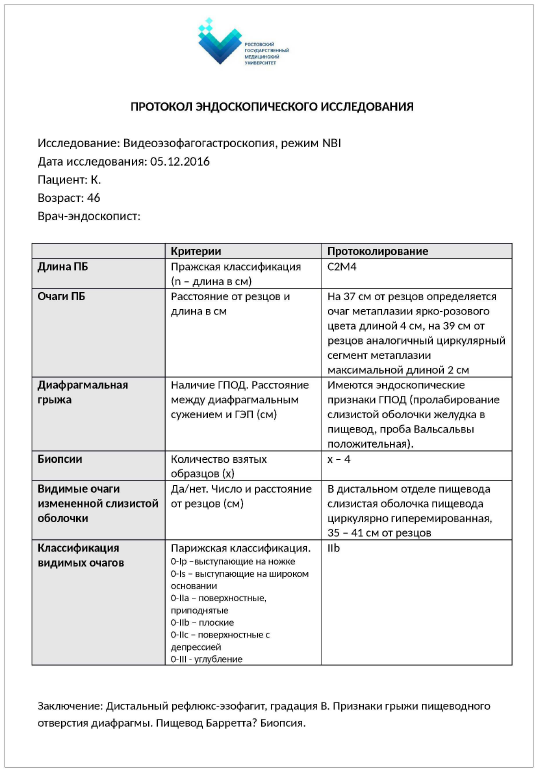
Рис. 2. Пример протокола эндоскопического исследования при пищеводе Барретта
Мы считаем, что лечение ПБ должно иметь комплексный подход, а именно, проведение медикаментозной терапии в пред- и послеоперационном периоде, выполнение антирефлюксных операций и последующие сеансы аргон-плазменной коагуляции [11].
Все наши пациенты в предоперационном периоде получали медикаментозную терапию, длительность которой зависела от степени повреждения слизистой оболочки пищевода. В настоящее время нет убедительных данных относительно регрессии метаплазии эпителия на фоне консервативной терапии. Медикаментозная терапия направлена лишь на уменьшение клинических проявлений рефлюкс-эзофагита.
Антирефлюксная хирургия не приводит к уменьшению сегментов ПБ, но это единственный метод, позволяющий восстановить функцию кардиального сфинктера и устранить гастроэзофагеальный рефлюкс с его последствиями, благодаря чему снижается воздействие кислой среды на слизистую оболочку пищевода, уменьшается воспаление тканей, тем самым создаются благоприятные условия для эффективного выполнения эндоскопического лечения ПБ. Всем пациентам с ПБ показано хирургическое лечение. Операциями выбора мы считаем операции Ниссена или Ниссена – Розетти из лапароскопического доступа. По нашим исследованиям первичное эндоскопическое лечение ПБ, т. е. до выполнения антирефлюксных операций, неэффективно и может приводить к неудовлетворительным результатам.
Через 1–1,5 мес после операции и стихания воспалительных изменений в пищеводе пациентам выполнялась эндоскопическая АПК. В ближайшем периоде после АПК осложнений лечения не отмечено. Болевой синдром после проведения АПК отмечался у 2-х пациентов, но купировался в течение 10-15 мин. применением антацидных препаратов с анестетиком. После выполнения эндоскопической АПК все пациенты возвращались к привычной деятельности на следующий день.
В зависимости от размеров сегмента метаплазии в среднем выполнялись от 1 до 5 сеансов АПК. Каждый повторный сеанс АПК проводили через 1–1,5 мес., это срок, достаточный для уменьшения посткоагуляционного отёка и визуализации границ эпителизации. За 1 сеанс площадь коагуляции поражённого участка составляла не более 4 см2, что практически не вызывает болевой реакции и снижает риск развития рубцовых стриктур пищевода. При проведении АПК воздействие начинали с краёв метаплазированного сегмента, что позволяло чётко отграничить патологический очаг, который требовал абляции.
Эндоскопическое лечение ПБ обеспечивает полное удаление очагов метаплазии эпителия. Из всех эндоскопических методик мы отдаем предпочтение АПК, так как данный метод лечения характеризуется высокой безопасностью применения с минимальными побочными эффектами и осложнениями.
В сроке до 3-х лет у 14 пациентов курс лечения полностью завершен. У данных пациентов отмечается полная регрессия метаплазированного эпителия и замещение его типичным многослойным плоским эпителием, подтвержденная гистологическим исследованием (Рис. 3). Еще 5 пациентов продолжают лечение.
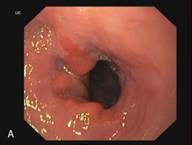
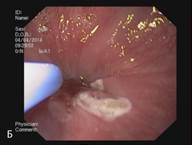
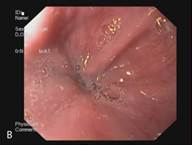
Рис. 3. Эндоскопическая картина пищевода Барретта. А – Эзофагоскопия. Слизистая оболочка пищевода до лечения, сегмент пищевода Барретта. Б – Аргон-плазменная коагуляция. В – Эзофагоскопия. Слизистая оболочка пищевода после лечения, полная регрессия метаплазированного эпителия
Обязательным условием при ведении пациентов с ПБ является эндоскопический контроль с биопсией, который необходимо осуществлять через 3, 6 и 12 мес. после лечения, затем (при длине сегмента более 3 см) – 1 раз в год, при длине сегмента менее 3 см – 1 раз в 2 года.
Выводы
- Комплекс диагностических мероприятий при пищеводе Барретта должен состоять из эндоскопического (с использованием методов, повышающих визуализацию) и морфологического исследований (прицельная биопсия + четырехквадрантный метод забора материала через каждые 2 см).
- Лечение пациентов с пищеводом Барретта должно иметь комплексный подход. Всем пациентам с пищеводом Барретта показано выполнение антирефлюксных операций. В пред- и послеоперационном периоде должна проводиться медикаментозная терапия, направленная на снижение кислотности желудочного сока, нейтрализацию выработанной соляной кислоты и ускорение эвакуации пищи из желудка.
- Аргон-плазменная коагуляция должна проводиться в зависимости от длины сегмента метаплазии, с интервалами 1–1,5 мес., с эндоскопическим и гистологическим контролем. За 1 сеанс площадь коагуляции метаплазированного участка не должна составлять более 4 см².
- Эндоскопический контроль с биопсией должен осуществляться через 3, 6 и 12 мес., а затем (при длине сегмента более 3 см) – 1 раз в год, при длине сегмента менее 3 см – 1 раз в 2 года.
Библиографическая ссылка
Черкасов М.Ф., Скуратов А.В., Черкасов Д.М., Старцев Ю.М., Меликова С.Г. ПРИНЦИПЫ ДИАГНОСТИКИ И ЛЕЧЕНИЯ ПИЩЕВОДА БАРРЕТТА // Современные проблемы науки и образования. – 2017. – № 4. ;URL: https://science-education.ru/ru/article/view?id=26465 (дата обращения: 19.04.2024).



