Восстановление поражений кожи при ожогах и ранах продолжает оставаться серьезной и социально значимой проблемой. Одним из современных направлений лечения дефектов кожи является использование клеточных технологий [7; 9], в частности – применение персонифицированных маломанипуляционных технологий. Основные преимущества этих методов – использование аутологичного клеточного материала и исключение этапов культивирования, что обеспечивает их максимальную простоту и безопасность. Наиболее известная и получившая признание маломанипуляционная технология для лечения дефектов кожи – технология «ReCell» компании Avita Medica, применяющаяся в ряде стран Европы, Канаде и Австралии [5; 6; 8]. ReCell получила регистрацию и в России и использовалась в ряде ведущих ожоговых центров [3], в том числе в ФГБУ «ПФМИЦ» Минздрава России в 2013-2014 годах. Показанием для ее применения являются локальные ожоги 2-й степени, что значительно ограничивает возможности использования. Кроме того, в клинической практике специалистов не удовлетворяло длительное нахождение пациентов под наркозом (до часа, иногда более), необходимое для полноценного ферментативного разделения кожи и выделения клеточной взвеси, и отсутствие фиксации клеточного материала к раневому ложу, приводящее к «стеканию» взвеси при расположении ран на боковых поверхностях туловища и/или конечностей.
Для уменьшения указанных недостатков специалисты ФГБУ «ПФМИЦ» Минздрава России разработали оригинальный способ лечения ожоговых ран [2], также основанный на применении взвеси свежевыделенных аутологичных клеток кожи пациента. Его применение позволило получить хорошие клинические результаты при лечении детей [1] с ожоговыми поражениями кожи как 2-й, так и 3-й степени. При использовании ReCell не фиксируются персональные данные о клеточном материале в каждом конкретном случае, что затрудняет анализ полученных результатов и возможность их коррекции и, на наш взгляд, является еще одним недостатком.
Поэтому было необходимо: во-первых, определить состав и дать характеристику клеточной взвеси, выделенной из неизмененной кожи пациентов с ожоговой травмой с использованием различных методов ферментативной обработки; во-вторых, выбрать оптимальный по простоте и эффективности метод ферментативной обработки; в-третьих, определить влияние на качество полученного клеточного материала возраста пострадавших.
Экспериментальная часть
Материалом для исследования были биоптаты утильной кожи 18 детей и 16 взрослых с ожоговыми поражениями, взятые во время операций аутодермопластики. Средний возраст детей составил 2.34±0.69, взрослых – 52.75±2.87 года. Протокол исследования утвержден локальным этическим комитетом (протокол № 4 от 25.03.2015) и Ученым советом ФГБУ «ПФМИЦ» Минздрава России. У каждого пациента или его официального представителя было получено информированное добровольное согласие на участие в исследовании.
Биоптаты кожи забирали в условиях операционной в стерильную пробирку, содержащую 0.9%-ный физиологический раствор и антибиотики (пенициллин/стрептомицин), и доставляли в лабораторию.
В условиях ламинарного бокса кожу тщательно многократно промывали стерильным 0.9%-ным физиологическим раствором и отделяли от остатков подкожно жировой клетчатки. После чего повторно промывали и переносили в пробирку с 0.25%-ным раствором трипсина. Несколько образцов разделяли на равные части, одну из которых помещали в холодильник при температуре +4-+6 °С на 18 часов, а вторую – в термостат при 37 °С на 1 час. По окончании периода ферментативной обработки действие фермента останавливали добавлением физиологического раствора с 10% аутологичной сыворотки. Пинцетом осторожно отделяли эпидермис от дермы по линии базальной мембраны и физиологическим раствором интенсивно смывали клетки с обоих слоев кожи с помощью шприца или пипетки. Полученную клеточную взвесь собирали в стерильную пробирку, тщательно ресуспендировали и использовали для исследования. Следует отметить, что при тепловой обработке не всегда происходило хорошее разделение слоев кожи. Для работы был выбран метод холодовой ферментативной обработки как более щадящий.
Концентрацию и процент жизнеспособных клеток во взвеси определяли на счетчике «Countes», Invitrogen, США. Для определения жизнеспособности применяли прижизненный краситель трипановый синий.
Фенотипирование клеток взвеси проводили на цитофлюориметре Navios Becman Coulter, США с помощью панели антител Becman Coulter (CD 45PC5, CD 14 PC5, CD HLA-DR PC7, CD 34PC7, Cetokeratin_Fitc, CD 90Fitc, CD 105PE, CD 44Fitc, CD 73PE, CD 10PC7, CD 13 PC5 с соответствующими изотипическими контролями). Для фенотипирования использовали от 500 тысяч до 1 миллиона клеточной взвеси из каждой пробы.
Часть клеточной взвеси (200 тыс./кв. см) засевали на чашки Петри (S=7 кв. см, «Costar») в среде DMEM с добавлением антибиотиков (пенициллин/стрептомицин), 2% глутамина и 10% телячьей эмбриональной сыворотки и помещали в СО2 – инкубатор при 5% СО2, 37 °С и абсолютной влажности. Для работы использовали реактивы и среды производства ООО «ПанЭко» Москва, Россия. Каждые 24 часа контролировали состояние культуры на пластике с помощью инвертированного микроскопа «Leica DM I 3000B», оснащенного видеокамерой и программой «LAS V 4.3», при увеличении ×50, ×100, ×200. Использовали метод светлого поля и фазового контраста. Через 48 часов после начала инкубации меняли среду. В дальнейшем смену среды проводили каждые 48 часов. За ростом клеток на пластике наблюдали в течение 96-144 часов до образования субконфлюэнтного монослоя. После чего культуру на части чашек окрашивали с помощью стандартной окраски азур-эозином по Романовскому, а часть чашек с культурой передавали для иммуногистохимического исследования.
Иммуногистохимическое исследование проводили на монослое клеток в чашках Петри, где клетки были предварительно зафиксированы 70%-ным этанолом. Протокол исследования включал инкубацию клеток с первичными антителами с последующей визуализацией на основе использования системы детекции UltraVision Quanto (Lab Vision Corporation, USA) и ее протокола (без блокирования пероксидазной активности и протеинового блока).
Были использованы моноклональные мышиные антитела к поверхностному белку фибробластов человека (Monoclonal mouse antibody to human fibroblast surface protein), clon 1B10 (Diagnostic BioSystems, USA), моноклональные мышиные антитела к Cytokeratin Pan (CKPAN), clon AE1/AE3 и моноклональные кроличьи антитела к Vimentin, clon SP20 (Lab Vision Corporation, USA). Окрашивание проводили сразу двумя антителами в одной чашке Петри, разграничивая области их нанесения гидрофобным карандашом. Ядра клеток докрашивали гематоксилином Майера.
Для статистической обработки результатов применяли методы непараметрической статистики с использованием пакета программ STATISTICA 6. Статистический анализ включал оценку нормальности распределения, определение среднего арифметического (М±m), t-критерия Стьюдента. Различия считали статистически значимыми при вероятности ошибки p<0.05.
Результаты и обсуждение
В выделенной взвеси фиксировали клетки разного размера, округлой и полигональной формы, без признаков деградации. В образцах, полученных после тепловой ферментативной обработки, отмечалось достаточно большое количество клеточного детрита, после холодовой – оно было незначительно. Количество выделенных клеток из одного и того же биоптата при различных способах ферментативной обработки существенно отличалось (таблица 1), так же как и доля жизнеспособных клеток. При этом в каждом образце при использовании метода холодовой ферментативной обработки и количество выделенных клеток, и процент жизнеспособных среди них преобладали по сравнению с данными, полученными при тепловой ферментативной обработке.
Полученные данные согласуются с результатами других авторов, указывающих на более щадящее действие фермента при холодовой обработке, характеризующееся большим выходом клеточной массы и доли жизнеспособных клеток [4].
Таблица 1
Концентрация и % жизнеспособных клеток во взвеси при различных способах ферментативной обработки
|
№ образца |
Холодовая трипсинизация |
Тепловая трипсинизация |
||
|
Количество клеток с 1 кв. см биоптата |
% жизнеспособных клеток |
Количество клеток с 1 кв. см биоптата |
% жизнеспособных клеток |
|
|
1 |
7.3×106 |
81% |
6.9×105 |
70% |
|
2 |
7.6×106 |
84% |
4.8×106 |
50% |
|
3 |
10.8×106 |
76% |
6.1×106 |
39% |
|
4 |
8.9×106 |
78% |
4.8×106 |
48% |
|
5 |
7.0×106 |
80% |
1.7×106 |
69% |
|
6 |
7.8×106 |
81% |
2.0×106 |
66 % |
Последующее исследование проводили только с образцами кожи, обработанными методом холодовой трипсинизации. При проведении холодовой ферментативной обработки сравнивали эффективность выделения клеток с 1 кв. см биоптата кожи, полученного от пострадавших детского возраста, и с биоптата такой же площади, полученного у взрослых. Результаты представлены в таблице 2.
Таблица 2
Характеристика клеток взвеси в зависимости от возраста пострадавших
|
Группы |
Возраст пострадавших |
Жизнеспособность в % (М±m) |
Количество клеток, выделенных с 1 кв. см биоптата (M±m) |
|
Дети |
2.34±0.69 |
80.39±3.02% |
12.88±0.75 млн |
|
Взрослые |
52.75±2.87 |
76.82±4.44% |
7.17±4.44 млн |
|
P |
1.000 |
1.000 |
Концентрация клеток в суспензии, выделенной методом холодовой трипсинизации, колебалась от 6 до 20 млн/мл; жизнеспособность – от 60 до 88%. Статистически значимых различий между данными, полученными при исследовании материала от детей и взрослых при выраженных возрастных различиях, не выявлено.
При фенотипировании установлено, что во всех пробах преобладали (80.4±9.7%) клетки, положительные на Cetokeratin (внуктриклеточный маркер кератиноцитов). Маркеры мезенхимальных клеток (CD 90+, CD 105PE+, CD 44+, CD 73+, CD 10+, CD13+) определялись на 14.2±5.6% клеток, что свидетельствовало о присутствии в клеточной взвеси клеток мезенхимального происхождения – предположительно фибробластов (основной популяции клеток дермы). Маркеры гемопоэтических клеток (CD 45, CD 14, CD HLA- DR, CD 34) составляли не более 4-6%, а в ряде образцов не определялись.
При наблюдении за ростом клеток в культуре уже через 24 часа фиксировали адгезию единичных клеток к пластику, однако основная масса клеток оставалась в среде (рис. 1).
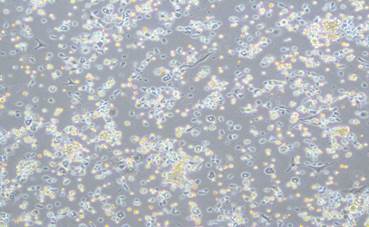
Рис. 1. Взвесь аутологичных клеток на чашке Петри через 24 часа культивирования (увеличение ×100, фазовый контраст)
На рис. 1 видны единичные распластанные клетки веретеновидной или звездчатой формы с выраженными отростками (фибробласты) и преобладающие, как плавающие в среде, так и прикрепившиеся к пластику, клетки полигональной и округлой формы (кератиноциты), а также мелкие клетки округлой формы (клетки крови).
Через 48 часов число клеток, фиксированных к пластику, увеличивалось (рис. 2). После смены среды на поверхности пластика видны: полигональные и округлые клетки с крупными ядрами, клетки веретеновидной или звездчатой формы с выраженными отростками, кроме того, наблюдали скопления клеток различной формы и размеров.
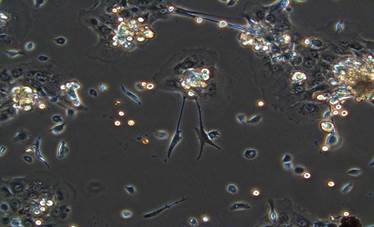
Рис. 2. Культура аутологичных клеток на чашке Петри через 48 часов культивирования (увеличение ×100, фазовый контраст)
Через 96-144 часа на поверхности культурального сосуда отмечали формирование субконфлюэнтного монослоя. Клетки монослоя покрывали до 70-80% поверхности. В эти сроки культуру фиксировали и окрашивали непосредственно на пластике. Монослой был сформирован крупными клетками полигональной формы с центрально расположенными крупными ядрами, в которых определялись 3-4 ядрышка. Форма и размеры клеток соответствовали таковым для клеток эпидермиса. Кроме того, на поверхности фиксировались единичные веретеновидные клетки с выраженными отростками, что характерно для фибробластов. Часть образцов использовали для иммуногистохимического исследования. Окрашивание проводили сразу двумя антителами в одной чашке Петри, разграничивая области их нанесения гидрофобным карандашом. Ядра клеток докрашивали гематоксилином Майера.
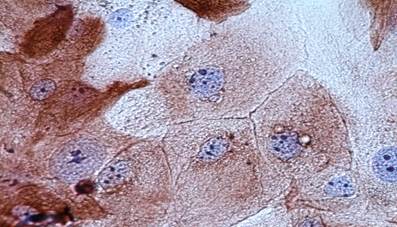
Рис. 3. Cytokeratin Pan-позитивные клетки в культуре (иммуногистохимическое окрашивание антителом Cytokeratin Pan, увеличение ×400)
Иммуногистохимическое окрашивание антителами к Cytokeratin Pan и Vimentin позволило наглядно дифференцировать фибробласты и кератиноциты. Окраска цитоплазмы Cytokeratin Pan свидетельствовала о наличии в этой культуре эпителиальных клеток, а различная интенсивность окрашивания клеток в образцах демонстрировала многослойность (слоистость) культуры (рис. 3). Клетки Cytokeratin Pan-позитивные отличаются по форме и размерам от Vimentin-позитивных фибробластов (рис. 4), на фоне интенсивно окрашенной цитоплазмы которых отчетливо просматриваются ядра неокрашенных кератиноцитов.
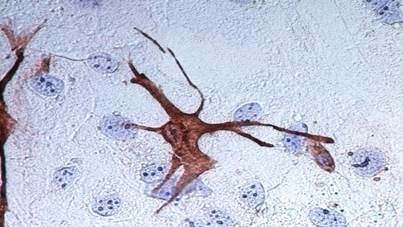
Рис. 4. Виментин-позитивные клетки в культуре (иммуногистохимическое окрашивание антителом Vimentin, ув. ×400)
Таким образом, проведенное исследование клеточной взвеси, выделенной из образцов неизмененной кожи пациентов с ожоговой травмой разного возраста, продемонстрировало наличие в ее составе как клеток эпидермиса – кератиноцитов, так и основных клеток дермального слоя – фибробластов. Это подтверждается выявлением различными методами (цитофлюориметрия, иммуногистохимия) в составе взвеси клеток как несущих маркеры кератиноцитов (цитокератин), так и маркеры, типичные для клеток мезенхимы – фибробластов: виментин, CD 90+, CD 105PE+, CD 44+, CD 73+, CD 10+, CD13+. Микроскопически форма клеток также соответствует основным типам клеток двух слоев кожи. Высокая жизнеспособность клеток в выделенной взвеси и способность к адгезии и пролиферации на пластике с сохранением характерных особенностей демонстрирует полноценность выделенных клеточных элементов. Следует отметить, что исследование материала, полученного от детей и взрослых, по жизнеспособности и количеству выделенных клеток с одного квадратного сантиметра не выявило статистически значимых различий, то есть возраст пострадавшего не влияет на характеристику полученной из его кожи клеточной взвеси.
Заключение. Таким образом, взвесь свежевыделенных клеток, полученная из неизмененной кожи пациентов с ожоговой травмой, состоит из основных клеточных элементов ее обоих слоев: и кератиноцитов, и фибробластов. Аутологичные клетки после выделения сохраняют высокую жизнеспособность и функциональную активность, так как определяется их выраженная адгезия к пластику, сохраняется пролиферативная активность и способность к экспрессии типичных рецепторов. Характеристики клеток взвеси не зависят от возраста пострадавших. В результате показано, что при использовании метода холодовой трипсинизации из неизмененной кожи пациентов с ожоговой травмой получен клеточный материал с хорошими свойствами, и это открывает перспективы для его клинического применения.
Библиографическая ссылка
Алейник Д.Я., Чарыкова И.Н., Давыденко Д.В., Рубцова Ю.П. ХАРАКТЕРИСТИКА КЛЕТОЧНОЙ ВЗВЕСИ, ВЫДЕЛЕННОЙ ИЗ НЕИЗМЕНЕННОЙ КОЖИ ПОСТРАДАВШИХ С ОЖОГОВОЙ ТРАВМОЙ // Современные проблемы науки и образования. – 2017. – № 2. ;URL: https://science-education.ru/ru/article/view?id=26332 (дата обращения: 16.04.2024).



