До настоящего времени в современной хирургии проблема оптимизации регенерации тканей ран различных структур остается весьма актуальной [1, 3, 6]. Результаты, полученные при анализе рядом исследователей, показывают, что до сих пор в хирургии послеоперационные осложнения со стороны ран являются довольно частым явлением [8, 9]. Особенно острой стоит эта проблема в отягощенных условиях для физиологического течения репаративного процесса [10, 11]. Несомненно, проблема заживления ран является своеобразным «тормозом» развития хирургии [5, 7]. Поэтому углубленное изучение причин срыва репаративного процесса может явиться одним из важнейших путей поиска действенных способов индукции регенерации [2, 4, 12].
Цель исследования – в динамике перитонита (в отягощенных условиях) изучить морфологические, метаболические и функциональные характеристики регенерирующих структур тканей тонкой кишки и брюшной стенки.
Материалы и методы исследования. Работа базируется на экспериментальных данных, поскольку ряд исследований состояния тканей области швов сопряжен с биопсией, которую выполнить в клинике у больных не всегда представляется возможным. Использовали каловую модель перитонита. Под тиопентал-натриевым наркозом (0,04 г/кг массы) выполняли введение в брюшную полость животных (17 беспородных взрослых собак) 20 % каловой взвеси из расчета 0,5 мл на 1 кг массы. Через сутки после моделирования выполняли лапаротомию, брюшную полость санировали, резецировали часть тонкой кишки с последующим формированием двухрядного инвертированного анастомоза. Брюшная стенка ушивалась наглухо. В контрольные сроки (1, 3, 5 и 7 суток) производили повторную лапаротомию, в отягощенных перитонитом условиях осуществляли биопсию тканей зоны анастомоза и лапаротомной раны. Интраоперационно и в раннем послеоперационном периоде животным проводилась инфузионная (80 мл на 1 кг) и антибактериальная терапия.
В работе применялись следующие лабораторно-инструментальные методы: определяли уровень токсических продуктов гидрофильной и гидрофобной природы, из биоптатов экстрагировали и фракционировали липиды, оценивали активность фосфолипазы А2, выраженность оксидативных процессов определяли по уровню малонового диальдегида (МДА). Морфологическая оценка проводилась с использованием микроскопии. Изучали показатели микроциркуляции, трофики и электрогенеза тканей кишечного анастомоза и лапаротомной раны. Использовали пневмопрессию для оценки физической герметичности швов анастомоза. В работе применяли статистические методы обработки данных.
Результаты исследования и их обсуждение
Выбранная модель перитонита оказалась вполне адекватной для решения поставленной цели. У животных возникал острый распространенный серозно-фибринозный или гнойно-фибринозный перитонит. При определении уровня токсических продуктов в плазме крови было выявлено прогрессивное увеличение содержания молекул средней массы, на третьи сутки исследования регистрировали повышение данного показателя на 746,3 % (р<0,05) относительно нормы, с пятых суток исследования выявлялась тенденция к снижению уровня среднемолекулярных пептидов в плазме крови. Аналогичная динамика регистрировалась при определении индекса токсичности плазмы крови по альбумину. Данный показатель был выше нормы на 435,3 % (р<0,05) на третьи сутки исследования, когда достигал максимальных значений.
После проведения санационных мероприятий брюшной полости, резекции тонкой кишки и формирования межкишечного соустья в его тканевых структурах возникали выраженные биофизические и биохимические изменения (табл.), что, безусловно, явилось неблагоприятным фоном для течения репаративного процесса. Существенные, но менее значимые патофизиологические явления отмечены и в тканях брюшной стенки области швов лапаротомной раны.
Исследованиями в раннем послеоперационном периоде отмечено, что заживление исследованных тканей протекало замедленно: анастомоза – по типу вторичного натяжения с некрозом тканей внутреннего ряда швов; брюшной стенки – с выраженными воспалительными, а в ряде случаев и гнойными явлениями.
Динамика некоторых биохимических и биофизических показателей состояния регенерирующих тканевых структур кишечного анастомоза
|
Показатель |
Норма |
Санация |
Этапы раннего послеоперационного периода (сутки) |
|||
|
1 |
3 |
5 |
7 |
|||
|
ОВП тканей, мВ |
-37,12 |
-51,8 0,58* |
-66,3 0,78* |
-57,3 0,81* |
-53,1 0,42* |
-49,5 0,89* |
|
Кровенаполнение тканей, мкл/г |
436,5 15,1 |
654,91 7,07* |
899,84 6,89* |
636,07 7,52* |
551,18 4,98* |
510,06 7,03* |
|
МДА в тканях, мкмоль/г |
3,48 |
6,42 0,12* |
8,92 0,17* |
7,56 0,15* |
5,97 0,15* |
4,89 0,14 |
|
Активность фосфолипазы А2 в тканях, мкмоль/c/г белка |
0,91 |
1,38 |
3,12 |
2,89 |
2,11 |
1,74 |
|
Активность каталазы в тканях, мгН2О2/мин/г белка |
0,033 0,002 |
0,044 0,004* |
0,071 0,0008* |
0,058 0,0015* |
0,047 0,0017* |
0,051 0,0049* |
|
Пневмопрессия, кПа |
30,25 |
11,85 0,38* |
15,89 0,26* |
21,26 0,51* |
26,98 0,39* |
|
Примечание: * – достоверность отличия по отношению к норме при p<0,05.
Через сутки после операции зарегистрированы наиболее значимые нарушения трофики тканей по линии швов как области анастомоза, так и брюшной стенки. В первую очередь отметим нарушение процессов, связанных с энергообеспечением. Об этом свидетельствовало снижение окислительно-восстановительного (редокс) потенциала (ОВП) (рис. 1).
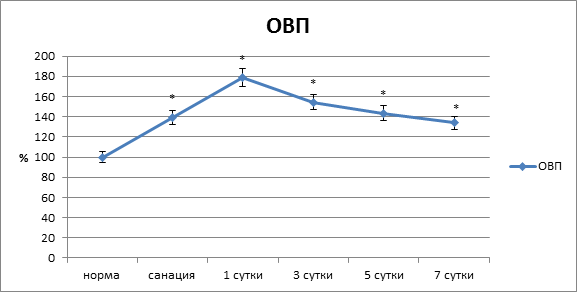
Рис. 1. Окислительно-восстановительный потенциал тканей по линии швов области анастомоза (* – достоверность изменений относительно нормы при р<0,05)
В тканях области соустья он падал на 78,4 % (p<0,05). При этом в регенерирующих структурах отмечено резкое повышение (на 106,1 %) объема крови, что свидетельствовало о выраженности воспалительного процесса. Отметим и резкую интенсификацию процессов перекисного окисления мембранных липидов и повышение фосфолипазной активности. В тканевых структурах анастомоза происходило увеличение содержания МДА на 156,3 % (p<0,05), активность фосфолипазы А2 повышалась на 242,9 % (p<0,05). Показатель пневмопрессии анастомоза – 11,85![]() 0,38 кПа (р<0,05).
0,38 кПа (р<0,05).
Во многом аналогичные явления в этот этап периода наблюдения отмечены и со стороны тканей лапаротомной раны области швов (рис. 2).
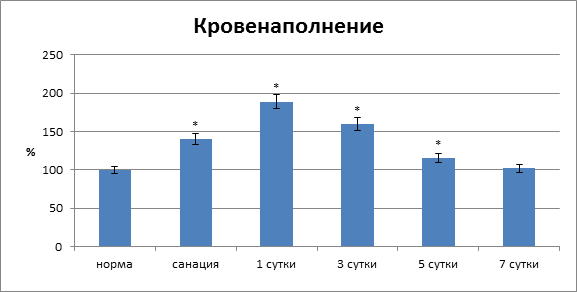
Рис. 2. Кровенаполнение тканей лапаротомной раны по линии швов
(* – достоверность изменений относительно нормы при р<0,05)
Существенные воспалительно-деструктивные явления в тканях по линии швов сохранялись и через трое суток после операции. Окислительно-восстановительный потенциал тканей соустья был ниже нормы на 54,4 % (р<0,01), что свидетельствовало о продолжающихся нарушениях метаболических процессов, связанных с энергообеспечением. Кровенаполнение в области соустья было выше нормы на 45,7 % (р<0,01), что было значительно меньше, чем в предыдущий контрольный этап и в целом могло свидетельствовать о начинающемся регрессе воспалительных явлений. Содержание МДА по линии анастомоза сохранялось повышенным и было выше нормы на 117,2 % (р<0,01), активность фосфолипазы А2 была выше нормы на 2,17,6 % (р<0,01) (рис. 3).
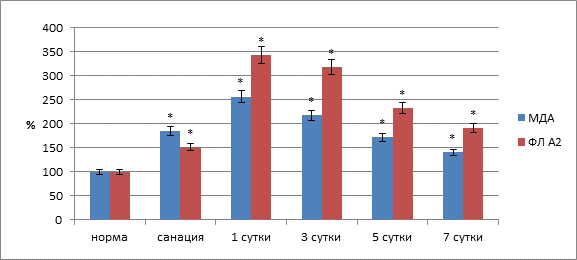
Рис. 3. Содержание малонового диальдегида и активность фосфолипазы А2 в тканях анастамоза по линии швов (* – достоверность изменений относительно нормы при р<0,05)
При пневмопрессии область анастомоза выдерживала давление 15,89![]() 0,26 кПа (р<0,01).
0,26 кПа (р<0,01).
При морфологической оценке в тканях шовного валика сохранялся выраженный воспалительный процесс, одним из проявлений чего была инфильтрация полиморфноядерными лейкоцитами, отмечались дисциркуляторные явления в виде венозного полнокровия и стаза, отека, очаговых и диффузных кровоизлияний.
В следующий этап периода наблюдения (5 суток после операции) зарегистрировано заметное уменьшение изменений биофизических и биохимических показателей тканевых структур анастомоза. Так, редокс-потенциал в области швов приближался к норме и был ниже на 43,1 % (р<0,05). Объем крови в тканях по линии швов был выше нормы только на 26,3 % (р<0,01), что подтверждало тенденцию к уменьшению воспалительного процесса. В тканевых структурах соустья отмечено снижение интенсивности перекисного окисления липидов (ПОЛ) и активности фосфолипазных систем. Содержание МДА в тканях по линии анастомоза было выше нормы на 71,6 % (p<0,05), активность фосфолипазы А2 – на 131,8 % (р<0,05). Нарушение герметичности анастомоза по тесту пневмопрессии происходило при давлении 21,26![]() 0,51 кПа (р<0,05) (рис. 4).
0,51 кПа (р<0,05) (рис. 4).
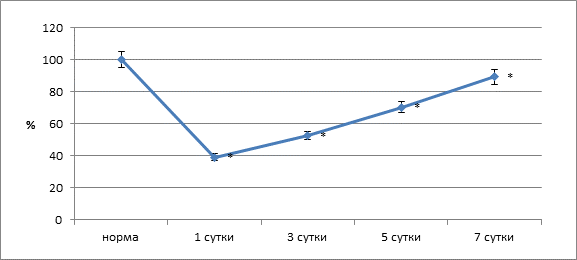
Рис. 4. Данные пневмопрессии в участке анастамоза
(* – достоверность изменений относительно нормы при р<0,05)
Через 7 суток после операции по линии швов процесс неполной репаративной регенерации близился к завершению. По линии швов имелись лишь единичные участки дефектов тканей, выполненных грануляционной тканью. В этот срок исследованные показатели трофики тканей по линии швов в участке анастамоза нормальных значений не достигали. В регенерирующих структурах отмечено стихание интенсивности процессов ПОЛ и активности фосфолипаз, хотя данные показатели оставались выше нормы на 40,5 и 91,2 % (p<0,05). Показатель пневмопрессии анастомоза – 26,9±1,8 кПа.
В этот срок во многом аналогичное состояние отмечено и со стороны тканей лапаротомной раны области швов. Исследованные биофизические и биохимические показатели восстанавливались.
По результатам исследования был проведен корреляционный анализ, который выявил сильную корреляционную связь (r=0,78) между выраженностью лейкоцитарной инфильтрации в тканях анастомоза области шва (по данным морфометрического исследования) и степенью интенсификации процессов оксидативного стресса (по уровню вторичных продуктов перекисного окисления липидов МДА).
Анализируя результаты лабораторно-инструментального исследования, предоставляется возможным сделать следующие выводы:
1. В отягощенных перитонитом условиях течение репаративного процесса тканей лапаротомной раны и межкишечного анастомоза замедляется.
2. Одним из факторов, снижающих темп репаративного процесса, является избыточная активность перекисного окисления липидов и фосфолипаз – мембранодестабилизирующих факторов в условиях воспаления. Это лежало в основе существенного снижения репаративного потенциала регенерирующих структурных в отягощенных условиях.
3. В активизации липопероксидации и фосфолипазных систем немаловажную роль играет значительная лейкоцитарная инфильтрация воспаленных тканей брюшины.
Библиографическая ссылка
Власов А.П., Зайцев П.П., Власов П.А., Болотских В.А., Кононенко С.В., Кренделев И.А., Гераськин В.С. РАССТРОЙСТВА ТРОФИКИ ТКАНЕЙ РЕГЕНЕРИРУЮЩИХ СТРУКТУР В ОТЯГОЩЕННЫХ УСЛОВИЯХ // Современные проблемы науки и образования. – 2017. – № 1. ;URL: https://science-education.ru/ru/article/view?id=26136 (дата обращения: 20.04.2024).



