Известно, что липопротеины могут связывать и транспортировать, в том числе и через цитоплазматическую мембрану, ксенобиотики, жирорастворимые витамины, стероидные и тиреоидные гормоны, лекарственные препараты [2]. Показано, что наиболее перспективными переносчиками являются липопротеины высокой плотности (ЛПВП) и их белковый компонент аполипопротеин А-I (апоА-I), образующий комплексы с биологически активными веществами [8; 11]. Многие клетки обладают рецепторами к апоА-I, поэтому апоА-I используют в качестве маркера при конструировании искусственных липосом для их распознавания такими клетками [9; 12]. В литературе появились работы, предполагающие, что одной транспортной ролью функции апоА-I не ограничиваются. Гимаутдиновой с сотрудниками методом малого углового рентгеновского рассеивания было показано, что апоА-I сам по себе и в комплексе с тетрагидрокортизолом (ТГК) связывается с эукариотической ДНК [1]. На коротких олигонуклеотидах было продемонстрировано, что наибольшее сродство комплекс апоА-I-ТГК имеет к олигонуклеотидам, в состав которых входит (GCC)n повторы (n=3-5). При этом в местах взаимодействия возникали однонитевые разрывы ДНК, в результате чего происходило увеличение копирования ДНК на 22-27% [10]. Основываясь на этих данных, мы предположили возможность использования апоА-I для трансфекции клеток млекопитающих плазмидными ДНК (пДНК). Поскольку почти все клетки животных, в том числе и опухолевые, имеют рецепторы к апоА-I [5; 6], комплекс апоА-I(n)-пДНК может быть поглощен этими клетками путем рецептор-обусловленного эндоцитоза. В связи с этим целью настоящего исследования явилось на моделях клеток различных линий (асцитной карциномы Эрлиха, лимфобластов U937 и клеток линии HEК 293Т) изучение возможности использования рекомбинантного и нативного аполипопротеина А-I для трансфекции плазмидными ДНК.
Материалы и методы
Выделение и очистку нативного апоА-I из плазмы крови человека проводили по методике, описанной в работе [11]. Рекомбинантный апоА-I получали из клеток продуцента, сконструированного ранее в нашей лаборатории. Клетки E.coli разрушали ультразвуком, белок из клеточного лизата выделяли с помощью аффинной хроматографии на сорбенте Ni-NTA Superflow (Qiagen, США) с последующим отщеплением лидерной последовательности, как описано в работе [3]. Качество белков анализировали в 12%-ном полиакриламидном геле в денатурирующих условиях по Леммли. Белки обессоливали общепринятым методом диализа против фосфатно-солевого буфера (ФСБ) рН 7,4-7,5 и стерилизовали фильтрованием через фильтр с размером пор 0,22 мкм Syringe-DivenFilters (JetBiofilm, Корея). Стерильные чистые белки хранили при 4 °С либо замораживали.
Спектрофотометрические измерения проводили в ЦКП «Спектрометрические измерения» на базе НИИ биохимии, г. Новосибирск. Измерение концентрации белков при λ=280 нм и концентрации ДНК при λ=260 нм проводили на спектрофотометре Evolution 300 (Thermo Scientific, США). Флуорометрические измерения конъюгата апоА-I-ФИТЦ выполняли на спектрофлуорофотометре RF-5301PC (Shimadzu, Япония).
Получение и очистка плазмидных ДНК. Плазмиды для трансфекции pTagGFP2-С (~4,7 т.п.н.) содержали ген gfp под контролем раннего промотора цитомегаловируса («Евроген», Россия). Второй вариант плазмиды являлся аналогичным и содержал рекомбинантную ДНК со слитыми генами gfp и апоА-I человека - pTagGFP2-apoA (~5,45 т.п.н.). Плазмиды нарабатывали в клетках E.coli, штамм recA- «NovaXGF» (Novagen, США) в среде LB в присутствии канамицина 30 мкг/мл. Плазмиды выделяли из клеток набором PlasmidMidiprep («Евроген», Россия) согласно инструкции. Качество плазмид и анализ фрагментов ДНК (продуктов ПЦР) осуществляли методом электрофореза в 0,8-1,2%-ном агарозном геле с последующим окрашиванием ДНК бромистым этидием.
Ампликон гена апоА-I получали с помощью ПЦР. Для ПЦР использовали набор реагентов с Taq ДНК-полимеразой («Евроген», Россия). Состав реакционной смеси использовали согласно инструкции к набору. Матрицей для ПЦР служила плазмидная ДНК pET-apoA-I, выделенная из клеток-продуцентов рекомбинантного белка апоА-I. Температура отжига праймеров первых пяти циклов составляла 58 °С, последующие циклы – 65 °С, общее количество циклов – 30. Праймеры для амплификации гена апоА-I: прямой праймер 5'-GATGATCCGCCGCAGAGC -3'; обратный праймер 5'- CTGGGTGTTCAGCTTCTTAG -3'. Объем реакционной смеси составлял 50 мкл, концентрация праймеров в реакционной смеси составляла 0,1 пмоль/мкл.
Получение конъюгата апоА-I-ФИТЦ. Конъюгат апоА-I-ФИТЦ получали путем инкубации белков с ФИТЦ в течение ночи в карбонатном буфере рН 9,5 в соотношении 12,5 мкг ФИТЦ на 1 мг белка. Конъюгат от непрореагировавшего ФИТЦ отделяли с помощью гель-фильтрации на Sephadex G 25 (1 мг белка на 10 мл смолы, высота колонки 10 см). Профиль элюции регистрировали на УФ-детекторе 2151 (LKB, Швеция) при длине волны 280 нм. Образование конъюгата в полученных хроматографических фракциях подтверждали анализом на спектрофлуорофотометре на наличие характерных для ФИТЦ пиков возбуждения (490 нм) и эмиссии (520 нм), а также в ПААГ.
Работы с культурами клеток. В качестве клеточной модели использовали опухолевые лимфобласты линии U937, клетки асцитной карциномы Эрлиха (АКЭ) и клетки линии HEК 293Т. Клеточная линия U937 была любезно предоставлена Чечушковым А.В. (НИИ экспериментальной и клинической медицины, г. Новосибирск). Клетки АКЭ были любезно предоставлены Калединым В.И. (ИЦиГ СО РАН, Новосибирск), в виде перитонеального экссудата мышей. Выделение и выращивание клеток из перитонеального экссудата мышей проводилось, как описано в работе [4]. Содержание, питание, уход за животными и выведение их из эксперимента осуществляли в соответствии с требованиями «Правил проведения работ с использованием экспериментальных животных» (приложение к Приказу МЗ СССР от 12.08.1977 № 755). Клетки линии HEK 293Т были любезно предоставлены Пыхтиной М.В. (НИИ биохимии, Новосибирск). Выращивание клеток линии U937 и HEK 293Т, а также инкубацию клеток с трансфицирующими веществами проводили в среде RPMI-1640 («Биолот», Россия), рН 7,4, содержащей 10%-ную эмбриональную сыворотку коров, 50 ед/мл пенициллина, 50 мкг/мл стрептомицина. Инкубацию проводили на 24-луночных планшетах (OrangeScientific, США) в СО2-инкубаторе (Cole-Parmer, США) в атмосфере, содержащей 5% СО2 и 95% воздуха, при температуре 37 °С. В случае инкубации клеток АКЭ, для лучшей адгезии клеток планшеты предварительно обрабатывали коллагеном (инкубировали планшеты с раствором коллагена 0,1 мг/мл в течение часа). Клетки снимали с планшетов 0,25%-ным раствором трипсина. Жизнеспособность клеток оценивали методом исключения трипанового синего (Serva, Германия), концентрацию клеток рассчитывали в камере Горяева. Музейные образцы клеток хранили в жидком азоте в среде RPMI-1640 с добавлением 40% эмбриональной сыворотки коров и 10% диметилсульфоксида.
Инкубацию клеток с комплексом апоА-I-ФИТЦ проводили после достижения конфлюентности культурой клеток в лунках на уровне 50-60%. Инкубацию клеток с трансфицирующими реагентами (комплексами пДНК-апоА-I и пДНК-Lipofectamine 2000) проводили после достижения конфлюентности культурой клеток в лунках 80-90% (~ 200 000 клеток/лунку). За основу метода трансфекции был взят протокол, прилагаемый фирмой производителем Lipofectamine 2000 (Invitrogen:LifeTechnologies, США). На одну лунку использовали 0,5 мкг ДНК и Lipofectamine 2000 в количестве 1, 2 и 4 мкл; инкубацию ДНК и Lipofectamine 2000 проводили в 50 мкл бессывороточной среды в течение 20 минут при комнатной температуре, после чего раствор добавляли в лунку планшета. В случае использования апоА-I, к 0,5 мкг ДНК добавляли разное количество апоА-I, от 0,5 до 5 мкг, смесь инкубировали в растворе ФСБ при комнатной температуре в течение 20-30 минут и добавляли в лунку планшета. На следующие сутки инкубационную среду меняли на свежую, не содержащую трансфицирующих реагентов.
Для визуального анализа флюоресценции клеток использовали инвертированный флуоресцентный микроскоп Axiovert 40 CFL (Zeiss, Германия). На вторые сутки после трансфекции клетки визуально анализировались. Уровень трансфекции оценивался как отношение количества флуоресцирующих клеток к общему количеству клеток, наблюдаемых в микроскопическом поле (не менее 20 полей для каждого образца). Результаты статистически обрабатывались и были представлены в процентах как среднее значение и ошибки среднего значения. Статистическую значимость результатов оценивали с помощью программы StatPlus 2009 (StatSoft, USA).
Результаты исследования и их обсуждение
На первом этапе работ было исследовано проникновение апоА-I в клетки. Для этого был получен конъюгат апоА-I с флуоресцирующим красителем ФИТЦ. Для получения конъюгата использовался рекомбинантный и нативный апоА-I. Исследовались концентрации конъюгата: 5, 15, 50 и 150 мкг/мл. Клетки инкубировались с конъюгатом в течение 18-20 ч, после чего клетки отмывались дважды раствором ФСБ и анализировались на инвертированном флуоресцентном микроскопе. Светящиеся клетки интерпретировались как клетки, поглотившие конъюгат. Типичный пример результата инкубации клеток линии HEK 239T и U937 с конъюгатом апоА-I-ФИТЦ представлен на рис. 1.
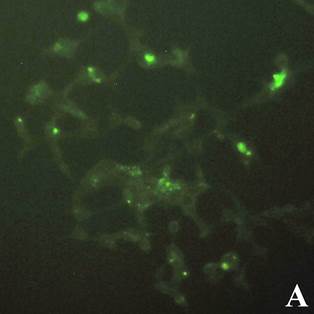
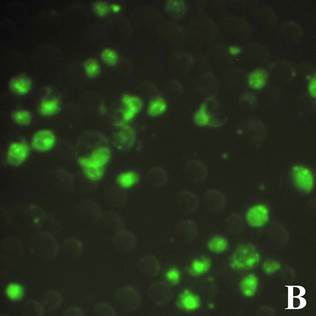
Рис. 1. Флуоресцентная микроскопия клеток линии HEK 239T (А) и U937 (В), инкубированных с конъюгатом апоА-ФИТЦ 50 мкг/мл в флуоресцентном режиме (ув. х 40)
Результаты инкубации клеток с конъюгатом показали, что наибольшее количество светящихся клеток обнаруживалось при максимальной исследуемой концентрации 50 мкг/мл и составляло примерно 1/3 часть от общего числа клеток. В контрольных клетках, инкубированных с апоА-I, подобного свечения не наблюдалось. Результаты также показывают, что количество светящихся клеток при использовании конъюгатов из нативного и рекомбинантного апоА-I было сходным и достоверных различий в образцах с исследуемыми концентрациями обнаружено не было. Это говорит о схожести биологических свойств полученного рекомбинантного апоА-I с нативным белком. Поэтому дальнейшие эксперименты проводились на рекомбинантном варианте белка.
На следующем этапе мы исследовали способность апоА-I трансфицировать клетки плазмидными ДНК. Для этого использовали плазмидные ДНК со встроенным геном зеленого флуоресцирующего белка gfp (pTagGFP2-С) и слитыми генами gfp-апоА-I (pTagGFP2-apoA). Исследовались различные соотношения пДНК и апоА-I по массе от 1:1 до 1:10. Количество пДНК составляло 0,5 мкг на ~ 200000 клеток. В качестве отрицательного контроля клетки инкубировали с пДНК в отсутствии апоА-I. В качестве положительного контроля трансфекцию проводили с теми же препаратами пДНК с Lipofectamine 2000. На следующие сутки после 24 ч инкубации проводили микроскопический анализ клеток.
В результате экспериментов наблюдались флуоресцирующие клетки, экспрессирующие гены gfp и gfp-апоА-I только с препаратом Lipofectamine 2000. Уровень трансфекции являлся низким для клеток U937 и АКЭ и составлял не более 5-10%. Максимальный уровень флуоресцирующих клеток ~ 70% был обнаружен в клетках линии HEK 293T. Низкий уровень трансфекции клеток U937 согласовался с литературными данными, где отмечается сложность данного типа клеток для трансфекции Lipofectamine-подобными препаратами [13].
Количество светящихся клеток, инкубированных с комплексами апоА-I-пДНК, не превышало 0,5%, и достоверного отличия с контрольными образцами обнаружено не было (инкубированных только с пДНК). Это говорит о том, что комплексы апоА-I-пДНК в исследованных соотношениях не проникали в клетки и/или ядра клеток. Вероятной причиной таких результатов могло быть недостаточно специфичное связывание апоА-I с пДНК для формирования стабильных комплексов или распад (диссоциация) комплексов апоА-I-пДНК в инкубационной среде.
Для проверки предположения о недостаточно специфическом связывании апоА-I с пДНК мы исследовали взаимодействие ДНК с апоА-I методом ретардации фрагментов ДНК в агарозном геле. В случае образования комплекса белок-ДНК, такие комплексы в электрическом поле задерживаются в геле (движутся медленнее) относительно свободных молекул ДНК. Данный метод используется для определения специфичности связывания различных белков с ДНК, например с гистоновыми белками [7].
В качестве ДНК использовалась плазмида, содержащая слитые гены gfp и апоА-I (pTagGFP2-apoA, ~ 5,45 т.п.н.) и ампликон гена апоА-I (~ 750 п.н.). Ампликон гена апоА-I в препаративных количествах получали методом ПЦР. Исследовались два варианта апоА-I – нативный и рекомбинантный. При анализе соотношение ДНК/белок по массе варьировалось от 1:1 до 1:100, количество ДНК на дорожку составляло ~ 100 нг. При анализе использовалась различная концентрация агарозы в геле (0,5, 1,0 и 1,5%). ДНК и белок смешивали в растворе ФСБ и инкубировали 30 мин при комнатной температуре. Затем к образцам добавляли 1/10 часть 80% глицерина и наносили в карманы геля. Пробег образцов составлял 10-12 см, напряженность электрического поля 0,8-1,0 В/см2. После окончания электрофореза ДНК окрашивали путем экспозиции геля в растворе бромистого этидия. В результате анализа мы не обнаружили отличий в подвижности исследуемых образцов ДНК с контрольными образцами, типичный пример анализа представлен на рис. 2.

Рис. 2. Электрофореграмма анализа ампликонов гена апоА-I, инкубированных с рекомбинантным белком апоА-I
Дорожки: М - маркерные фрагменты ДНК («Сибэнзим», Россия); 1 и 9 - контрольные образцы ампликонов (без апоА); 2-8 ампликоны, инкубированные с апоА-I в соотношении по массе 1:1, 1:2, 1:4, 1:8, 1:16, 1:32 и 1:64 соответственно.
По литературным данным, используемые для трансфекции гистоновые белки или их фрагменты вызывают задержку фрагментов ДНК в геле уже при массовом отношении ДНК:белок, равном 1:0,5 [7]. В наших экспериментах изменения в подвижности не были обнаружены даже при избыточном отношении белка. На основании этих результатов мы предполагаем отсутствие взаимодействия белка апоА-I как рекомбинантной, так и нативной формы с исследуемыми молекулами ДНК. Вероятно, этим и была обусловлена неспособность апоА-I трансфицировать клетки.
Выводы
На модели клеток опухолевых лимфобластов U937, АКЭ и клеток линии HEK 293T была показана способность рекомбинантного и нативного белка апоА-I, меченного ФИТЦ, проникать в клетки. На данных клеточных моделях установлено, что апоА-I неспособен трансфицировать плазмидными ДНК исследуемые клетки. На примере плазмидной ДНК и ампликона гена апоА-I методом ретардации фрагментов ДНК в геле агарозы показано отсутствие специфического взаимодействия молекул ДНК с белком апоА-I.
Библиографическая ссылка
Рябченко А.В., Котова М.В., Поляков Л.М. ИЗУЧЕНИЕ ВОЗМОЖНОСТИ ИСПОЛЬЗОВАНИЯ АПОЛИПОПРОТЕИНА А-I ДЛЯ ТРАНСФЕКЦИИ РАЗЛИЧНЫХ ЛИНИЙ КЛЕТОК ПЛАЗМИДНЫМИ ДНК // Современные проблемы науки и образования. – 2016. – № 6. ;URL: https://science-education.ru/ru/article/view?id=25881 (дата обращения: 18.04.2024).



