Муковисцидоз (МВ) – одно из наиболее частых генетически детерминированных наследственных заболеваний, развивающееся вследствие продукции экзокринными железами секрета повышенной вязкости, что вызывает вторичные изменения преимущественно в бронхолегочной, пищеварительной, репродуктивной системах. Однако определяющим в клинической картине МВ является хронический бронхолегочный процесс. Своевременная диагностика изменений в бронхо-легочной системе при МВ обеспечивает раннее начало терапии, что позволяет предупредить развитие тяжелых осложнений. Ведущим методом лучевой диагностики поражения легких при МВ является рентгенография грудной клетки. Компьютерная томография высокого разрешения (КТВР) органов грудной клетки проводится для оценки прогрессирования и тяжести поражения легких у больных [1,9]. Новые перспективные возможности в диагностике открывает ультразвуковое исследование грудной клетки. Этот метод уже широко применяется для диагностики поражения бронхолегочной системы у взрослых [7]. Существуют успешные исследования эффективности ультразвуковой диагностики у детей при пневмониях [3].
Цель. Изучить особенности поражения органов дыхания при МВ у детей в Чувашской Республике (ЧР) и оценить возможности их диагностики при помощи ультразвука.
Цель определила следующие задачи: 1. Охарактеризовать генетические особенности МВ у детей ЧР. 2. Описать клинические характеристики течения заболевания. 3. Изучить ультразвуковую семиотику поражения легких при МВ у детей.
Материалы и методы. Проанализированы данные 37 детей с МВ – 19 мальчиков (51,4 %) и 18 девочек (48,6 %) в возрасте от 11 мес. до 18 лет. Средний возраст детей составил 9,1±5,9 лет, медиана-9,4 (12,5) лет. Средний возраст постановки диагноза среди детей, находящихся под наблюдением, составил 2,9±4,4 года, медиана возраста установления диагноза – 0,9 (2,2 лет). Диагноз МВ установлен на основании результатов неонатального скрининга (при наличии), клинической картины и данных положительной потовой пробы и/или генетического исследования. Больные наблюдаются в Центре по диагностике, лечению и реабилитации больных МВ ЧР (получают стационарную и консультативную помощь), функционирующем на базе отделения пульмонологии и аллергологии БУ «Республиканская детская клиническая больница» МЗ ЧР. Для определения частоты МВ в ЧР были проанализированы данные рождаемости и диагностики МВ после всех этапов неонатального скрининга за 2006–2014 гг. Проведен ретроспективный анализ медицинской документации, включая амбулаторные карты и выписки из стационаров. Комплексное обследование включало: уровень хлоридов пота при проведении потового теста (титрование по методу Гибсона и Кука, определение проводимости на аппарате «Nanoduct», Wescor, США), молекулярно-генетическое исследование, рентгенологическое исследование органов грудной клетки, бактериологический анализ с помощью селективных сред, исследование функции внешнего дыхания (ФВД), компьютерную томографию органов грудной клетки (КТ). Молекулярно-генетические исследование проведено у 36 (97,3 %) пациентов в лаборатории ДНК_диагностики ФГБУ «Медико-генетический научный центр» РАМН (Москва). Определялась аллельная частота всех выявленных мутаций и идентифицировалась «тяжесть» генотипа: под «тяжелым» подразумевалось обязательное наличие в генотипе мутации I–III класса, под «мягким» – хотя бы 1 мутации IV–V классов. Микробиологическое исследование мокроты (мазок из зева, мокрота, орофарингеальный смыв) проведено в бактериологической лаборатории Городского центра диагностики (Чебоксары) с помощью селективных сред или в бактериологических лабораториях РДКБ и НЦЗД (Москва). Исследование ФВД выполнено 19 детям старше 5 лет (51,4 %) методом спирометрии на аппарате «Shiller SP-10» (Швейцария) по стандартной методике. КТ органов грудной клетки в спиральном режиме сканирования проведена 19 больным (51,4 %). УЗИ легких и плевральной полости проводилось на ультразвуковом сканере SonoScape S8Exp (Китай) мультичастотными линейным (6–11 МГц) и конвексным (4–11 МГц) датчиками. Изображение в виде кинопетли архивировалось на жёсткий диск прибора с последующим изучением на персональном компьютере. УЗИ выполнено 15 детям с муковисцидозом, 5 детям исследование проводилось в динамике на фоне лечения. Статистическая обработка проведена с помощью пакета прикладных программ SPSS (SPSS Inc.), Чикаго, США.
Результаты и обсуждения. В связи с тем, что средняя продолжительность жизни больных МВ в последние годы существенно возросла и болезнь все чаще приобретает хронический характер [5], помимо новых методов лечения ведутся разработки соответствующих скринирующих программ и диагностических методов, позволяющих осуществить до симптоматическую диагностику заболевания. Несомненным достижением диагностики МВ на современном этапе является внедрение в ряде стран, и в том числе России, неонатального скрининга (в ЧР с июня 2006 года). В ЧР частота встречаемости МВ по данным неонатального скрининга составила в среднем 1:7920 (охват новорожденных составляет 99,5–99,8 %).
В ЧР у детей, больных МВ, молекулярно-генетическое исследование проведено у 97,3 % пациентов, обнаружив низкую гетерогенность мутаций гена МВТР. Обнаружены следующие генотипы: E92K/E92K (27,8 %), E92K/F508del (22,2 %), F508del/F508del (13,9 %), E92K/W401X (2,8 %), E92K/N1303K (2,8 %), Е92К/CFTRdel1-11 (2,8 %), F508del/unknown (8,3 %), Е92К/unknown (8,3 %) и unknown/unknown (11,1 %). Установлено лидирующее место мутации E92K -47,2 % (замена глутаминовой кислоты на лизин в 92-й позиции белка трансмембранного регулятора МВ), в то время как доминирующая во всех этнических группах мутация F508del оставила 29,2 %. Ранее мутация Е92К определялась у достаточно ограниченного числа жителей средиземноморья и была ассоциирована с распространенностью у тюркских народов [8], но ни в одном этносе или географическом регионе мира такой высокой аллельной частоты ее до настоящего момента не выявлялось. При этом в 27,8 % случаях мутация Е92К выявлена в гомозиготном состоянии, а в 22,2 % – в гетерозиготном положении с мутацией F508del и в 16,7 % – с другими мутациями.
Кроме того, у пациентов выявлены мутации N1303K, W401X, СFTRdele1_11, cуммарная аллельная частота которых составила 4,2 %. Все мутации находились в компаундном положении с Е92К. Аллельная частота неизвестных мутаций составила 19,4 %.
Значительное доминирование E92K определило клиническую картину муковисцидоза в исследуемой группе. Как известно, клинические эффекты мутаций определяются механизмом поломки (сдвиг рамки считывания стоп-мутация, миссенс-замена), в связи с этим замена глутаминовой аминокислоты на лизин в экзоне 4, который кодирует соответствующий трансмембранный домен белка МВТР, приводит к незначительному нарушению структуры белка МВТР [2,6]. Клиничеcки это проявляется в длительном сохранении функции поджелудочной железы, изолированному поражению легких и отсутствию классической картины симметричного поражения бронхолегочной системы и желудочно-кишечного тракта. Так и среди обследованных больных преобладание «мягких» фенотипов определило относительно позднюю диагностику муковисцидоза по клиническим симптомам, у ряда пациентов диагноз верифицировали лишь в подростковом возрасте.
Поражение бронхолегочной системы наблюдается у всех пациентов с МВ. Респираторный синдром при МВ проявляется у трети больных уже в первые месяцы жизни. Ведущими синдромами поражения органов дыхания у больных муковисцидозом были бронхообструктивный, синдромы дыхательной недостаточности и локального воспаления. Средние показатели ОФВ1 составили 57,9±39,7 от должного, медиана 76,5(84,0), ФЖЕЛ 56,8±39,1, медиана 74,5 (82,0). Из респираторного тракта в 47 % патологическая флора не выявлена, в 36,1 % представлена в виде монокультуры и в 16,7 % в виде миксткультуры. В монокультуре представлен S. aureus у 7 (18,9 %) больных, P. aeruginosa у 11 (29,7 %) больных (или в ассоциацией с S. aureus) и у одного с Burkholderia cepatia (2,7 %). Вязкий бронхиальный секрет нарушает мукоцилиарный клиренс, что вызывает появление кашля с вязкой, трудно отделяемой мокротой слизисто-гнойного или гнойного характера и формирования хронического обструктивного бронхита, бронхоэктазов, пневмофиброза, эмфиземы. Раннее развитие морфологических изменений легких диктует необходимость ранних превентивных лечебных и профилактических мероприятий, стратегической целью которых является уменьшение степени выраженности инфекционно-воспалительного процесса в бронхолегочной системе. На сегодняшний день оценка поражения бронхо-легочной системы складывается из клинических симптомов, рентгенологической картины легких и, по достижении 5–6 летнего возраста, спирометрии. Известно, что признаки воспаления и инфекции в бронхо-легочной системе, нарушение проходимости дыхательных путей у пациентов с МВ, имеются уже в младенческом возрасте, тогда как болезнь может не проявляться в течение ряда лет [10]. Таким образом, отсутствие симптомов далеко не всегда является отражением благополучия в бронхолегочной системе, и своевременное выявление изменений респираторного тракта является жизненно необходимой и сложной задачей.
Рентгенография органов грудной клетки остается важным и необходимым этапом в оценке состояния легких у больных МВ. Однако этот метод лучевой диагностики мало чувствителен к ранним изменениям. Компьютерная томограмма органов грудной клетки позволяет выявлять больше структурных изменений, но использование КТ на ранней стадии болезни ограничивается проблемами радиации.
По данным проведенной КТ у обследованных детей в 100 % случае выявлен хронический бронхит, а также эмфизема (18,9 %), пневмофиброз (43,2 %), ателектазы (13,5 %), формирование бронхоэктазов (40,5 %), булл (9,1 %). 15 детям выполнено УЗИ грудной клетки, у 9 из них его результаты сопоставлены с данными КТ.
Необходимо отметить, что только у 31,6 % пациентов ЧР имелись изменения со стороны показателей ФВД, в то время как КТ-признаки поражения бронхолегочной системы имели место у всех больных. Это демонстрирует КТ как более чувствительный индикатор поражения бронхиального дерева, чем спирометрия и подтверждает раннее развитие морфологических изменений легких.
Для контроля за состоянием больного МВ, в т. ч. за новорожденными без клинических проявлений заболевания, необходимо регулярное наблюдение специалистами Центра муковисцидоза. Лечение ребенка, больного МВ, нужно начинать сразу после постановки диагноза. Объем терапии зависит от клинических проявлений и результатов лабораторных и инструментальных методов обследования.
Поиск нового радиологически безопасного метода диагностики изменений в бронхолегочной системе у пациентов с МВ, позволяющего в широкой клинической практике выявлять заболевание на ранних этапах болезни, заинтересовал специалистов нашего Центра. Такие возможности предоставляет ультразвуковая диагностика лёгких, с помощью которой нами были обследованы 15 детей с МВ.
Эхографически пневмофиброз (безвоздушная паренхима легких с учётом клинической картины трактуется как пневмофиброз) выявлен у 10 (66 %) детей, пневмония (безвоздушная паренхима легких с учётом клинической картины трактуется как воспалительная инфильтрация) – у 5 (33 %), подозрение на бронхоэктазы (расширенные бронхи с гиперэхогенным содержимым на фоне безвоздушной паренхимы легких) – у 5 (33 %), локальные интерстициальные изменения – у 4 (26 %), при этом у одного ребёнка могло определяться несколько видов патологии. У 6 (40 %) у детей с обострением заболевания наблюдался плевральный выпот. Ниже приведены результаты нашего исследования.
Детям с муковисцидозом УЗИ грудной клетки выполнялось в период обострения заболевания (5 детей) и ремиссии (10 детей). При обострении, сопровождавшемся усилением одышки и сухого кашля с затруднённым отхождением мокроты, в лёгких выявлялись участки безвоздушной лёгочной паренхимы, эхографически классифицированные нами как распространённая форма нарушения воздушности [4]. Они имели гипоэхогенную неоднородную структуру с элементами воздушной эхобронхограммы в виде радиально расходящихся к периферии линейных гиперэхогенных сигналов различной протяжённости (воздушные бронхи).
Кроме того, у 5 детей в безвоздушной зоне лоцировались трубчатые структуры неравномерного диаметра с локальными расширениями и неоднородным, преимущественно гиперэхогенным содержимым, которое незначительно толчкообразно смещалось при кашле – неравномерно расширенные бронхи с мокротой, возможно, бронхоэктазы. Подобные двусторонние изменения отмечены у 3 детей, односторонние – у 2 детей. На границе с воздушной лёгочной тканью регистрировались множественные артефакты «хвоста кометы».
В состоянии ремиссии у 7 детей были выявлены очаговые нарушения воздушности лёгочной ткани в виде очагов округлой, овальной или уплощенной формы наибольшим размером до 20 мм с однородной гипоэхогенной структурой и без элементов воздушной эхобронхограммы (рисунок). По локализации они совпадали с диагностированными при КТ очагами субплеврального пневмофиброза.
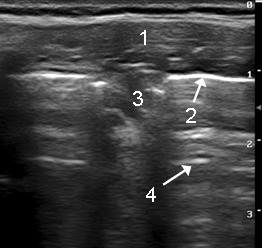
Пневмофиброз у ребенка с муковисцидозом: мягкие ткани грудной клетки (1), плевра (2), безвоздушная гипоэхогенная паренхима легких (3), реверберации (4)
Интерстициальные изменения в лёгких, соответствовавшие на томограммах симптому «матового стекла», при УЗИ регистрировались в виде неровного и несколько утолщенного гиперэхогенного сигнала от поверхности воздушного лёгкого с множественными артефактами «хвоста кометы».
Сравнительный анализ ультразвукового и рентгенологического методов обследования бронхолегочной системы у пациентов с МВ свидетельствует об информативности УЗИ легких, разработанного нашими специалистами. Использование алгоритма ультразвуковой диагностики может быть рекомендовано как в стационаре, так и при амбулаторном наблюдении пациентов, независимо от результатов рентгенографии.
Заключение:
1. Особенностью генетического профиля детей Чувашской Республики, больных муковисцидозом, является наличие малого числа мутаций со значительным преобладанием т. н. мягкой мутации E92K.
2. Клиническая и КТ-картина поражения органов дыхания имеют место у всех пациентов с муковисцидозом. При этом данные спирометрии находятся ниже предела нормальных возрастных значений только у 31,6 % больных.
3. Поражение бронхолегочной системы у детей с МВ протекает преимущественно в виде хронического гнойного обструктивного бронхита, пневмофиброза, формированием бронхоэктазов.
4. УЗИ грудной клетки является информативным радиологически безопасным дополнительным методом диагностики МВ, который следует шире использовать в клинической практике. Наряду с безопасностью, основным его преимуществом является возможность ранней диагностики изменений в бронхолегочной системе, что позволяет мониторировать течение заболевания с первых месяцев жизни ребёнка, своевременно диагностировать развитие осложнений и контролировать эффективность проводимого лечения.
Библиографическая ссылка
Голубцова О.И., Дианова Т.И., Краснов М.В., Сафонов Д.В., Красовский С.А., Егорова И.Н. СОВРЕМЕННЫЕ ВОЗМОЖНОСТИ ДИАГНОСТИКИ ПОРАЖЕНИЯ БРОНХОЛЕГОЧНОЙ СИСТЕМЫ ПРИ МУКОВИСЦИДОЗЕ У ДЕТЕЙ В ЧУВАШИИ // Современные проблемы науки и образования. – 2016. – № 3. ;URL: https://science-education.ru/ru/article/view?id=24492 (дата обращения: 16.04.2024).



