В условиях широкого внедрения приемов минимальной системы обработки почвы, а также перенасыщения севооборотов восприимчивыми сортами пшеницы наблюдается нарастание пораженности пшеницы желтой пятнистостью Pyrenophoratritici-repentis(Died). Drechs.) В 2012 г. он был выявлен на 638,5 тыс. га, или 53 % от обследованной площади, что в 10 раз превышает показатели 2005 г., в 2013 г. по состоянию на 10 мая (http://rsc26.ru) площадь заражения достигла 991,2 тыс. га (59 %); в 2014 г. – 936,7 тыс. га или 60 % от обследованной площади.
Гриб, вызывающий желтую пятнистость листьев пшеницы – Pyrenophoratritici-repentis(Died). Drechs. Слово «пиренофора» означает ядро, косточка или зернышко. Гриб первоначально был выделен из Agropyron repens в 50-х годах XIX века и описан как Pleosporatrichostoma Дидике в 1902 году. Позже он переименовал его в вид Pleosporatritici-repentis. Название Pyrenophoratritici-repentis впервые применил Дрехслер (Drechsler,1923) для описания возбудителя желтой пятнистотсти листьев на пшенице [3].
Систематическое положение: царство Fungi, отдел Ascomycota, класс Ascomycetes, подкласс Dothideomycetidae, порядок Pleosporales, семейство Pleosporaceae [21].
Желтая пятнистость или пиренофороз поражает листья, стебли и зерновки пшеницы. Первые симптомы заболевания проявляются на посевах пшеницы в фазы кущения – начало выхода в трубку (29–31 по Цадоксу) [3]. Проявляется заболевание с обеих сторон листьев и листовых влагалищ озимой пшеницы и других зерновых культур в виде мелких одиночных или многочисленных пятен овальной или округлой формы, желтой или светло-коричневой окраски диаметром от 2 до 5 мм. В центре пятна эпидермис слегка приподнят. Иногда в центре пораженного участка образуется коричневое некротическое пятно диаметром 1–2 мм. С течением времени пятна разрастаются в продольном направлении от 12 до 20 мм в длину, иногда принимают ромбовидную или чечевицеобразную форму, приобретают темно-коричневую окраску. Обычно пятна окаймлены зоной хлороза.
Пораженные листья по мере увеличения зоны поражения отмирают, начиная с верхушки. К концу вегетации на сильно разросшихся пятнах и иногда после того, как лист полностью усохнет, появляется оливково-бурый налет конидиального спороношения. На листьях растений, устойчивых к болезни, пятна разрастаются незначительно или остаются без изменений, особенно на флаг-листе.
Гриб может инфицировать колос, это приводит к обесцвечиванию чешуек и зерна. На колосковых чешуях пятна не разрастающиеся, удлиненные или в виде штрихов 2-4 х 1-2 мм. Оболочка семян становится красноватой, зерна покрыты грязновато-красными пятнами – внешне напоминает поражение фузариозом [10; 29].
На стеблях пшеницы образуются серо-коричневые и темно-бурые полоски, пятна (10х4 мм) с хлоротичной зоной [3].
Возбудитель пиренофороза способен продуцировать сильные токсины: эмодин, катенарин, исландицин [25], которые вызывают хлоротичность листьев (похожую хлоротичность наблюдают при недостатке или избытке азотных удобрений) [15]. Токсины определяют специфичность взаимодействия фитопатогена и растения-хозяина. Токсин PtrToxA индуцирует образование некрозов, PtrToxB – хлорозов вследствие ингибирования фотосинтеза, а PtrToxC – вызывает образование хлорозов, но в отличие от PtrToxB на других сортах пшеницы. Штамм гриба может иметь один, два или три токсина, на чем основывается система дифференциации рас.
На основании образования хлоротических и некротических пятен на сортах пшеницы идентифицированы четыре патотипа гриба. Первый патотип образует как некротические, так и хлоротические пятна, второй – только некрозы, третий только хлорозы, а четвертый не образует ни некрозов, ни хлорозов [28].
Частота встречаемости физиологических рас различается по годам. Л.А. Михайлова, И.Г. Тернюк и Н.В. Мироненко (2007) отмечают, что в 1990 г. большая часть популяции была представлена расой 1 (90 %), 9 % выделенных изолятов относились к расе 2, раса 4 составила менее 1 %. Раса 3 была выделена в 1994 г. только с твердой пшеницы с частотой около 3 %. Канадская популяция патогена менее вирулентна, чем популяции европейской части России, Казахстана и Финляндии. Исследователи связывают этот факт с возрастом популяции: чем «моложе» популяция, тем она более вирулентна по отношению к растению-хозяину [15]. О.С. Афанасенко (2010) отмечает, что микроэволюционные изменения в популяциях возбудителя желтой пятнистости пшеницы при заселении новых территорий происходят в направлении расширения генетического разнообразия и усиления вирулентности по сравнению с популяциями, обитающими на освоенных территориях.
Первые сообщения о распространении желтой пятнистости листьев пшеницы появились в Австралии и Северной Америке в 1970-х, а в Европе – в 1980-х годах [21; 27]. На сегодняшний день это серьезное заболевание пшеницы во многих странах [26].
В России желтая пятнистость впервые была зарегистрирована в 1985 г. на Северном Кавказе [4; 12]. С тех пор он встречается ежегодно [3]. По данным Л.Н. Шуляковской (2010), в 1991 г. зараженная пиренофорозом площадь составляла 10 % со слабым развитием в основном в северной и южной частях Краснодарского края, с 1998 г. заболевание отмечалось повсеместно с развитием 3–15 %, а на необработанных полях – до 30–40 %. В 2006–2008 гг. в Северо-Кавказском регионе отмечалось слабое развитие септориоза, но значительное поражение посевов пшеницы пиренофорозом [2, 17]. Его доля в патокомплексе в 2006 г. достигла 71 % [19]. По данным А.Г. Жуковского и др. (2012), желтая пятнистость листьев больше распространена в более теплых и влажных районах Северного Кавказа.
Изучение структуры популяции патогена показало, что наиболее вирулентными являются фенотипы пиренофороза из южной предгорной зоны, причем статистический анализ выявил большее разнообразие по фенотипическому составу южной предгорной и центральной зон [2]. Л.А. Михайлова, И.Г. Тернюк, Н.В. Мироненко (2010) обнаружили возбудителя желтой пятнистости в Дагестане, Западной Сибири, Алтае, а также Северо-Западе, где развитие болезни в 2007 г. на некоторых сортах достигло 70 %. По данным Т.С. Маркеловой (2011), за последние 10 лет ранее не характерный для данной агроклиматической зоны пиренофороз появился и заметно распространился в Поволжье. Желтая пятнистоcть является широко распространенной болезнью озимой и яровой пшеницы в южном, юго-восточном и северном регионах Казахстана, впервые заболевание было отмечено в юго-восточной части Казахстана в 1996 году с очень дождливой и прохладной весной [8].
Заболевание прогрессирует, его развитие часто достигает уровня эпифитотий, которые повторяются 3–4 раза за 10 лет. Пиренофороз является очень вредоносным заболеванием хлебных злаков. Вредоносность выражается в преждевременном усыхании листьев, щуплости зерна, уменьшении длины и озерненности колоса. Потери урожая в эпифитотийные годы могут составлять 15-30 % [20]. При оптимальных условиях развития возбудителя заболевания (высокая относительная влажность воздуха и повышенная температура), а также, если пик развития желтой пятнистости совпадает с фазой налива зерна – молочно-восковой спелости, потери зерна могут составлять 50–65 % [7], при этом ухудшается качество зерна [9].
Фитосанитарное состояние посевов озимой пшеницы связано со всеми факторами, обусловливающими формирование урожайности и обеспечивающими сохранение и повышение естественного и приобретенного иммунитета растений (повышение плодородия почвы, сбалансированное минеральное питание, внедрение устойчивых сортов и пр.) [24]. Таким образом, для разработки тактики интегрированной борьбы необходимо всестороннее биоценотическое изучение агробиоценозов, поскольку именно агробиоценология, по мнению М.С. Гилярова, «является фундаментальной биологической основой многих направлений современной сельскохозяйственной науки» [6], в том числе защиты растений.
Цель исследования – разработка методов фитосанитарной стабилизации агроценоза озимой пшеницы на основе точной диагностики, анализа динамики популяции возбудителя пиренофороза, научно обоснованного применения средств защиты растений.
Материал и методы исследования. Исследования проводили в 2013–2014 гг. на учебно-опытной станции ФГБОУ ВПО «Ставропольский государственный аграрный университет» (зона неустойчивого увлажнения). Землепользование учебно-опытной станции ФГБОУ ВПО «Ставропольский государственный аграрный университет» расположено в зоне черноземов лесостепной и степной областей (чернозем выщелоченный, глубокомицеллярно-карбонатный, среднемощный, среднегумусный, тяжелосуглинистый). Это зона умеренно-континентального климата.
Схема опыта, помимо контроля, включала два препарата на основе различных действующих веществ: ципроконазол +эпоксиконазол (160+240 г/л) и эпоксиконазол + азоксистробин (160+240 г/л).
Фитосанитарное состояние озимой пшеницы изучали в соответствии с Методическими указаниями по регистрационным испытаниям фунгицидов в сельском хозяйстве [13].
Результаты исследования и их обсуждение. В настоящее время система интегрированной защиты зерновых культур от болезней грибной этиологии, в том числе и желтой пятнистости листьев пшеницы, в качестве обязательного элемента включает в себя использование фунгицидов. Во время вегетации в основном применяют препараты группы триазолов, очень эффективно контролирующие виды ржавчины и мучнистую росу. Воздействие триазолов на возбудителей листовых пятнистостей несколько слабее. Триазолы характеризуются наличием защитного, куративного и искореняющего эффекта, что позволяет использовать их на любой стадии инфекционного процесса.
Стробилурины обладают высоким уровнем природной активности в отношении многих возбудителей болезней, однако из-за отсутствия куративного действия обработки при заражении растений недостаточно результативны. Сочетание их с азолами или морфолинами, которым свойственен куративный эффект, повышает их эффективность.
Наиболее длительный эффект на листовые болезни оказывают эпокси-, тебуко- и ципроконазольные препараты [3].
В результате учетов до начала обработки развитие пятнистостей достигало экономического порога вредоносности, равного при планируемой урожайности свыше 4 т/га 5–10 %. В течение 14 дней после обработки наблюдалось периодическое выпадение осадков, благоприятствовавшее споруляции и распространению фитопатогенов, таким образом, фунгицидная обработка была направлена, прежде всего, на сдерживание развития заболевания.
Исследования показали, что через 14 дней после обработки максимальная биологическая эффективность в отношении септориоза озимой пшеницы по показателям «распространенность» и «развитие болезни» отмечалась по препарату на основе ципроконазола и эпоксиконазола (норма расхода препарата – 0,3 л/га), соответственно, 44,4 % и 47,3 % (табл. 1).
Таблица 1
Пораженность озимой пшеницы в фазу цветения септориозом и пиренофорозом по вариантам опыта, % (2013–2014 гг.)
|
Вариант |
Септориоз |
Пиренофороз |
||
|
распростра- ненность |
развитие |
распростра- ненность |
развитие |
|
|
Контроль (без обработки) |
90,0 |
43,1 |
100,0 |
51,8 |
|
ципроконазол +эпоксиконазол (норма расхода препарата - 0,3 л/га) |
50,0 |
22,2 |
100,0 |
32,9 |
|
эпоксиконазол + азоксистробин (норма расхода препарата - 0,6 л/га) |
66,6 |
27,5 |
92,3 |
21,7 |
|
Примечание: НСР05 2013 г. |
12,4 |
8,1 |
3,4 |
8,9 |
|
НСР05 2014 г. |
16,1 |
5,6 |
- |
12,7 |
Полученные результаты можно объяснить в соответствии с имеющимися в специальной литературе данными о возрастающей устойчивости возбудителя септориоза (SeptoriatriticiBerk. &M.A. Curtis) к стробилуринам.
С другой стороны, препарат на основе азоксистробина, который ингибирует митохондриальное дыхание, приводя к старению и отмиранию мицелия, показал более высокую (в 1,6 раза) биологическую эффективность в отношении пиренофороза по показателю «развитие болезни». Биологическая эффективность изучаемых фунгицидов в отношении пиренофороза представлена на рисунке 1.
Основными образующими урожай органами являются: флаговый лист, часть стебля от флагового листа до колоса, колосовые чешуйки. В течение двух-трех недель они должны осуществить мощное производство пластических веществ и «перекачать» их в зерно [23].
Нами проанализирован уровень развития заболеваний отдельно на флаговом и первом подфлаговом листе (табл. 3). Исследования показали, что фунгицид на основе ципроконазола и эпоксиконазола (0,3 л/га) эффективно защищает флаговый лист от септориоза, однако в силу его более слабой активности в отношении возбудителя пиренофороза, данное заболевание занимает освободившуюся экологическую нишу.
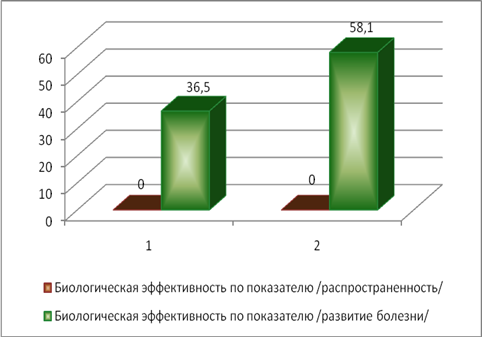
Рис.1. Биологическая эффективность фунгицидов в отношении возбудителя пиренофороза озимой пшеницы, %:
1- ципроконазол +эпоксиконазол (норма расхода препарата - 0,3 л/га);
2 - эпоксиконазол + азоксистробин (норма расхода препарата - 0,6 л/га)
Таблица 3
Пораженность листовых ярусов озимой пшеницы в фазу цветения септориозом и пиренофорозом по вариантам опыта, % (среднее за 2013–2014 гг.)
|
Вариант |
Септориоз |
Пиренофороз |
||
|
распростра- ненность |
развитие |
распростра- ненность |
развитие |
|
|
флаговый лист |
||||
|
Контроль (без обработки) |
80,0 |
33,1 |
100,0 |
41,8 |
|
ципроконазол +эпоксиконазол (норма расхода препарата - 0,3 л/га) |
15,0 |
3,8 |
100,0 |
33,7 |
|
эпоксиконазол + азоксистробин (норма расхода препарата - 0,6 л/га) |
40,0 |
10,0 |
100,0 |
25,0 |
|
подфлаговый лист |
||||
|
Контроль (без обработки) |
100,0 |
53,1 |
100,0 |
61,8 |
|
ципроконазол +эпоксиконазол (норма расхода препарата - 0,3 л/га) |
75,0 |
38,8 |
100,0 |
33,8 |
|
эпоксиконазол + азоксистробин (норма расхода препарата - 0,6 л/га) |
85,0 |
38,8 |
75,0 |
16,3 |
При обработке фунгицидом эпоксиконазол + азоксистробин (0,6 л/га) отмечена эффективная защита первого подфлагового листа, в первую очередь, от пиренофорозной инфекции.
Через 28 дней после обработки учет заболеваний на флаговом листе показал следующую пораженность растений фитопатогенами (табл. 4).
Таблица 4
Пораженность озимой пшеницы в фазу молочной спелости септориозом и пиренофорозом по вариантам опыта, % (2013–2014 гг.)
|
Вариант |
Септориоз |
Пиренофороз |
||
|
распростра- ненность |
развитие |
распростра- ненность |
развитие |
|
|
Контроль (без обработки) |
100,0 |
63,1 |
100,0 |
54,1 |
|
ципроконазол +эпоксиконазол (норма расхода препарата - 0,3 л/га) |
100,0 |
41,6 |
100,0 |
36,9 |
|
эпоксиконазол + азоксистробин (норма расхода препарата - 0,6 л/га) |
100,0 |
68,7 |
100,0 |
25,0 |
|
Примечание: НСР05 2013 г. |
- |
11,7 |
- |
11,2 |
|
НСР05 2014 г. |
- |
9,8 |
- |
9,4 |
При обработке фунгицидом ципроконазол + эпоксиконазол (0,3 л/га) отмечалось поражение стеблей пиренофорозом. Распространенность данной формы заболевания составила 30 %. Более того, по данному варианту отмечено единичное поражение фузариозом колоса.
Дополнительная прибавка по варианту эпоксиконазол + азоксистробин (0,6 л/га) в сравнении с применением фунгицида на основе ципроконазола и эпоксиконазола (0,3 л/га), составившая 0,2 т/га, может объясняться теми фактами, что фунгицид на основе эпоксиконазола и азоксистробина в течение 14 дней после обработки обеспечивал более эффективную защиту подфлагового листа от пиренофороза (в 2,1 раза по показателю развитие болезни) и, соответственно, увеличил продолжительность ассимиляционных процессов. Более того, азоксистробин, как одно из действующих веществ фунгицида, оказывает регулирующее действие на закрытия устьиц. В результате в условиях недостатка влаги, который отмечался в июне 2014 г. во время налива зерна, улучшался процесс ассимиляции СО2, снижалась интенсивность дыхания, что позволило повысить устойчивость растения к неблагоприятным факторам, повысило эффективность использования воды.
Выводы. Через 14 дней после обработки максимальная биологическая эффективность в отношении септориоза озимой пшеницы по показателям «распространенность» и «развитие болезни» отмечалась по препарату на основе ципроконазола и эпоксиконазола (норма расхода препарата – 0,3 л/га), соответственно, 44,4 % и 47,3 %. препарат на основе азоксистробина, который ингибирует митохондриальное дыхание, приводя к старению и отмиранию мицелия, показал более высокую (в 1,6 раза) биологическую эффективность в отношении пиренофороза по показателю «развитие болезни».
Фунгицид на основе ципроконазола и эпоксиконазола (0,3 л/га) эффективно защищает флаговый лист от септориоза, однако в силу его более слабой активности в отношении возбудителя пиренофороза, данное заболевание занимает освободившуюся экологическую нишу. Таким образом, распространенность заболевания на верхнем листовом ярусе достигает 100 % при развитии заболевания 33,7 %.
Биологическая эффективность фунгицидов в плане защиты первого подфлагового листа от септориоза составила 10–15 % по показателю «распространенность» и 27,0 % по показателю «развитие болезни». Освободившуюся от септориозной инфекции экологическую нишу на первом подфлаговом листе при обработке фунгицидом на основе ципроконазола и эпоксиконазола (0,3 л/га) занял пиренофороз, против возбудителя которого данный вариант опыта показал меньшую эффективность.
При обработке фунгицидом эпоксиконазол + азоксистробин (0,6 л/га) отмечена эффективная защита первого подфлагового листа, в первую очередь, от пиренофорозной инфекции.
При обработке фунгицидом ципроконазол + эпоксиконазол (0,3 л/га) отмечалось поражение стеблей пиренофорозом. Распространенность данной формы заболевания составила 30 %.
Дополнительная прибавка по варианту эпоксиконазол + азоксистробин (0,6 л/га) составила 0,3 т/га, что на 0,2 т/га больше, чем при применении фунгицида на основе ципроконазола и эпоксиконазола (0,3 л/га).
Рецензенты:
Власова О.И., д.с.-х.н., доцент, заведующая кафедрой общего и мелиоративного земледелия ФГБОУ ВПО «Ставропольский государственный аграрный университет», г. Ставрополь;
Войсковой А.И., д.с.-х.н., профессор, заведующий кафедрой растениеводства и селекции имени профессора Ф.И. Бобрышева ФГБОУ ВПО «Ставропольский государственный аграрный университет», г. Ставрополь.
Библиографическая ссылка
Защепкин Е.Е., Шутко А.П., Тутуржанс Л.В. ЖЕЛТАЯ ПЯТНИСТОСТЬ КАК СОСТАВНАЯ ЧАСТЬ ПАТОГЕННОГО КОМПЛЕКСА ОЗИМОЙ ПШЕНИЦЫ В ЦЕНТРАЛЬНОМ ПРЕДКАВКАЗЬЕ // Современные проблемы науки и образования. – 2015. – № 2-2. ;URL: https://science-education.ru/ru/article/view?id=22326 (дата обращения: 19.04.2024).



