В более ранних исследованиях, посвященных изучению взаимосвязи структура–активность производных 1,3-диазинона-4, было выявлено, что соединения данного ряда обладают выраженными противовоспалительными свойствами [3, 4]. В связи с этим мы сочли целесообразным продолжить исследования в направлении поиска новых эффективных нестероидных противовоспалительных соединений среди 2-стирил- и 2-виниленгетерилпроизводных 1Н-пиримидин-4-она [2, 5].
Материалы и методы
Программа PASS (Prediction of activity spectra for substances) использовалась с целью выявления перечня наиболее вероятных фармакологических свойств, характерных для прогнозируемых молекул. С помощью программы HyperChem 8 производилась оптимизация геометрии трехмерных виртуальных структур. Молекулярный докинг осуществлялся при помощи программы Molegro Virtual Docker 5.5 trial. Структура фермента циклооксигеназа-2 была получена из банка данных протеинов. Синтез осуществлялся по следующей методике: исходный 4-(2,6-диметил-4-оксо-5-фенил-4Н-пиримидин-1-ил)-бензсульфамид растворяют в 4 мл диметилформамида при нагревании и добавляют эквимолярное количество соответствующего альдегида, растворенного в 1 мл этанола. Реакционную смесь нагревают, добавляя порциями этанол до 5 мл, после чего кипятят в течение 1,5-3 часов и отгоняют 3-4 мл смеси растворителей. Затем реакционную массу выливают на лед, отфильтровывают и промывают большим количеством воды. Очистку от примесей осуществляют перекристаллизацией из этанола. Подтверждение строения синтезированных соединений осуществлялось методами 1Н ЯМР и ИК-спектроскопии. Спектры 1Н-ЯМР регистрировали в DMSO-D6, на приборе Brucker-300Mhz при 20°C., в качестве внутреннего стандарта использовали – ГМДС. Положение сигналов определялось по шкале ![]() , в м.д., с указанием интенсивности и мультиплетности. Спектры поглощения ИК регистрировали на спектрометре ФСМ 1201 в области от 4000 до 400 см-1, образцы исследовались в виде суспензий в вазелиновом масле. Используемые реактивы соответствовали маркам «Ч.Д.А.» и «Х.Ч.».
, в м.д., с указанием интенсивности и мультиплетности. Спектры поглощения ИК регистрировали на спектрометре ФСМ 1201 в области от 4000 до 400 см-1, образцы исследовались в виде суспензий в вазелиновом масле. Используемые реактивы соответствовали маркам «Ч.Д.А.» и «Х.Ч.».
Результаты и обсуждение
С целью достижения структурной близости прогнозируемых соединений с высокоселективными НПВС группы коксибов в качестве исходного соединения было выбрано производное 1Н-пиримидин-4-она, содержащее сульфаниламидный фрагмент [6]. Для сформированного ряда исследуемых структур был проанализирован спектр возможных фармакологических свойств при помощи программы PASS [7]. Результаты в виде вероятности проявления возможных видов биологической активности в долях единицы представлены в таблице 1.
Таблица 1
Прогноз биологической активности 2-винилензамещенных производных
4-(2,6-диметил-4-оксо-5-фенил-4H-пиримидин-1-ил)-бензсульфамида
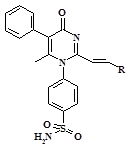
|
Вид биологической активности |
Заместитель |
Соединение |
|||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
||
|
R |
|
|
|
|
|
|
|
|
|
|
Pa характеризует вероятность проявления активности |
|||||||||
|
D4-агонист |
0,881 |
0,832 |
0,825 |
0,826 |
0,851 |
0,819 |
0,834 |
0,899 |
|
|
Антипротозойная |
0,820 |
0,764 |
0,738 |
0,753 |
0,766 |
0,674 |
0,772 |
0,719 |
|
|
Ингибитор ЦОГ |
0,741 |
0,735 |
0,682 |
0,736 |
0,764 |
0,691 |
0,592 |
0,662 |
|
|
Нейропротекторная |
0,562 |
0,563 |
0,548 |
0,562 |
0,579 |
0,489 |
0,516 |
0,554 |
|
|
Антиартритная |
0,503 |
0,496 |
0,469 |
0,492 |
0,557 |
0,414 |
0,429 |
0,514 |
|
Из таблицы 2 видно, что для всех соединений помимо других возможных фармакологических свойств прогнозируется высокая вероятность ингибирования циклооксигеназы, которая составляет от 0,592 до 0,764. Это может свидетельствовать о целесообразности дальнейшего поиска новых противовоспалительных соединений в данном ряду. Наиболее перспективным по данным программы PASS является соединение 5, содержащее в структуре п-фторфенильный радикал.
Следующий этап молекулярного конструирования заключался определении сродства прогнозируемых виртуальных молекул к сайту связывания фермента циклооксигеназа-2 методом молекулярного докинга [9]. Геометрия молекул лигандов была предварительно оптимизирована с помощью программы HyperChem 8 методом молекулярной механики. Оценка результатов проводилась по минимальной энергии образования комплекса. В процессе докинга исследовались параметры взаимодействия 200 конформаций каждого лиганда и учитывалась подвижность наиболее значимых аминокислот активного центра фермента. Энергии наиболее устойчивых комплексов лиганд-ЦОГ-2 приведены в таблице 2.
Таблица 2
Результаты молекулярного докинга
|
Лиганд |
Минимальная энергия образования комплекса |
|
1 |
-25.56 |
|
2 |
-58.37 |
|
3 |
-137.34 |
|
4 |
-147.93 |
|
5 |
-106.85 |
|
6 |
-138.77 |
|
7 |
-24.64 |
|
8 |
-65.86 |
|
Диклофенак |
-100.33 |
По данным прогноза наиболее прочный комплекс с ЦОГ-2 образуют соединения 3, 4, 5 и 6. Структуры 1, 7 и 8 характеризуются более слабым связыванием с биологической мишенью. Большинство лигандов вступает во взаимодействие со следующими аминокислотными фрагментами активного центра циклооксигеназы-2: Arg 120, His 90, Glu 524, Phe 518, Pro 528, Ser 530, Ser 353, Tyr 355, Tyr 385, Val 89 и Val 349. Связывание молекул с аминокислотными фрагментами Ser 530 и Tyr 385 является характерной особенностью НПВС, содержащих в структуре сульфаниламидный фрагмент [8].
Синтез соединений осуществлялся путем взаимодействия 4-(2,6-диметил-4-оксо-5-фенил-4Н-пиримидин-1-ил)-бензсульфамида с ароматическими и гетероциклическими альдегидами в среде этанола и диметилформамида по схеме 1.
Схема 1
Синтез 2-винилензамещенных производных
4-(2,6-диметил-4-оксо-5-фенил-4Н-пиримидин-1-ил)-бензсульфамида
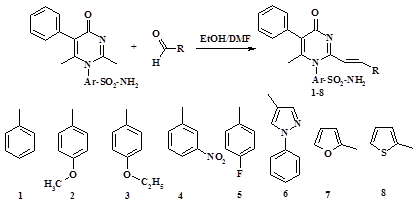
Наибольший выход целевого продукта достигается при использовании в качестве компонентов синтеза гетероциклических альдегидов (соединения 6, 7 и 8). Для синтезированных соединений были определены основные физико-химические характеристики. Структура веществ подтверждена методами ИК- и 1H ЯМР спектроскопии [1].
4-(6-Метил-4-оксо-5-фенил-2-стирил-4H-пиримидин-1-ил)-бензсульфамид (1)
Выход 56,0%. Вещество представляет собой серый с желтоватым оттенком кристаллический порошок. Тпл = 318-320°С.
1Н ЯМР спектр (ДМСО-d6), ![]() , м.д.: 1,67 (c, 3H, CH3); 2,25 (c, 3H, CH3); 6,36 (д, 1H,CH); 7,02-7,13 (м, 3Н, Ar); 7,17-7,22 (т, 2H, Ar); 7,39-7,61 (м, 6H, Ar); 7,71-7,78 (д, 2H, Ar); 8,19 (д, 1H, CH) 8,54 (с, 2Н, NH2).
, м.д.: 1,67 (c, 3H, CH3); 2,25 (c, 3H, CH3); 6,36 (д, 1H,CH); 7,02-7,13 (м, 3Н, Ar); 7,17-7,22 (т, 2H, Ar); 7,39-7,61 (м, 6H, Ar); 7,71-7,78 (д, 2H, Ar); 8,19 (д, 1H, CH) 8,54 (с, 2Н, NH2).
4-{2-[2-(4-Метоксифенил)-винил]-6-метил-4-оксо-5-фенил-4H-пиримидин-1-ил}-бензсульфамид (2)
Выход 55,0%. Вещество представляет собой желтоватый мелкокристаллический порошок. Тпл = 312-314°С.
1Н ЯМР спектр (ДМСО-d6), ![]() , м.д.: 1,69 (c, 3H, CH3); 2,23 (c, 3H, CH3); 6,36 (д, 1H,CH); 6,97-7,02 (м, 2H, Ar); 7,19-7,31(м, 4Н, Ar); 7,42-7,57 (м, 5H, Ar); 7,72-7,77 (д, 2H, Ar); 8,19 (д, 1H, CH); 8,53 (с, 2Н, NH2).
, м.д.: 1,69 (c, 3H, CH3); 2,23 (c, 3H, CH3); 6,36 (д, 1H,CH); 6,97-7,02 (м, 2H, Ar); 7,19-7,31(м, 4Н, Ar); 7,42-7,57 (м, 5H, Ar); 7,72-7,77 (д, 2H, Ar); 8,19 (д, 1H, CH); 8,53 (с, 2Н, NH2).
4-{2-[2-(4-Этоксифенил)-винил]-6-метил-4-оксо-5-фенил-4H-пиримидин-1-ил}-бензсульфамид (3)
Выход 58,0%. Вещество представляет собой желтоватый мелкокристаллический порошок. Тпл = 253-255°С.
1Н ЯМР спектр (ДМСО-d6), ![]() , м.д.: 1,42-1,46 (т, 3H, CH3); 2,12 (c, 3H, CH3); 4,31-4,38 (к. 2Н, СН2); 6,36 (д, 1H,CH); 6,99-7,03 (д, 2Н, Ar); 7,19-7,41 (к, 4H, Ar); 7,42-7,56 (м, 5H, Ar); 7,73-7,76 (д, 2H, Ar); 8,18 (д, 1H, CH); 8,48 (с, 2Н, NH2).
, м.д.: 1,42-1,46 (т, 3H, CH3); 2,12 (c, 3H, CH3); 4,31-4,38 (к. 2Н, СН2); 6,36 (д, 1H,CH); 6,99-7,03 (д, 2Н, Ar); 7,19-7,41 (к, 4H, Ar); 7,42-7,56 (м, 5H, Ar); 7,73-7,76 (д, 2H, Ar); 8,18 (д, 1H, CH); 8,48 (с, 2Н, NH2).
4-(6-Метил-2-{2-[3-нитрофенил]-винил}-4-оксо-5-фенил-4H-пиримидин-1-ил)-бензсульфамид (4)
Выход 65,0%. Вещество представляет собой желтоватый мелкокристаллический порошок. Тпл = 280-282°С.
1Н ЯМР спектр (ДМСО-d6), ![]() , м.д.: 1,67 (с, 3H, CH3); 6,34-6,40 (д. 1H, СН); 7,19-7,23 (т, 2Н, Ar); 7,43-7,57 (м, 5H, Ar); 7,74 (д, 2H, Ar); 8,19 (д, 1H, CH); 8,39-8,49 (м, 2H, Ar); 8,52 (с, 2Н, NH2); 8,91 (с, 1Н, Ar); 8,95-8,98 (д, 1Н, Ar).
, м.д.: 1,67 (с, 3H, CH3); 6,34-6,40 (д. 1H, СН); 7,19-7,23 (т, 2Н, Ar); 7,43-7,57 (м, 5H, Ar); 7,74 (д, 2H, Ar); 8,19 (д, 1H, CH); 8,39-8,49 (м, 2H, Ar); 8,52 (с, 2Н, NH2); 8,91 (с, 1Н, Ar); 8,95-8,98 (д, 1Н, Ar).
4-{2-[2-(4-Фторфенил)-винил]-6-метил-4-оксо-5-фенил-4H-пиримидин-1-ил}-бензсульфамид (5)
Выход 67,0%. Вещество представляет собой белый с желтоватым оттенком мелкокристаллический порошок. Тпл = 316-318°С.
1Н ЯМР спектр (ДМСО-d6), ![]() , м.д.: 1,71 (с, 3H, CH3); 6,32-6,37 (д. 1H, СН); 7,15-7,32 (м, 6Н, Ar); 7,41-7,56 (м, 5H, Ar); 7,73-7,76 (д, 2H, Ar); 8,20 (д, 1H, CH); 8,53 (с, 2Н, NH2).
, м.д.: 1,71 (с, 3H, CH3); 6,32-6,37 (д. 1H, СН); 7,15-7,32 (м, 6Н, Ar); 7,41-7,56 (м, 5H, Ar); 7,73-7,76 (д, 2H, Ar); 8,20 (д, 1H, CH); 8,53 (с, 2Н, NH2).
4-{6-Метил-4-оксо-5-фенил-2-[2-(1-фенил-1H-пиразол-4-ил)-винил]-4H-пиримидин-1-ил}-бензсульфамид (6)
Выход 80,0%. Вещество представляет собой желтоватый с серым оттенком мелкокристаллический порошок. Тпл = 334-336°С.
1Н ЯМР спектр (ДМСО-d6), ![]() , м.д.: 1,67 (с, 3H, CH3); 6,67-6,7 (т. 2Н, Ar); 6,97-7,02 (д, 1H, CH); 7,18-7,23 (т. 2Н, Ar); 7,28-7,33 (т. 2Н, Ar); 7,38-7,59 (м. 6Н, Ar); 7,64-7,67 (д. 2Н, Ar); 7,73-7,76 (д. 2Н, Ar); 8,21 (д, 1H, CH); 8,52 (с, 2Н, NH2).
, м.д.: 1,67 (с, 3H, CH3); 6,67-6,7 (т. 2Н, Ar); 6,97-7,02 (д, 1H, CH); 7,18-7,23 (т. 2Н, Ar); 7,28-7,33 (т. 2Н, Ar); 7,38-7,59 (м. 6Н, Ar); 7,64-7,67 (д. 2Н, Ar); 7,73-7,76 (д. 2Н, Ar); 8,21 (д, 1H, CH); 8,52 (с, 2Н, NH2).
4-[2-(2-Фуран-2-ил-винил)-6-метил-4-оксо-5-фенил-4H-пиримидин-1-ил]-бензсульфамид (7)
Выход 82,0%. Вещество представляет собой желтоватый с серым оттенком мелкокристаллический порошок. Тпл = 238-240°С.
1Н ЯМР спектр (ДМСО-d6), ![]() , м.д.: 1,72 (с, 3H, CH3); 5,85-5,87 (т. 1Н, Ar); 6,15-6,19 (м. 1Н, Ar); 6,97-7,02 (д, 1H, CH); 7,10 (с. 1Н, Ar); 7,18-7,23 (т. 2Н, Ar); 7,40-7,57 (м. 5Н, Ar); 7,72-7,77 (д. 2Н, Ar); 8,21 (д, 1H, CH); 8,52 (с, 2Н, NH2).
, м.д.: 1,72 (с, 3H, CH3); 5,85-5,87 (т. 1Н, Ar); 6,15-6,19 (м. 1Н, Ar); 6,97-7,02 (д, 1H, CH); 7,10 (с. 1Н, Ar); 7,18-7,23 (т. 2Н, Ar); 7,40-7,57 (м. 5Н, Ar); 7,72-7,77 (д. 2Н, Ar); 8,21 (д, 1H, CH); 8,52 (с, 2Н, NH2).
4-[6-Метил-4-оксо-5-фенил-2-(2-тиофен-2-ил-винил)-4H-пиримидин-1-ил]-бензсульфамид (8)
Выход 86,0%. Вещество представляет собой желтоватый мелкокристаллический порошок. Тпл = 204-206°С.
1Н ЯМР спектр (ДМСО-d6), ![]() , м.д.: 1,72 (с, 3H, CH3); 6,22-6,25 (м. 1Н, Ar); 6,59-6,62 (т. 1Н, Ar); 6,81 (д. 1Н, Ar); 7,18-7,23 (т. 2Н, Ar); 7,29-7,34 (д, 1H, CH); 7,41-7,72 (м. 5Н, Ar); 7,74-7,76 (д. 2Н, Ar); 8,23 (д, 1H, CH); 8,53 (с, 2Н, NH2).
, м.д.: 1,72 (с, 3H, CH3); 6,22-6,25 (м. 1Н, Ar); 6,59-6,62 (т. 1Н, Ar); 6,81 (д. 1Н, Ar); 7,18-7,23 (т. 2Н, Ar); 7,29-7,34 (д, 1H, CH); 7,41-7,72 (м. 5Н, Ar); 7,74-7,76 (д. 2Н, Ar); 8,23 (д, 1H, CH); 8,53 (с, 2Н, NH2).
Выводы
Синтезировано восемь новых 2-винилензамещенных производных 4-(2,6-диметил-4-оксо-5-фенил-4Н-пиримидин-1-ил)-бензсульфамида, которые по данным молекулярного конструирования должны проявлять противовоспалительную активность. Структуры полученных соединений были подтверждены спектральными методами анализа. Далее планируется проведение скрининговых фармакологических исследований синтезированных веществ и анализ взаимосвязи структура-противовоспалительная активность в данном ряду.
Рецензенты:
Оганесян Э.Т., д.фарм.н., профессор, заведующий кафедрой органической химии, Пятигорский медико-фармацевтический институт, филиал ГБОУ ВПО ВолгГМУ Минздрава России, г. Пятигорск;
Попова О.И., д.фарм.н., профессор кафедры фармакогнозии, Пятигорский медико-фармацевтический институт – филиал ГБОУ ВПО ВолгГМУ Минздрава России, г. Пятигорск.
Библиографическая ссылка
Сочнев В.С., Кодониди И.П., Бандура А.Ф., Смирнова Л.П., Ивченко А.В., Шатохин С.С., Филимонов Ю.Д., Кодониди М.И. МОЛЕКУЛЯРНОЕ КОНСТРУИРОВАНИЕ И СИНТЕЗ НОВЫХ 2-ВИНИЛЕНЗАМЕЩЕННЫХ ПРОИЗВОДНЫХ 1Н-ПИРИМИДИН-4-ОНА С ПРОГНОЗИРУЕМОЙ ПРОТИВОВОСПАЛИТЕЛЬНОЙ АКТИВНОСТЬЮ // Современные проблемы науки и образования. – 2015. – № 2-2. ;URL: https://science-education.ru/ru/article/view?id=22091 (дата обращения: 19.04.2024).