Мелатонин является универсальным регулятором биологических ритмов живых организмов, выступает посредником между пейсмейкерным механизмом супрахиазматических ядер гипоталамуса и периферическими органами [3]. У гормона выявлены разнообразные функции как иммуномодулятора [8], сильного антиоксиданта [6], онкопротектора [10], снотворного [5], адаптогена [1].
Известно, что содержание животных в условиях нарушенного светового режима оказывает значительное влияние на иммунный статус, что связано с изменением синтеза мелатонина в эпифизе [2]. Т-лимфоциты несут на себе рецепторы к мелатонину [9], ввиду чего активно реагируют на него. Для оценки состояния тимопоэза на ранних и поздних его стадиях в работе были использованы CD1a и CD3 маркеры.
Целью исследования является изучение количественной реакции CD1a- и CD3-позитивных клеток тимуса при введении мелатонина в различных световых условиях.
Материал и методы исследования
Объектом гистологического исследования служил тимус 160 половозрелых белых мышей-самцов 2-месячного возраста. Животные были распределены на 8 групп: 1-я контрольная (n = 20) – животные, которые содержались в обычных условиях вивария (естественное освещение, свободный доступ к воде и корму) в течение 2 недель; 1-я опытная (n = 20) – животные получали мелатонин (препарат мелаксен, Unipharm, USA) с водой в дозе 4 мг/л постоянно в течение 2 недель и находились в условиях обычного освещения; 2-я – контрольная (n = 20) – животные, которые содержались в условиях постоянного затемнения в течение 2 недель; 2-я опытная (n = 20) – животные находились в условиях постоянного затемнения в течение 2 недель и получали мелатонин с водой постоянно в дозе 4 мг/л; 3-я контрольная (n = 20) – животные находились в условиях обычного освещения и получали питьевую воду в течение 4 недель; 3-я опытная (n = 20) – животные находились в условиях обычного освещения и получали мелатонин в дозе 4 мг/л с водой постоянно в течение 4 недель; 4-я контрольная (n = 20) – животные находились в условиях постоянного затемнения в течение 4 недель; 4-я опытная (n = 20) – животные получали мелатонин постоянно в дозе 4 мг/л с водой и находились в условиях затемнения.
Все действия, предусматривавшие контакт с экспериментальными животными, осуществлялись согласно «Правилам проведения работ с использованием экспериментальных животных» и в соответствии с «Европейской конвенцией о защите позвоночных животных, использованных для экспериментов и в иных научных целях»,
В работе применялись следующие методы:
1) иммуногистохимический метод выявления CD1а- и CD3-позитивных клеток с помощью моноклональных антител фирмы Santa Cruz (USA).
Тимус извлекался после декапитации. Материал для исследования помещали в 10%-ный забуференный формалин и далее заливали в парафин. Парафиновые срезы толщиной 5 мкм были нанесены на высокоадгезивные стекла и подвергались сушке при комнатной температуре в течение 24 ч. Окраска препаратов происходила с помощью иммуногистохимических автоконтейнеров AUTOSTAINER-360 (THERMO, Великобритания) и Leica BOND-MAX (Германия);
2) морфометрический анализ проводился с помощью программы Image J;
3) статистическая обработка полученных результатов проводилась с использованием программы SPSS Statistics 17.0 (2008).
Результаты исследования и их обсуждение
При обработке гистологических срезов тимуса мышей контрольных и опытных групп CD1а-позитивные клетки располагаются в корковом веществе долек непосредственно под капсулой органа. CD1а-позитивные клетки имеют округлую и овальную формы, мембраны их окрашиваются в коричневый цвет. Клетки, не несущие данный маркер, окрашены в сине-голубой цвет.
Данные, полученные в ходе изучения CD1а-позитивных клеток в корковом веществе тимуса, демонстрируют, что ни световые условия, ни введение мелатонина не вызывают статистически значимых изменений количественных показателей кортикальных тимоцитов (рис. 1). Так, среднее число клеток в поле зрения (при увеличении 1000) составляет при содержании животных в обычных условиях освещения 47,46±2,74 и 46,68±2,54 клеток в поле зрения у контрольных, 46,80±1,60 и 51,60±2,09 клеток в поле зрения у опытных мышей (2 и 4 недели эксперимента соответственно), в условиях постоянного затемнения – 41,50±1,97 и 40,16±2,49 клеток в поле зрения у контрольных, 43,20±2,36 и 44,30±2,47 клеток в поле зрения у опытных мышей (2-я и 4-я недели эксперимента соответственно).
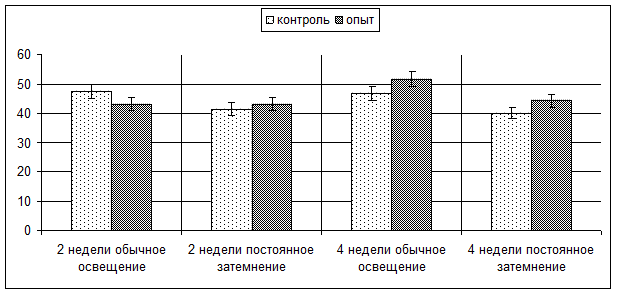
Рис. 1. Количество CD1а-позитивных клеток в корковом веществе долек тимуса мышей опытных и контрольных групп
CD1а – мембранный маркер кортикальных тимоцитов, необходим для развития Т-лимфоцитов, отсутствует на зрелых Т-клетках [7]. Ввиду этого CD1а-позитивные клетки являются незрелыми, и можно сделать вывод, что введение мелатонина в условиях обычного освещения и искусственного затемнения не оказывает влияния на дифференцировку клеток на ранней стадии развития тимоцитов.
CD3-позитивные клетки выявляются по всему срезу тимуса контрольных и опытных мышей с более плотным расположением в корковом веществе. Клетки имеют округлую и овальную формы, мембраны их окрашены в коричневый цвет.
Так, в корковом веществе дольки тимуса введение мелатонина в течение 2 недель в условиях обычного освещения приводит к снижению количества CD3-позитивных клеток с 548,06±11,79 до 415,02±9,24 (p < 0,001) в поле зрения, в условиях постоянного затемнения – с 516,12±8,20 до 426,96±13,07 (p < 0,001) в поле зрения (рис. 2). Более значительное снижение количества CD3-позитивных клеток наблюдается в корковом веществе дольки тимуса мышей, получавших мелатонин в течение 4 недель в условиях обычного освещения – в 1,7 (p < 0,001) и в условиях постоянного затемнения – в 1,6 раза (p < 0,001).
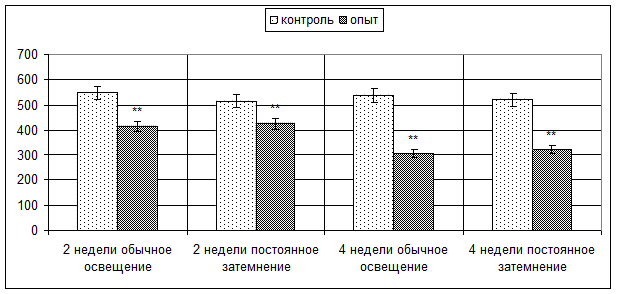
Рис. 2. Количество CD3-позитивных клеток в корковом веществе долек тимуса мышей опытных и контрольных групп. ** – p < 0,001
Окраска препаратов тимуса экспериментальных мышей антителами к CD3 маркеру демонстрирует статистически значимое снижение количества CD3-позитивных клеток в мозговом веществе долек, степень выраженности которого напрямую зависит от длительности введения гормона (рис. 3). Так, в условиях обычного освещения введение мелатонина в течение 2 недель приводит к снижению числа CD3-позитивных клеток в поле зрения с 414,18±10,20 до 357,30±6,49 (p < 0,001), а на 4-й неделе введения гормона более значительно – с 421,36±9,81 до 254,82±9,63 (p < 0,001) клеток в поле зрения. Схожая картина наблюдается при введении мелатонина в условиях постоянного затемнения, где на 2-й неделе введения гормона число клеток в поле зрения постепенно снижается с 390,12±8,16 до 334,40±8,26 (p < 0,001), а на 4-й неделе – с 403,30±12,38 до 237,20±6,49 (p < 0,001) клеток в поле зрения.
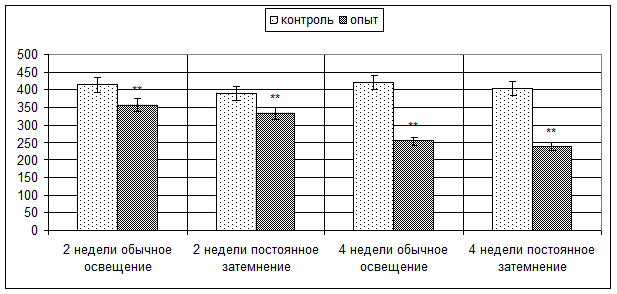
Рис. 3. Количество CD3-позитивных клеток в мозговом веществе долек тимуса мышей опытных и контрольных групп. ** – p < 0,001
На границе коркового и мозгового вещества окраска срезов тимуса к маркеру CD3 также демонстрирует снижение количества исследуемых клеток, выраженность которого зависит от длительности поступления гормона в организм мышей (рис. 4). Так, количество CD3-позитивных клеток в поле зрения снижается при поступлении мелатонина в обычных условиях освещения в течение 2 недель с 166,20±2,78 до 128,16±3,10 (p < 0,001), а в течение 4 недель – с 158,72±2,13 до 110,72±2,78 (p < 0,001), при поступлении гормона в условиях постоянного затемнения в течение 2 недель – с 149,02±4,29 до 132,76±4,17 (p < 0,05), в течение 4 недель – с 152,32±2,86 до 107,76±2,52 (p < 0,001).
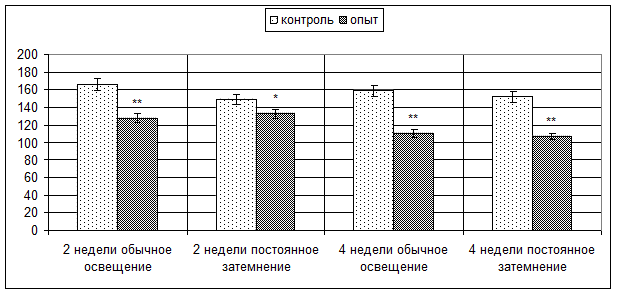
Рис. 4. Количество CD3-позитивных клеток на границе коркового и мозгового вещества долек тимуса мышей опытных и контрольных групп. * – p < 0,05, ** – p < 0,001
Так как CD3 антиген является высокоспецифичным маркером зрелых Т-лимфоцитов [4], то можно заключить, что снижение плотности расположения CD3-позитивных клеток в дольке тимуса мышей после введения мелатонина в течение 2 и 4 недель в условиях различного освещения может быть связано с усиленной миграцией зрелых клеток из тимуса или стимуляцией их апоптоза.
Выводы
1. Введение мелатонина в течение 2 и 4 недель в условиях обычного освещения и постоянного затемнения не вызывает статистически достоверных изменений количественных показателей CD1а-позитивных клеток в корковом веществе дольки тимуса экспериментальных животных.
2. Постоянное введение мелатонина экспериментальным мышам приводит к снижению количества CD3-позитивных клеток в корковом и мозговом веществе, а также на границе коркового и мозгового вещества долек тимуса, и эти изменения более выражены при поступлении гормона в течение 4 недель и не зависят от условий освещения.
Рецензенты:
Воронов Л.Н., д. б. н., профессор, заведующий кафедрой биологии и методики преподавания ФГБОУ ВПО «Чувашский государственный педагогический университет имени И.Я. Яковлева», г. Чебоксары;
Денисова Т.Г., д. м. н., профессор АУ ЧР «Институт усовершенствования врачей» МЗСР ЧР, г. Чебоксары.
Библиографическая ссылка
Шатских О.А., Лузикова Е.М., Сергеева В.Е. РЕАКЦИЯ CD1A – И CD3-ПОЗИТИВНЫХ КЛЕТОК ТИМУСА ПРИ ВВЕДЕНИИ МЕЛАТОНИНА В РАЗЛИЧНЫХ СВЕТОВЫХ УСЛОВИЯХ // Современные проблемы науки и образования. – 2015. – № 5. ;URL: https://science-education.ru/ru/article/view?id=21615 (дата обращения: 25.04.2024).



