В настоящее время остается актуальным вопрос поиска новых штаммов бактерий рода Lactobacillus для создания современных пробиотических препаратов и продуктов функционального питания, что обусловлено широчайшим спектром полезных свойств этих микроорганизмов. Однако использование новых штаммов лактобацилл в биотехнологии для производства пробиотиков становится возможным лишь после детального изучения их биологических свойств и корректной идентификации, что регламентируется соответствующими нормативными документами - МУ 2.3.2.2789-10 и МУК 4.2.2602-10 [4; 5].
Ранее основой для видовой идентификации лактобацилл было изучение их биохимических свойств, в частности способность ферментировать углеводы, что, если принять во внимание вариабельность этих свойств, нередко может приводить к неточности при идентификации, особенно при работе с близкородственными микроорганизмами. В современных методических документах рекомендуется использовать молекулярно-генетические методы, в частности секвенирование фрагментов гена 16S рРНК. Этот метод позволяет проводить точную видовую идентификацию, но не отражает штаммовые особенности микроорганизмов. Широкие возможности и перспективы для изучения штаммовых характеристик открывает метод MALDI TOF масс-спектрометрии, который позволяет не только идентифицировать микрооганизм, но и в ряде случаев получать уникальный набор рибосомальных белков (фингерпринт) для каждого из исследуемых штаммов.
Кроме точной видовой идентификации промышленно перспективных штаммов лактобацилл, обязательным является изучение их биологических свойств, в частности подробная характеристика их биохимического профиля и антагонистической активности.
Антагонистические свойства молочнокислых бактерий обусловлены продукцией органических кислот (молочной, уксусной), перекиси водорода и образованием субстанций, схожих с антибиотиками [9; 10]. Особую значимость изучение антагонистических свойств лактобацилл, а именно их межштаммовых взаимодействий приобретает в свете внедрения в технологические производственные циклы метода совместного культивирования, который является экономически выгодным и перспективным при создании пробиотиков и продуктов функционального питания на основе нескольких штаммов лактобацилл.
Этот вопрос неоднократно поднимался в отечественных и зарубежных исследованиях. Имеются данные об успешном совместном культивировании двух видов рода Lactobacillus. Установлено, что L. salivarius и L. plantarum имеют близкие физиологические показатели роста и совместное их выращивание дает соотношение клеток в стационарной фазе 60% к 40% [2]. Перспективными в отношении этого технологического подхода можно считать штаммы лактобацилл, которые обладают выраженным антагонизмом к патогенным и условно патогенным микроорганизмам и средним уровнем антагонизма к другим штаммам этого же рода [3].
Существует несколько подходов к изучению антагонизма микроорганизмов: in vivo при использовании гнотобиологической технологии, а также in vitro, методами отсроченного антагонизма и совместного культивирования [7]. Среди методов выявления антагонизма in vitro наибольшее распространение получил метод отсроченного антагонизма на плотной питательной среде, основанный на раздельном, последовательном культивировании испытуемых и индикаторных микроорганизмов. Недостатками метода являются: большой расход питательных сред, длительность и трудоемкость исследования, раздельное последовательное культивирование испытуемого и индикаторного микроорганизмов, в результате чего можно определить только чувствительность индикаторной культуры к продуктам метаболизма испытуемого штамма, выращенного первым. Следовательно, метод отсроченного антагонизма позволяет обнаружить только продуцируемые экзаметаболиты, подавляющие развитие других бактерий, и не выявляет конкурентной борьбы, которая происходит при их совместном культивировании. В этом случае не в полной мере выявляются конкурентные взаимоотношения, которые могли бы проявиться при совместном выращивании. Нами был использован метод прямого совместного культивирования испытуемого и индикаторного штаммов на плотной питательной среде, предложенный Н.А. Глушановой [1], так как этот метод представляется наиболее информативным в нашем случае. Подобный метод и его модификация (на полужидкой питательной среде) рекомендован и в нормативных документах для определения способности пробиотических штаммов ингибировать представителей нормофлоры кишечника и выявления штаммов антагонистов при конструировании комплексных препаратов [4; 5].
Цель исследования: уточнить таксономическое положение отдельных штаммов рода Lactobacillus, изучить их биохимические свойства, установить тип их межштаммовых взаимоотношений и выделить группу штаммов, перспективных для совместного культивирования.
Материалы и методы исследования: в работе использовали 13 штаммов бактерий рода Lactobacillus, выделенных из кишечника здоровых людей и находящихся на хранении в Государственной коллекции лактобацилл ФБУН «ННИИЭМ им. академика И.Н. Блохиной» Роспотребнадзора: L. plantarum 8 RA-3, L. plantarum 30, L. plantarum 1862, L. fermentum 39, L. fermentum 90 ТC-4, L. casei 577, L. casei 583, L. paracasei ssp. paracasei 6, L. delbrueckii 76, L. acidophilus 1660, L. rhamnosus 1790, L. rhamnosus 7, L. rhamnosus 526.
Для восстановления и рассева штаммов после вскрытия ампулы лиофильную массу заливали 1 мл среды МРС-1 (Lactobacillus MRS broth, HiMedia), переносили в стерильную пробирку и инкубировали при 37 °С 24 часа (I генерация штамма). На вторые сутки 0,5 мл I генерации пересевали на МРС-1 и инкубировали при 37 °С 24 часа (II генерация штамма).
Далее II генерацию штамма раститровывали на стерильном физиологическом растворе (рН 7,0), с разведений 10-4,10-5,10-6,10-7 проводили высевы по 0,05 мл на плотную среду МРС-4 (Lactobacillus MRS agar, HiMedia) и инкубировали 48 часов при 37 °С в анаэробных условиях с использованием газогенерирующих пакетов GasPak Anaerobe Gas Generating Pouch System with Indicator, США.
Выросшие колонии микроорганизмов наносили на 3 ячейки-мишени для последующей масс-спектрометрии и остаток засевали в МРС-1 для последующего изучения биохимического профиля.
Масс-спектрометрический анализ осуществляли с помощью времяпролетного MALDI масс-спектрометра Autoflex (Bruker Daltonics, Германия), оснащенного модифицированным твердотельным лазером. Все измерения проводили в линейном режиме, детектируя положительные ионы. Внешнюю калибровку проводили с помощью бактериального тест-стандарта (Bruker Daltonics, Германия), в качестве матрицы использовали α-циано-4-гидрокси-коричную кислоту (α-CHCA).
Пробоподготовка суточных культур исследуемых микроорганизмов проводилась методом прямого нанесения по стандартному протоколу, представленному в руководстве пользователя, идентификация, запись, обработка и анализ масс-спектров проводилась с помощью программы BioTyper RTC. О достоверности идентификации судили по значению коэффициента совпадения (Score values) - 2,000 – 3,000 – идентификация до вида, 1,999-1,700 – идентификация до рода, 1,699 – 0 – идентификация не прошла) и значению категорий – А – достоверная идентификация до вида, В - достоверная идентификация до рода, С – недостоверный результат.
Для постановки ПЦР гена 16S рРНК геномную ДНК выделяли методом нуклеосорбции с использованием набора «ДНК-сорб В» (ЦНИИЭ Роспотребнадзора, г. Москва), использовали стандартные реагенты производства ЦНИИЭ Роспотребнадзора и специфические праймеры: FL 3' -gag ttt gat cct ggc tca gga- 5', RL 3' - cga cga cca tga acc acc tgt -5' [8]. Праймеры синтезированы ЗАО «Синтол», Москва. ПЦР проводили на приборе «Терцик-МС2» («ДНК-технология», Москва).
Электрофорез продуктов амплификации выполняли в 1,5%-ном агарозном геле, содержащем 5 мкг/мл бромида этидия, в течение 40 мин при 100 V на гель в трис-боратном буферном растворе. Очистку амплифицированного фрагмента от агарозного геля для последующего секвенирования проводили с помощью набора для очистки ДНК (ООО «Цитокин», Санкт-Петербург).
Секвенирование наработанных фрагментов гена 16S рРНК выполняли с использованием секвенатора GenomeLabTM GeXP (Beckman Coulter). Полученные сиквенсы анализировали в программе BLAST (www.blast.ncbi.nlm.nih.gov/Blast.cgi) и MEGA (www.megasoftware.com).
Расширенное изучение биохимических свойств штаммов было проведено с использованием стрипов API 50 CHL (Biomerueux, Франция) согласно инструкции производителя.
Исследование биосовместимости лактобацилл проводили методом совместного культивирования на плотной питательной среде МРС-4. Суточную культуру, выращенную на жидкой питательной среде и стандартизированную по стандарту мутности, наносили на поверхность плотной питательной среды бактериологической петлей диаметром 3 мм. После впитывания капли, отступив 1-2 мм от ее края, на поверхность той же среды наносили в том же объеме каплю другой испытуемой культуры, которая, растекаясь, примерно наполовину покрывала первую каплю.
В наложенной части культуры развиваются при взаимном присутствии (совместное культивирование), конкурируя друг с другом. После подсыхания второй капли чашки с посевами переворачивали вверх дном и инкубировали при 37 °С с использованием газогенерирующих пакетов GasPak Anaerobe Gas Generating Pouch System with Indicator, США. Каждый опыт ставили в двух повторах, меняя положения культур (с целью исключения влияния последовательности наслоения капель культур на характер роста в зоне совместного культивирования). Контролем служили капли одной и той же культуры, наслоенные друг на друга по описанной выше методике.
Учет результатов проводили через 24 и 48 часов после начала инкубации. При задержке роста одной из исследуемых культур взаимоотношения между ними рассматривались как антагонистические, а сами культуры относили в категорию бионесовместимых. Культуры считали биосовместимыми в случае обнаружения полного «слияния» пятен или усиления роста исследуемых штаммов в зоне совместного культивирования (мутуализм, синергизм, сателлизм). Если одна из культур в зоне совместного культивирования «выходит наверх», подавляя рост второй культуры, независимо от последовательности их нанесения, такой вариант расценивали как слабый антагонизм.
Наличие выраженной зоны угнетения (задержки роста) одной культуры по периферии пятна другой испытуемой культуры расценивали как признак сильного антагонизма (рис. 1). Опыт проводили в троекратной повторности.
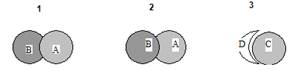
Рис. 1. Примеры проявления антагонизма испытуемых микроорганизмов при совместном культивировании на плотной среде: 1 – культура А проявляет антагонизм в отношении культуры В; 2 – культура В проявляет антагонизм в отношении культуры А; 3 – культура С проявляет резкий антагонизм в отношении культуры D
Результаты исследования и их обсуждение
В ходе идентификации с использованием метода MALDI TOF масс-спектрометрии получены индивидуальные масс-спектры для каждого исследуемого штамма лактобацилл, типичные масс-спектры представлены на рис. 2.
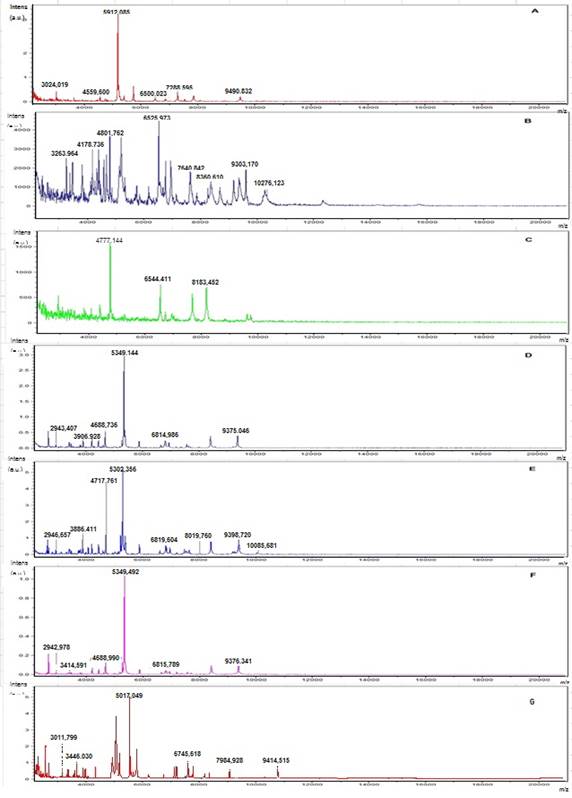
Рис. 2. Масс-спектры бактерий рода Lactobacillus, включенных в исследование, полученные с использованием α-CHCA -матрицы (A – L. plantarum 8 RA-3, B – L. acidophilus 1660, C – L. delbrueckii ssp. lactis 76, D – L.casei 577, E – L. paraсasei ssp. paracasei 6, F – L. rhamnosus 7, G – L. fermentum 90 TC-4)
Хотя снятие масс-спектров осуществляли в диапазоне 2000-20000 m/z, визуально наиболее информативным является участок от 2000 до 10000 m/z. Все культуры были идентифицированы с использованием программно-аппаратного комплекса MALDI BioTyper, при этом значения Score values составили от 1,922 до 2,217 (категория А), что говорит о высокой степени достоверности полученных результатов. В ходе исследований подтвердилось таксономическое положение всех культур, кроме того, положение штамма L. delbrueckii 76 было уточнено и этот штамм идентифицирован как L. delbrueckii ssp. lactis.
Таксономический статус исследованных штаммов также был подтвержден с использованием секвенирования фрагмента гена 16S рРНК: совпадение нуклеотидных последовательностей указанной детерминанты штаммов с наиболее близкими референсными последовательностями из GenBank составило 98-100%, результаты идентификации этим методом совпали с результатами MALDI масс-спектрометрии (рис. 3).
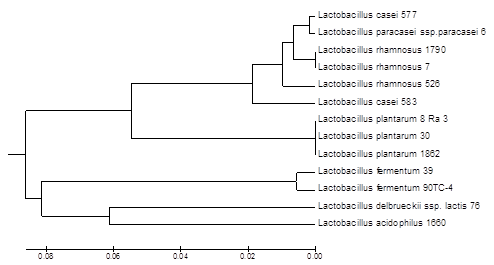
Рис. 3. Дендрограмма, построенная на основании анализа последовательности фрагмента гена 16S рРНК исследуемых штаммов лактобацилл с использованием алгоритма UPGMA
При изучении биохимических профилей с использованием тест-системы API 50CHL была проанализирована биохимическая активность штаммов с использованием набора из 49 субстратов.
Установлено, что штаммы видов L. plantarum, L. fermentum, L. casei, L. paracasei и L. rhamnosus утилизируют наибольшее число субстратов, включая моносахара – гексозы (галактоза, фруктоза, манноза и др.), пентозы (арабиноза, рибоза), дисахариды (целлобиоза, мальтоза и др.), гликозиды (арбутин, амигдалин), глюкозиды (эскулин, салицин), сульфатированные олигосахариды (метил-α-D-маннопиранозид) и многоатомные спирты (сорбит, маннит).
Отличительной особенностью штаммов L. plantarum и L. paracasei является способность к утилизации мелецитозы, «отличительной меткой» штамма L. fermentum 39 - способность к гидролизу ацетилглюкозамина, арбутина и глюконата калия.
Штаммы L. delbrueckii ssp. lactis 76 и L. acidophilus 1660 утилизируют 12 субстратов, включая гексозы, N-ацетилглюкозамин, глюкозиды (салицин) и дисахариды. Штаммы вида L. rhamnosus утилизировали пентозы, гексозы, многоатомные спирты, сульфатированные олигосахариды (метил-α-D-маннопиранозид) и дисахариды.
Полученные данные также позволили подтвердить таксономический статус изученных штаммов. Необходимо отметить, что при анализе биохимической активности исследованные штаммы разделились по признаку утилизации сахаров. Это объясняется тем, что микроорганизмы относятся к двум разным биохимическим группам: виды L. delbrueckii, L. acidophilus относятся к группе гомоферментативных лактобацилл, а виды L. plantarum, L. fermentum, L. casei, L. paracasei, L. rhamnosus – к группе факультативно-гетероферментативных лактобацилл. Метаболизм сахаров у представителей этих групп принципиально отличается: в первом случае генетически детерминирован гликолитический путь, во втором – пентозофосфатный. Гомоферментативные лактобациллы неспособны сбраживать пентозы, а гетероферментативные микроорганизмы обладают двумя путями метаболизма сахаров, при этом сбраживание гексоз происходит по гликолитическому пути, а пентоз – по окислительному пентозофосфатному. При достаточном количестве гексоз их сбраживание идет по гликолитическому пути, а при снижении количества гексоз наличие в питательной среде пентоз индуцирует синтез фосфокетолазы.
По результатам изучения межштаммовых взаимоотношений исследуемые штаммы были разделены нами на три условные группы: штаммы с сильной антагонистической активностью, штаммы – слабые антагонисты и штаммы со средней антагонистической активностью.
К группе штаммов с сильной антагонистической активностью нами были отнесены штаммы L. plantarum 30, L. delbrueckii ssp. lactis 76 и L. rhamnosus 1790. Указанные микроорганизмы подавляют по семь (L. plantarum 30) и восемь штаммов (L. delbrueckii 76 и L. rhamnosus 1790). Высокий уровень антагонизма этих бактерий по отношению к представителям этого же рода ограничивает их применение при реализации принципа совместного культивирования как при периодическом, так и при непрерывное способе. Наиболее слабые антагонистические свойства проявил штамм L. casei 577. В ходе опыта развитие этого штамма подавлялось семью другими штаммами. Использование в составе комплексных заквасок данного штамма нецелесообразно, так как низкая устойчивость к действию бактериоцинов родственных бактерий приведет к скорой гибели этого микроорганизма.
К группе со средней антагонистической активностью нами были отнесены следующие штаммы: L. plantarum 8 RA-3, L. fermentum 39, L. fermentum 90 ТC-4, L. casei 583, L. acidophilus 1660. Все эти микроорганизмы биосовместимы с большим количеством штаммов и являются антагонистами небольшого количества штаммов (1-3 штамма).
Взаимоотношения бактерий этой группы относятся к синергидным, т.е. имеет место один из вариантов полезных межбактериальных взаимодействий: мутуализм, комменсализм или нейтрализм.
Лактобактерии, относящиеся к видам L. fermentum и L. Delbrueckii, ранее не привлекали внимание исследователей в направлении исследования способности к сосуществованию, биосовместимость этих микроорганизмов с другими видами с помощью методики совместного культивирования на плотной питательной среде была изучена нами впервые.
Данные о межштаммовых взаимоотношениях микроорганизмов, полученные нами, позволили выделить группу бактерий рода Lactobacillus, наиболее перспективных в отношении совместного культивирования. Наибольший интерес из изученной группы лактобактерий представляют штаммы L. plantarum 8 RA-3 и L. fermentum 39. Эти микроорганизмы обладают выраженным антагонизмом по отношению к условно-патогенным микроорганизмам и устойчивостью к спектру антибактериальных средств, недетерминированной плазмидами [6]. Высокая степень биосовместимости этих штаммов, установленная нами впервые в описанном опыте, определила целесообразность их использования для совместного культивирования в составе мультиштаммовых пробиотиков.
Рецензенты:
Смирнов В.Ф., д.б.н., профессор кафедры физиологии и биохимии человека и животных ФГАОУ ВО «Нижегородский государственный университет им. Н.И. Лобачевского», г. Нижний Новгород;
Заславская М.И., д.б.н., профессор кафедры микробиологии и иммунологии ГБОУ ВПО «Нижегородская государственная медицинская академия» Министерства здравоохранения России, г. Нижний Новгород.
Библиографическая ссылка
Точилина А.Г., Белова И.В., Соловьева И.В., Новикова Н.А., Иванова Т.П., Жирнов В.А. ИЗУЧЕНИЕ БИОЛОГИЧЕСКИХ СВОЙСТВ ШТАММОВ РОДА LACTOBACILLUS // Современные проблемы науки и образования. – 2015. – № 5. ;URL: https://science-education.ru/ru/article/view?id=21579 (дата обращения: 19.04.2024).



