Фторированные соединения используются в качестве агрохимикатов, лекарственных препаратов. Фторсодержащие компоненты являются ингибиторами ферментов и модификаторами межклеточных коммуникаций, они способны также к нарушению мембранного транспорта и процессов преобразования энергии.
Благодаря своеобразию свойствперфторкарбоновых кислот и возможности широко использовать их для научных и промышленных целей, они служат объектом интенсивных исследований и в настоящее время являются хорошо изученной группой веществ.
Перфторкарбоновые кислоты – синтетические химические соединения, применяемые в производстве широко используемых фторполимеров. Они также являются поверхностно-активными веществами, обладают высокой химической стабильностью, что делает их идеальными материалами для широкого применения (например, антипригарное покрытие для посуды, влаго- и пятностойкие покрытия для текстиля, смазки, упаковка пищевых продуктов, противопожарная пена и т. д.). Будучи крайне устойчивыми к биоразложению, перфторкислоты к настоящему времени обнаруживаются во многих объектах окружающей среды и живых организмах. Например, перфтороктановая кислота является наиболее часто детектируемым загрязнителем этого класса [9, 10]. Исследования показывают, что перфторкарбоновые кислоты очень медленно выводятся из организма человека – от 2 лет до 21 года, практически не подвергаются метаболизму и накапливаются в организме (в основном в почках и печени) [5]. Также они влияют на репродуктивную и эндокринную системы [6, 7], доказаны их канцерогенные свойства [5].
Перфторкарбоновые кислоты внесены в Приложение В Стокгольмской конвенции по стойким органическим загрязняющим (СОЗ) веществам, что предусматривает принятие мер по минимизации и, по возможности, прекращению производства и использования. И в свою очередь более остро встает проблема утилизации этих экологически опасных поллютантов неприродного происхождения со всеми вытекающими последствиями по их включению в естественный обмен веществ и энергии с участием микроорганизмов, которые минерализуют их, не оказывая отрицательного влияния на окружающую среду. Поэтому целью данной работы являлось выделение и характеристика перспективных бактерий для деструкции стойких органических загрязнителей –перфторкарбоновых кислот на примере перфторэнантовой кислоты (рис. 1).
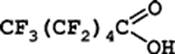
Рис. 1. Перфторэнантовая (перфторгексановая) кислота
Материалы и методы исследования
Выделение штаммов-деструкторов перфторорганических кислот производили из образцов почв с территории промышленных предприятий (Республики Башкортостан), а также образов грунта, отобранных около мест хранения средств тушения пожаров (Мальдивская Республика). Для получения микроорганизмов методом накопительных культур 1 г почвы помещали в колбы (объем 250 мл) со 100 мл жидкой минеральной среды Раймонда [8] (г/л): Na2CO3 – 0,1; MgSo4 × 7 H20 – 0,2; FeSo4 × 7 H2O – 0,02 ; CaCl2 – 0,01; MnSo4 × 7 H2O – 0,02; K2HPO4 × 3 H2O – 1,0; NaH2PO4 × 3 H2O – 1,5; NH4Cl – 3 [13]. В качестве единственного источника углерода и энергии вносили стерильную перфторэнантовую (перфторгексановую) кислоту в количестве 0,1 % (по объему). Культивирование проводили в статических условиях при температуре 28ºС в течение 7 суток при периодическом встряхивании. Бактериальные штаммы выделяли из накопительных культур на агаризованной минеральной среде Раймонда без пептона, на поверхность которой наносили углеводородный субстрат – 100 мкл стерильной перфторэнантовой кислоты. Культивирование микроорганизмов в чашках Петри осуществляли при температуре 28 ºС. Изолирование получившихся колоний микроорганизмов проводили по морфолого-физиологическим признакам.
Чистоту выделенных культур проверяли общепринятыми методами – микроскопическим контролем и высевом на агаризованную среду МПА [4].
Характеризацию чистых культур микроорганизмов – деструкторов фторорганических соединений проводили по морфологическим, физиологическим и биохимическим признакам, используя общепринятые руководства [2, 3].
Культивирование штаммов проводили в колбах со 100 мл питательной среды Раймонда без пептона, в которую инокулировали 1 мл бактериальной суспензии. В качестве источника углерода и энергии добавляли перфторэнатовую кислоту в количестве 0,2 г. Инкубирование осуществляли в стационарных условиях при температуре 28 ºС в течение 5 недель, на протяжении которых несколько раз измеряли титр микроорганизмов и динамику изменения фторид-иона (F-) в среде.
Способность к деструкции оценивали по способности роста в жидкой среде с единственным источником углерода в виде фторкарбоновой кислоты. Каждую колбу инокулировали бактериальной суспензией до начальной оптической плотности (ОП) при 450 нм в кювете с длиной оптического пути 10 мм около 0,02. Определение оптической плотности бактериальных суспензий проводили на спектрофотометре модели СФ-56 (Россия). Инкубирование осуществляли при температуре 28 ºС в течение 5 недель, на протяжении которых несколько раз измеряли оптическую плотность бактериальной суспензии.
Концентрацию фторид-иона в среде измеряли при помощи ионселективного кристаллического электрода ЭЛИС-131F (ООО «Измерительная техника», Россия).
Результаты и их обсуждение
В ходе проведенной работы из исследованных образцов методом накопительных культур было выделено 9 бактериальных штаммов, способных использовать перфторэнантовую кислоту в жидкой среде в качестве единственного источника углерода и энергии (маркировка М у штаммов, выделенных из образцов из Мальдивской Республики, цифровая – Республики Башкортостан).
Установлено, что среди выделенных штаммов были как грамположительные, так и грамотрицательные микроорганизмы. Все изоляты аэробные, каталазоположительные, оксидазоположительные, растущие в интервале температур 10–35 °С.
Все новые выделенные бактерии-деструкторы были способны к нитратредукции, использовали в качестве источника углерода широкий спектр органических веществ (таблица).
Признаки штаммов штаммов-деструкторов перфторэнантовой кислоты
|
Свойства |
1.1 |
1.2 |
1.3.2 |
2.4 |
М1 |
М2 |
М3 |
М4 |
|
Образование индола |
+ |
+ |
+ |
+ |
+ |
- |
- |
- |
|
Рост на среде Эшби |
- |
- |
- |
- |
- |
- |
- |
- |
|
Гидролиз крахмала |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
Разжижение желатина |
+ |
+ |
- |
- |
+ |
+ |
+ |
+ |
|
Каталазная активность |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
Образование сероводорода |
- |
- |
- |
- |
- |
+ |
- |
+ |
|
Образование аммиака из аргинина |
- |
- |
- |
+ |
- |
- |
+ |
- |
|
Реакция Фогес-Проскауэра |
- |
- |
- |
- |
- |
- |
- |
- |
|
Лецитиназа |
+ |
+ |
- |
+ |
- |
+ |
+ |
+ |
|
Ассимиляция субстратов |
||||||||
|
Сахароза |
+ |
+ |
- |
- |
+ |
+ |
- |
- |
|
Глюкоза |
+ |
+ |
+ |
- |
+ |
+ |
- |
+ |
|
Глицерин |
+ |
+ |
- |
- |
+ |
+ |
- |
+ |
|
Галактоза |
- |
- |
- |
- |
+ |
- |
- |
+ |
|
Рамноза |
- |
+ |
- |
- |
+ |
- |
- |
+ |
|
Мальтоза |
+ |
- |
+ |
- |
+ |
+ |
- |
+ |
|
Фруктоза |
+ |
+ |
- |
- |
+ |
+ |
- |
+ |
|
Ксилоза |
+ |
+ |
- |
- |
+ |
+ |
- |
+ |
Таким образом, изолированные штаммы-деструкторы по результатам предварительной идентификации являлись представителями классов Alphaproteobacteria(порядок Rhizobiales), Gammaproteobacteria, Actinbacteria. Работа по уточнению родовой и видовой принадлежноститребует привлечения генетических методов и филогенетического анализа.
Далее было показано (рис. 2), что ОП культуральных жидкостей растущих бактериальных культур находились в интервале 0,2–0,4 о.е. Максимальный уровень роста показывали штаммы М1, 1.3.02, 2.4 и 2.1, причем штамм 2.4 был описан еще и в качестве деструктора хлорорганических соединений [1], в частности 2,4 – дихлорфеноксиуксусной кислоты (2,4-Д), являющейся основой для ряда гербицидов. Максимумы ОП культуральных жидкостей наблюдали на седьмые сутки культивирования, после которых увеличения концентрации биомассы и ОП при 450 нм не наблюдалось, но не наблюдалось и ее снижения, что, возможно, свидетельствует о накоплении промежуточных продуктов.
Анализ данных по высвобождению ионов фтора в среду (рис. 3) показал, что перфторкарбоновые кислоты, судя по всему, очень тяжело подвергаются биодеструкции, с этим, вероятно, также связан долгий период адаптации Изучаемых культур микроорганизмов к субстрату, который в наших условиях составил 7 суток.
В среду было внесено 0,2 % субстрата в виде пефторгексановой кислоты, т.е. 6,4 mM, а с учетом, что она состоит из фтора на 66,6 %, следует, что в среду вносили 4,2 mM фтора. По выходу свободных фторид – ионов в среду в результате деструктирующего воздействия микроорганизмов на перфторкислоту была определена степень биодеструкции этой кислоты. Для лучших штаммов ее величина составила более 30 % и находилась на уровне для следующих штаммов: 1.3.02 – 63,8%, 2.4 – 42,6%, 1.2 – 41,4 %, М1 – 30,0 %, остальных – менее 20%.
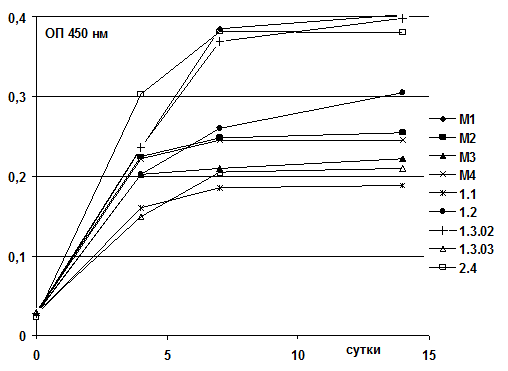
Рис. 2. Динамика роста штаммов-деструкторов в жидкой минеральной среде, содержащей перфторэнантовую кислоту
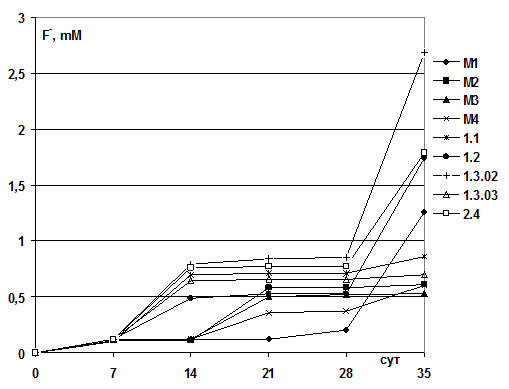
Рис. 3. Динамика изменения концентрации фторид-иона в жидкой минеральной среде, содержащей перфторэнантовую кислоту, при росте штаммов-дестркуторов
Заключение
Основываясь на полученных результатах, можно утверждать, что выделенные бактерии – деструкторы перфторэнантовой кислоты, имея большой деградативныйпотенциал, способны к росту и утилизации фторорганических субстратов и являются перспективными для создания биологических препаратов – деструкторов стойких органических загрязнителей – перфторорганических кислот.
Рецензенты:Горбунова В.Ю., д.б.н., заместитель заведующего кафедры генетики, ФГБОУ ВПО «Башкирский государственный педагогический университет им. М. Акмуллы»,г. Уфа;
Чемерис А.В., д.б.н., заместитель директора по научной работе, ФГБУН Институт биохимии и генетики Уфимского научного центра Российской академии наук, лаборатория молекулярной биологии и нанобиотехнологии, г. Уфа.
Библиографическая ссылка
Шарипов Д.А., Юлгутлина Э.В., Четвериков С.П. ПЕРСПЕКТИВНЫЕ БАКТЕРИИ ДЛЯ ДЕСТРУКЦИИ СТОЙКИХ ОРГАНИЧЕСКИХ ЗАГРЯЗНИТЕЛЕЙ – ПЕРФТОРКАРБОНОВЫХ КИСЛОТ // Современные проблемы науки и образования. – 2015. – № 3. ;URL: https://science-education.ru/ru/article/view?id=20027 (дата обращения: 25.04.2024).



