В последнее время большое внимание привлекают синтетические возможности новых электрофильных реагентов, дихлорида и дибромида селена [1-10], которые являются более селективными по сравнению с использующимися ранее тетрагалогенидами селена [10]. Например, реакции дихлорида и дибромида селена с ацетиленом протекают как стереоселективное анти-присоединение с образованием Е,Е-бис(2-галогенвинил)селенидов с выходами, близкими к количественным, в то время как присоединение к ацетилену тетрагалогенидов селена приводит, наряду с Е,Е-бис(2-галогенвинил)селенидами, к продуктам их галогенирования по одной двойной связи [10].
Присоединение дигалогенидов селена к двойной связи в большинстве случаев протекает региоселективно, причем значительное влияние на направление реакции может оказать природа заместителя при двойной связи. В реакциях дигалогенидов селена с дивинилсульфидом и дивинилселенидом образуются продукты присоединения по правилу Марковникова, 2,6-дигалоген-1,4-тиаселенаны и -диселенаны, которые претерпевают перегруппировку и превращаются в термодинамически более устойчивые 1,3-тиаселеноланы и -диселеноланы [1; 2; 6; 8]. В отличие от винилсульфидов двойная связь в винилсульфонах дезактивирована к электрофильному присоединению за счет сильного электроноакцепторного эффекта сульфонильной группы. В реакциях дигалогенидов селена с дивинилсульфоном, которые протекают медленнее, чем с дивинилсульфидом, селен присоединяется преимущественно в α-положение двойной связи с образованием 4- и 5-членных гетероциклов [9].
Влияние такой сильной электроноакцепторной группы, как карбонильная, приводит к образованию продуктов присоединения против правила Марковникова - это наблюдается в реакции дигалогенидов селена с метилвинилкетоном [4].
Материалы и методы исследования
Спектры ЯМР 1Н и 13С регистрировали на приборе Bruker DPX-400 (рабочие частоты 400.13, и 100.61 МГц соответственно) в CCl4, внутренний стандарт - ГМДС. Элементный анализ выполнен на приборе Thermo Finigan EA 1112.
Типичная методика. Синтез 2-хлор-3-фенилпропилтеллуртрихлорида (II). К смеси 0.54 г (2 ммоль) TeCl4 и 50 мл ССl4 прибавили раствор 0.24 г (2 ммоль) аллилбензола в 5 мл ССl4 и перемешивали смесь 60 часов при комнатной температуре. Отгоняли растворитель на роторном испарителе, остаток промыли холодным гексаном и сушили в вакууме. Получили 0.74 г (выход 95%) 2-хлор-3-фенилпропилтеллуртрихлорида (II).
2-Хлор-3-фенилпропилтеллуртрихлорид (II). Спектр ЯМР 1Н, d, м.д.: 2.75-2.82 м (1Н, CH2Ph), 3.35 м (1H, CH2Ph), 3.79-3.83 м (1H, CH2Te), 4.00 м (1H, CH2Te), 5.14-5.17 м (1H, CHCl), 7.28-7.37 м (5H, C6H5). Спектр ЯМР 13С, d, м.д.: 44.10 (CH2Ph), 60.40 (CHCl), 69.00 (CH2TeCl3), 126.57 (C6H5), 128.12 (C6H5), 129.23 (C6H5), 137.00 (C6H5). Найдено, %: С 28.04; H 2.78; Cl 36.36. С9Н10Cl4Te. Вычислено, %: С 27.89; H 2.60; Cl 36.59.
2-Бром-3-фенилпропилтеллуртрибромид (III). Спектр ЯМР 1Н, d, м.д.: 2.23-2.27 м (1Н, CH2Ph), 2.54 м (1H, CH2Ph), 3.24-3.26 м (1H, CH2Te), 3.77-3.97 м (1H, CH2Te), 4.90-4.98 м (1H, CHBr), 7.14-7.32 м (5H, C6H5). Спектр ЯМР 13С, d, м.д.: 43.32 (CH2Ph), 46.41 (CHBr), 52.57 (CH2TeBr3), 126.81 (C6H5), 128.40 (C6H5), 129.16 (C6H5), 139.69 (C6H5). Найдено, %: С 18.94; H 1.66; Br 56.82. С9Н10Br4Te. Вычислено, %: С 19.12; H 1.78; Br 56.53.
Бис(2-хлор-3-фенилпропил)селенид (VI). Спектр ЯМР 1Н, d, м.д.: 2.74-2.77 м (1Н, CH2Ph), 3.09-3.13 м (1Н, CH2Ph), 3.19-3.23 м (1H, CH2Se), 3.32-3.34 м (1H, CH2Se), 3.94-4.04 м (1H, CHCl), 7.10-7.25 м (5H, C6H5). Спектр ЯМР 13С, d, м.д.:38.31 (CH2Ph), 44.30 (CH2Se), 62.05 (CHCl), 126.42 (C6H5), 128.02 (C6H5), 128.92 (C6H5), 136.92 (C6H5). Найдено, %: С 56.14; H 5.39; Cl 17.98. С18Н20Cl2Se. Вычислено, %: С 55.98; H 5.22; Cl 18.36.
Бис(2-бром-3-фенилпропил)селенид (VII). Спектр ЯМР 1Н, d, м.д.: 2.44-2.50 м (1Н, CH2Ph), 2.83-2.87 м (1Н, CH2Ph), 2.89-2.94 м (1H, CH2Se), 3.14-3.18 м (1H, CH2Se), 3.63-3.69 м (1H, CHBr), 6.58-6.65 м (5H, C6H5). Спектр ЯМР 13С, d, м.д.: 34.26 (CH2Ph), 40.69 (CH2Se), 50.64 (CHBr), 126.08 (C6H5), 127.33 (C6H5), 128.44 (C6H5), 135.38 (C6H5). Найдено, %: С 45.78; H 4.38; Br 33.87. С18Н20Br2Se. Вычислено, %: С 45.50; H 4.24; Br 33.64.
Результаты и обсуждение
Реакции галогенидов селена и теллура с аллилбензолом не описаны в литературе. Нами впервые изучены реакции присоединения дигалогенидов селена и тетрагалогенидов теллура к аллилбензолу в различных условиях.
Установлено, что реакция тетрахлорида теллура с аллилбензолом (I) в среде четыреххлористого углерода приводит к продукту присоединения по правилу Марковникова, 3-фенил-2-хлорпропилтеллуртрихлориду (II), с выходом 95%.
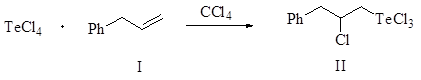
В аналогичных условиях реакция тетрабромида теллура с аллилбензолом в среде четыреххлористого углерода практически не идет. Однако при приведении процесса в среде этилацетата реакция приводит к функционализированному продукту присоединения по правилу Марковникова. Выход 2-бром-3-фенилпропилтеллуртрибромида (III) составляет 72%.
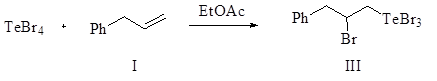
В продолжение систематических исследований реакций дигалогенидов селена с ненасыщенными соединениями [1-10] нами изучено присоединение дихлорида и дибромида селена к аллилбензолу. Реакцию проводили при комнатной температуре в СС14 или хлороформе. Установлено, что реакция приводит к продуктам присоединения против правила Марковникова, бис(1-галоген-3-фенилпроп-2-ил)селенидам (IV, V), которые с течением времени претерпевают перегруппировку и превращаются в термодинамически более устойчивые продукты присоединения по правилу Марковникова, бис(2-галоген-3-фенилпропил)селениды (VI, VII). Найдены условия, позволяющие селективно получить соединения (VI, VII) с высоким выходом.
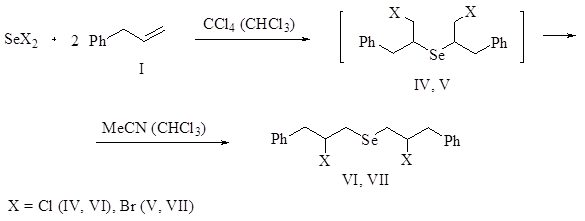
Селениды (IV, V) являются кинетическими продуктами, содержание которых в начальный период реакции составляет более 90% (данные ЯМР) в смеси с продуктами присоединения по правилу Марковникова (VI, VII). Содержание селенидов (IV, V) с течением времени уменьшается, а продуктов (VI, VII) возрастает. В более полярных растворителях, таких как хлороформ и ацетонитрил, перегруппировка идет быстрее, чем в СС14. Установлено, что реакция дихлорида и дибромида селена с аллилбензолом более селективно протекает в СС14, в среде хлороформа или ацетонитрила образуется некоторое количество (около 5-10%) побочных продуктов. Поэтому целесообразно проводить реакцию в СС14, а изомеризацию продуктов присоединения против правила Марковникова проводить в хлороформе или ацетонитриле. На этой основе разработан эффективный способ получения селенидов (VI, VII) с выходом 92-94%.
Изомеризация бромида (V) протекает быстрее, чем хлорида (IV). Это согласуется с тем фактом, что нуклеофильное замещение галогена в алкилбромидах протекает быстрее, чем в алкилхлоридах. Так, реакция дихлорида селена с аллилбензолом в СС14 через 20 ч перемешивания при комнатной температуре приводит к смеси соединений (IV) и (VI) в соотношении 3 : 2, а в реакции дибромида селена в аналогичных условиях превалирует уже продукт присоединения по правилу Марковникова [соотношение соединений (V)/(VII) = 1 : 4]. Можно предполагать, что изомеризация протекает через образование промежуточных селенираниевых катионов [10].
Строение продуктов (II. III, IV, V, VI, VII) доказано методами ЯМР 1H, 13C, а для соединений (II, III, VI, VII) подтверждено данными элементного анализа. Каждый из селенидов (IV, V, VI, VII) представляет собой смесь двух диастереомеров (d,l- и мезо-формы) в соотношении 1:1.
Выводы
Реакции тетрагалогенидов теллура с аллилбензолом протекают региоселективно с образованием продуктов присоединения по правилу Марковникова. Реакция тетрахлорида теллура с аллилбензолом в среде четыреххлористого углерода приводит к 2-хлор-3-фенилпропилтеллуртрихлориду (II) с выходом 95%. При взаимодействии с аллилбензолом тетрабромида теллура в среде этилацетата образуется 2-бром-3-фенилпропилтеллуртрибромид (III) с выходом 72%. На основе реакций дигалогенидов селена с аллилбензолом разработаны региоселективные способы получения продуктов присоединения по правилу Марковникова, бис(2-галоген-3-фенилпропил)селенидов. Получены данные, позволяющие предполагать, что реакции дигалогенидов селена протекают через образование промежуточных кинетических продуктов присоединения против правила Марковникова, бис(1-галоген-3-фенилпроп-2-ил)селенидов, которые с течением времени изомеризуются в термодинамически более устойчивые продукты присоединения по правилу Марковникова, бис(2-галоген-3-фенилпропил)селениды.
Таким образом, на основе реакций дигалогенидов селена и тетрагалогенидов теллура с аллилбензолом разработаны эффективные региоселективные способы получения ранее неизвестных соединений: 2-хлор-3-фенилпропилтеллуртрихлорида, 2-бром-3-фенилпропилтеллуртрибромида (III) и бис(2-галоген-3-фенилпропил)селенидов (VI, VII) − перспективных полупродуктов и синтонов для органического синтеза и реагентов для микроэлектроники.
Работа выполнена при финансовой поддержке Российского научного фонда (проект № 14-13-01085). Основные результаты получены с использованием материально-технической базы Байкальского аналитического центра коллективного пользования Сибирского отделения РАН.
Рецензенты:
Ларина Л.И., д.х.н., ведущий научный сотрудник ИрИХ СО РАН, г. Иркутск.
Мартынов А.В., д.х.н., ведущий научный сотрудник ИрИХ СО РАН, г. Иркутск.
Библиографическая ссылка
Мусалов М.В., Мусалова М.В., Потапов В.А., Амосова С.В. РЕГИОСЕЛЕКТИВНЫЕ РЕАКЦИИ ГАЛОГЕНИДОВ СЕЛЕНА И ТЕЛЛУРА С АЛЛИЛБЕНЗОЛОМ // Современные проблемы науки и образования. – 2014. – № 6. ;URL: https://science-education.ru/ru/article/view?id=16041 (дата обращения: 20.04.2024).



