Соединения марганца проявляют, как известно, высокую активность в окислительно-восстановительных реакциях, и в частности в процессах дожигания. Перспективность использования алюминатов кальция для увеличения механической прочности, термостабильности, стабилизации высокодисперсного состояния активного компонента подтверждается многочисленными исследованиями. Одним из методов раскрытия механизмов химических реакций является использование меченых атомов. Настоящая работа посвящена исследованию марганецалюмокальциевого катализатора в реакции гомомолекулярного изотопного обмена в молекулах СО. Катализатор предоставлен лабораторией проф. Голосмана Е.З. (Новомосковский институт азотной промышленности).
Методика
Кинетику гомомолекулярного изотопного обмена (ГМИО) СО:
12С18О+13С16О«12С16О+13С18О изучали в стеклянной вакуумной установке статическим методом с принудительной циркуляцией газа ![]() в интервале температур -196±500 °С при давлении СО 20 мм рт. ст. Образец, помещенный в реактор, подвергали обработке, которая включала в себя прогрев при 400 °С в течение 3-4 часов с откачкой диффузионным насосом до остаточного давления 10-6 мм рт. ст., затем катализатор охлаждали до заданной температуры и выдерживали при этой температуре 30 минут. Такой обработке образец подвергался перед измерением при каждой температуре во избежание искажения результатов вследствие влияния СО на свойства поверхности. Методика обработки экспериментальных результатов приведена в [1]. Скорости изотопного обмена выражаются в молекулах СО, обменивающихся на 1 см2 поверхности катализатора в секунду.
в интервале температур -196±500 °С при давлении СО 20 мм рт. ст. Образец, помещенный в реактор, подвергали обработке, которая включала в себя прогрев при 400 °С в течение 3-4 часов с откачкой диффузионным насосом до остаточного давления 10-6 мм рт. ст., затем катализатор охлаждали до заданной температуры и выдерживали при этой температуре 30 минут. Такой обработке образец подвергался перед измерением при каждой температуре во избежание искажения результатов вследствие влияния СО на свойства поверхности. Методика обработки экспериментальных результатов приведена в [1]. Скорости изотопного обмена выражаются в молекулах СО, обменивающихся на 1 см2 поверхности катализатора в секунду.
Удельную поверхность образцов определяли методом БЭТ по низкотемпературной адсорбции криптона. Рентгенофазовый анализ образцов проводили на дифрактометре ДРОН-3М с использованием излучения Cu Кα. Значения межплоскостных расстояний (d), рассчитанных из рентгенограмм, сравнивали с данными JSPDS - International Centre for Diffract Data. Измерения проведены Даценко А.М. в лаборатории рентгеновского и электронно-микроскопического анализа РХТУ им. Д.И. Менделеева. Для изучения пористой структуры катализатора была использована методика, описанная в книге [2], по адсорбции н-пропанола из водных растворов. Характеристики катализаторов приведены в таблице 1.
Таблица 1
Характеристики исследованных катализаторов
|
№ |
Катализатор |
SудKr м2/г |
Данные рентгенофазового анализа |
Пористая структура катализатора |
|
1 |
Mn-Al-Ca |
104 |
Mn3O4, алюминаты кальция |
V макропор - 66% V переходных пор - 33% V микропор - 1% |
Результаты экспериментов
1. Зависимость удельной каталитической активности (Куд) от температуры
Из исследования пористой структуры катализатора следует, что внутренняя диффузия не оказывает влияния на кинетику изотопного обмена. Удельная каталитическая активность была исследована на 3 навесках в интервале температур от -196 до +500 °С. Результаты исследования показали, что кинетика обмена хорошо описывается уравнением первого порядка. В интервале -196±25 °С на графике в координатах Аррениуса (рис. 1) наблюдается восходящая прямая, соответствующая энергии активации обмена Е=14,6 кДж/моль. При дальнейшем повышении температуры начинается резкое снижение Куд и появление в смеси молекул СО2 . При 500 °С количество СО2 за 14 минут достигает 12об%.
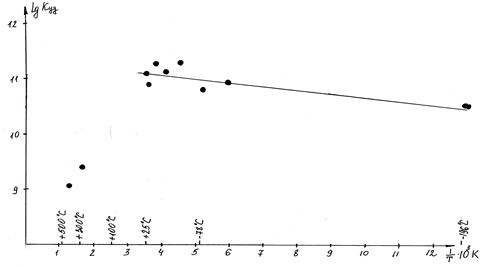
Рис. 1. Зависимость Куд MnAlCa-катализатора от температуры.
При температурах выше 300 °С наблюдался гетерообмен С18О с кислородом поверхности. Рассчитанные скорости гетерогенного обмена при 315 °С и 500 °С в 1060 раз выше, чем скорости гомомолекулярного обмена СО.
(КТ=315°С=0,224 1010 ![]() RТ=323°С =1,73 1012(
RТ=323°С =1,73 1012( ![]() )
)
(КТ=500°С =0,141 1010 ![]() RТ=500°С =2,38 1012(
RТ=500°С =2,38 1012( ![]() ).
).
2. Адсорбция СО
Изучение равновесной адсорбции СО на образцах было проведено объемным методом при температурах -196, -110, -80, -50 и +25 °С, изменении давления от 0,01 до 5 мм рт. ст. Адсорбция протекала быстро. Изобара адсорбции демонстрирует уменьшение адсорбируемого количества СО с повышением температуры (рис. 2).
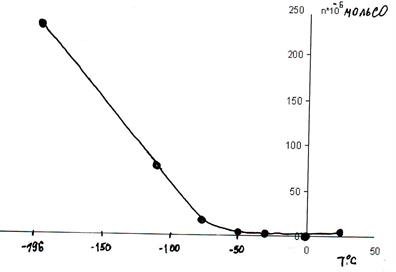
Рис. 2. Изобара адсорбции СО.
Для определения количества СО, прочно связанного с поверхностью, после снятия изотермы адсорбции проводили откачку газовой фазы при температуре адсорбции в течение 30 минут, при этом часть адсорбированного СО, более слабо связанного с поверхностью [3], десорбировалась. Затем напускали новую порцию газа и снова снимали изотерму адсорбции. Разница между величинами первой и повторной адсорбции определяла количество оставшегося после первой адсорбции СО, более прочно связанного с поверхностью.
Откачка в течение одинакового времени (30 минут) при каждой из исследованных температур и проведение повторной адсорбции показало, что изменение доли слабосвязанного СО с поверхностью происходит скачкообразно: при -196 °С доля слабосвязанного СО составляет 35%, при повышении температуры до -110 °С слабо связаны с поверхностью более 65% молекул СО. Затем при -80 °С обнаружено, что 80% молекул СО связаны достаточно прочно, а при повышении температуры до -50 °С вновь резко увеличивается доля слабосвязанных молекул – до 65%. И наконец при +25 °С, когда общее количество адсорбированных молекул минимально, оказывается, что все они связаны с поверхностью прочно.
Обсуждение результатов
Из литературных данных [4-6] известно, что на оксидах металлов СО способна адсорбироваться в двух формах: обратимой и необратимой. В случае обратимой адсорбции при десорбции в газовую фазу возвращается СО. Если же имеет место необратимая адсорбция, до десорбция возможна лишь в виде СО2.
Согласно представлениям Гарнера [7] необратимая хемосорбция СО на оксидах металлов приводит к образованию на поверхности карбонат-ионов с высвобождением двух электронов по следующей схеме:
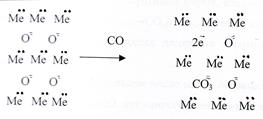
При этом в решетке оксида возникает анионная вакансия. Изотермы адсорбции СО на MnAlCa при всех температурах были обработаны в соответствии с линейной формой уравнения Лэнгмюра:
![]() . (1)
. (1)
На основании уравнения Ленгмюра рассчитаны значения констант адсорбционного равновесия b и число молей в монослое nm для каждой из температур. Расчет теплот адсорбции по изобаре Вант-Гоффа дал крайне низкие значения: ΔHпервичной = -1,1 кДж, ΔHповторной = -0,5 кДж. В интервале температур -196±25 °С существует два типа адсорбционных центров со слабой энергией связи адсорбированного СО с поверхностью. При этих температурах обмен в молекулах СО протекает без участия кислорода катализатора, через слабо связанные с поверхностью комплексы из двух или более адсорбированных молекул СО. При высоких температурах обмен идет через комплексы адсорбированной СО с кислородом катализатора:
12С18Ог+[16О]пов↔12С 18О[16О]пов↔12С16Ог+[18О ]пов (1.)
13С16Ог+[18О]пов↔13С 16О[18О]пов↔13С18Ог+[16О ]пов (1.1)
Однако полученные данные о появлении СО2 в экспериментах при высоких температурах могут свидетельствовать о существовании еще одной формы взаимодействия СО с поверхностью марганцевого катализатора: адсорбированная СО может десорбироваться в виде CO2. С образованием этой формы адсорбции СО, по-видимому, связано наблюдаемое падение скорости гомообмена при температурах выше 60 °С. На основании литературных данных в этом случае можно предполагать образование на поверхности ионов СО32-.
Автор выражает благодарность за помощь в выполнении экспериментальной части работы дипломнице Тявиной М.О., а также профессору РХТУ им. Менделеева Жаворонковой К.Н. за обсуждение результатов экспериментов.
Рецензенты:
Альтзельцер В.С., д.х.н., профессор, ОАО «Научно-исследовательский институт резиновых и латексных изделий», г. Москва;
Гладской В.М. д.т.н., профессор Института системной автоматизации и инноватики МГУТУ им. К.Г. Разумовского, г. Москва.
Библиографическая ссылка
Бреева Н.В., Бреева Н.В. ИЗОТОПНЫЙ ОБМЕН В МОЛЕКУЛАХ СО НА ЦЕМЕНТНОМ MNALCA КАТАЛИЗАТОРЕ // Современные проблемы науки и образования. – 2014. – № 6. ;URL: https://science-education.ru/ru/article/view?id=15729 (дата обращения: 24.04.2024).



