Введение
Проблемы, связанные с техногенным воздействием на урбанизированные экосистемы, приобретают все большее значение. Это обусловлено как интенсивным развитием промышленности в городской среде, так и постоянным возрастанием доли техногенного загрязнения от автомобильного транспорта, а также ростом сети автомобильных дорог. По этим причинам экологические условия для сохранения устойчивости древесных растений в урбанизированной среде промышленных городов становятся все менее благоприятными [3; 5; 10; 13; 14]. Известно, что атмосферное загрязнение городской среды (как соединениями серы, азота, так и тяжелыми металлами) сопровождается их активной аккумуляцией листьями древесных растений и развитием окислительного стресса у растений, который часто приводит к интенсивной генерации в клетках активных форм кислорода (АФК) [2; 6; 8; 9; 12; 17-19; 24]. Важнейшим механизмом сохранения устойчивости древесных растений в условиях промышленного загрязнения является активизация многоуровневой биохимической системы антиоксидантной (АОС) защиты. Она состоит из подсистем высокомолекулярных и низкомолекулярных антиоксидантов. К высокомолекулярным антиоксидантам относится ряд ферментов, среди которых основная роль в элиминации АФК принадлежит супероксиддисмутазе (СОД). Важнейшим компонентом АОС являются низкомолекулярные протекторные метаболиты, в ряде случаев способные эффективно осуществлять защиту организма от образующихся АФК. Этими соединениями часто являются фенольные соединения (флавоноиды и др.), органические кислоты [4; 18; 20; 25]. Известно, что гидроксикоричные кислоты и ряд фенолгликозидов также обладают антиоксидантной активностью [7; 11]. Несмотря на то что внимание исследователей к этой проблеме постоянно возрастает, до сих пор многие особенности функционирования антиоксидантной системы растений в условиях техногенного воздействия остаются неясными. В частности, остается невыясненной роль отдельных фенольных соединений в клетках листьев растений в механизмах антиоксидантной защиты и уровень их антиоксидантной активности. Это и было основной целью исследований.
Материалы и методы
Для хроматографического анализа проводился сбор листьев березы повислой, растущей как вблизи наиболее загруженных автотранспортом городских автомагистралей г. Екатеринбурга (5 м), так и на расстоянии 400 м от нее. Контрольные пробы взяты в березняках в 30 км от города. Взятие каждой пробы осуществлялось от нескольких деревьев. Затем пробы смешивались для получения средней пробы. Сразу после сбора листья березы высушивали при 60 °С, затем размалывали. После этого навеску с 2 г смешивали с 20 мл 95%-ного этанола. Экстракцию фенольных соединений из листьев березы проводили в обратном холодильнике на водяной бане в течение 30 мин при кипении раствора. После этого суспензию центрифугировали при 10000 g в течение 10 мин. Хроматографический анализ проводили на жидкостном хроматографе Shimadzu LC-20 со спектрофотометрическим УФ-детектором. Детектирование элюента осуществляли одновременно на двух полосах поглощения: 254 и 360 нм на хроматографической колонке PerfectSil Target ODS-3 5 мкм с обращенной фазой, размерами 250 х 4,6 мм. Градиентное элюирование проводилось в диапазоне 10–50% со скоростью 1 мл в мин при температуре 40 °С. Элюент А – ацетонитрил – 0,05 М фосфатный буферный раствор (рН=3,0); элюент В – ацетонитрил-вода (9:1). Продолжительность хроматографического анализа – 45 мин при 40 °С. Из них от 0 до 30 мин проводилось градиентное элюирование в диапазоне 10-50%, затем в течение 15 мин при концентрации 50%. Для идентификации фенольных соединений использовали вещества-свидетели фирмы Sigma-Aldrich Fluka: кверцетин, изокверцетин, кафтаровая к-та, арбутин, салицин, гиперозид, галловая к-та, гидрохинон, рутин, кофейная к-та, феруловая к-та, аскорбиновая к-та, 3-кофеоилхинная к-та, 4-кофеоилхинная к-та, 5-кофеоилхинная к-та, кемпферол, мирицетин.
Результаты
Градиентный хроматографический анализ (ВЭЖХ) образцов из листьев березы повислой, взятых как в урбанизированной среде, так и за пределами импактной зоны, позволил выявить 51-54 фенольных соединения (рис. 1).
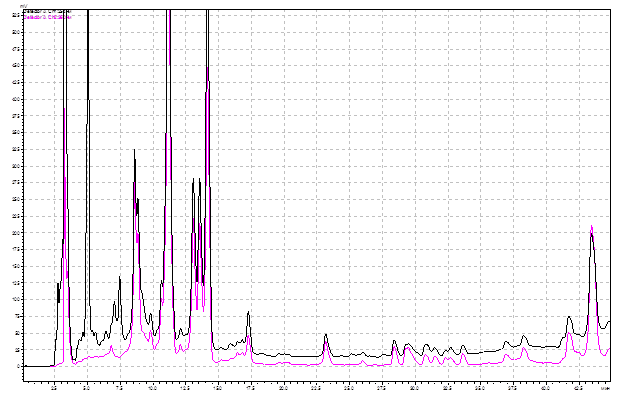
Рис. 1. ВЭЖХ фенольных соединений из листьев березы повислой в условиях урбанизации (техногенного загрязнения выбросами автотранспорта).
Примечания: 1 - аскорбиновая кислота; 4 – галловая кислота; 6 – кафтаровая кислота; 9 – кофейная кислота; 12 – 4-кофеоилхинная кислота; 17 – рутин; 18 – 5-кофеоилхинная кислота; 20-гиперозид; 20а – изокверцетин; 26 – мирицетин; 34 – кверцетин; 39 – кемпферол
Таблица 1. Влияние интенсивного техногенного загрязнения (выбросами автотранспорта) на содержание фенольных соединений в листьях березы повислой
|
№ хроматогр. пика |
Абсорбция (mv). Контроль |
Абсорбция (mv). Загрязнение (5 м от автомагистрали) |
Изменение со держания фенольных сое- динений (в %) |
ВУ |
Спектральное отношение S360 /S254 |
|
1 |
39,00±4,37 |
59,9±6,18 |
+53,59 |
2,51 |
0,05 |
|
2 |
119,46±15,12 |
100,67±12,61 |
-15,72 |
2,78 |
0,05 |
|
4 |
590,50±63,31 |
375,22±42,25 |
-36,46 |
3,20 |
0,06 |
|
7 |
500,00±65,22 |
218,14±25,23 |
-56,40 |
5,02 |
0,06 |
|
16 |
293,12±32,58 |
580,24±62,14 |
+97,95 |
9,02 |
0,94 |
|
18 |
70,02±0,85 |
29,20±3,27 |
-58,29 |
9,81 |
0,56 |
|
19 |
98,46±12,55 |
136,86±15,36 |
+39,00 |
10,6 |
0,91 |
|
20 |
680,1±72,31 |
483,0±54,28 |
-28,98 |
11,21 |
0,77 |
|
21 |
271,17±29,81 |
304,18±32,68 |
+12,17 |
13,0 |
0,88 |
|
22 |
270,58±30,11 |
288,70±32,18 |
+6,69 |
13,62 |
0,81 |
|
23 |
460,0±50,13 |
198,57±21,14 |
-56,83 |
14,3 |
0,55 |
|
26 |
18,10±2,64 |
24,44±2,97 |
+35,02 |
16,5 |
0,96 |
|
27 |
60,45±7,22 |
31,16±3,56 |
-48,45 |
17,23 |
0,69 |
|
29 |
5,43±0,62 |
3,59±0,47 |
-33,89 |
20,05 |
0,67 |
|
37 |
3,62±0,41 |
4,31±0,52 |
+19,06 |
27,5 |
1,05 |
|
38 |
23,53±2,73 |
13,18±1,67 |
-43,99 |
28,42 |
1,22 |
|
45 |
14,12±1,77 |
4,79±0,54 |
-66,08 |
33,58 |
1,3 |
|
46 |
13,76±1,72 |
8,15±1,12 |
-40,77 |
37,0 |
1,11 |
|
47 |
21,72±2,65 |
8,39±0,95 |
-61,37 |
38,25 |
1,08 |
|
48 |
3,26±0,39 |
3,03±0,41 |
-7,06 |
40,0 |
0,68 |
|
50 |
44,01±4,82 |
37,09±3,97 |
-15,72 |
41,7 |
1,11 |
|
51 |
151,01±17,12 |
100,19±12,74 |
-33,65 |
43,3 |
1,32 |
Из общего количества нами идентифицировано 15 фенольных соединений. Список идентифицированных нами фенольных соединений в листьях березы представлен в табл. 2. По химическому составу это были флавоноиды, фенолкарбоновые и гидроксикоричные кислоты.
Для анализа основных, доминирующих тенденций в содержании фенольных соединений в условиях техногенного загрязнения нами проведен как тотальный сравнительный количественный попарный анализ всех выявленных при хроматографии пиков, так и анализ идентифицированных нами фенольных соединений.
Тотальный попарный сравнительный анализ образцов (пиков с идентичным ВУ и спектральным соотношением (S360 /S254)) листьев из загрязненной городской среды (вблизи автомагистрали) и контрольных древостоев (за пределами импактной зоны) убедительно продемонстрировал, что эти образцы значительно отличались между собой (табл. 1).
Как показали результаты сравнительного изучения хроматограмм, в образцах листьев вблизи автомагистрали наблюдается значительное преобладание фракций с заметным снижением содержания соединений в пике (68,18%). Фракций с возрастанием содержания фенольных соединений отмечено лишь 31,82%. При этом обращает внимание значительный уровень изменения содержания этих соединений (табл. 1).
Для более глубокого анализа компенсационных процессов, происходящих в клетках листьев березы в условиях техногенного стресса, было целесообразно проанализировать тенденции реакций идентифицированных нами на хроматограммах фенольных соединений, так как функции ряда из них хорошо известны.
Как показали результаты, при сравнительном попарном анализе идентифицированных фенольных соединений нами выявлен примерно такой же спектр тенденций, как и при анализе тотального спектра. Выявлено, что количество идентифицированных фенольных соединений, содержание которых снижается, составляло 80%, количество соединений, содержание которых возрастало, значительно меньше: 20% (табл. 2). В составе соединений с резко выраженной реакцией ингибирования синтеза преобладали фенолкарбоновые, гидроксикоричные кислоты и флавоноиды.
Таким образом, преобладающей реакцией на заметный окислительный стресс у древесных растений в импактной зоне в условиях значительного техногенного загрязнения было заметное ингибирование синтеза фенольных соединений (табл. 2). Это арбутин, галловая кислота, гиперозид, кверцетин, изокверцетин, кемпферол; кофейная кислота, 4-кофеоилхинная кислота, 5-кофеоилхинная кислота, рутин, феруловая кислота, а также аскорбиновая кислота.
Содержание ряда других фенольных соединений в листьях, наоборот, заметно возрастало. Это кафтаровая кислота, мирицетин, салицин. Учитывая то, что, по мнению ряда авторов [23], наиболее активным антиоксидантным эффектом из флавоноидов обладает мирицетин, возрастание его содержания в листьях березы вблизи автомагистрали вполне объяснимо. Можно предполагать, что названные фенольные соединения, сохраняющие высокую активность и при значительном уровне техногенного воздействия, являются достаточно высокоустойчивыми.
Таким образом, выявленное нами в зоне интенсивного техногенного загрязнения (около автомагистрали), преимущественно, сильное ингибирование синтеза большинства фенольных соединений, по нашему мнению, однозначно свидетельствует о том, что у большинства фенольных соединений, обладающих сильной антиоксидантной активностью, интенсивность их синтеза подавляется. Но, учитывая, что в составе хроматограмм присутствуют как мажорные, так и минорные фракции, очевидно, что количественные изменения в составе минорных фракций не вносят значительного вклада в процессы компенсации окислительного стресса (свободнорадикального окисления), как количественные сдвиги в составе мажорных фракций.
Таблица 2. Влияние интенсивного техногенного загрязнения (выбросами автотранспорта) на содержание фенольных соединений в листьях березы повислой в зависимости от расстояния до автомагистрали
|
Наименование соединения |
Абсорбция (mv). Контроль 30 км от города |
Абсорбция (mv). Загрязнение 5 м от автомагистрали |
Абсорбция (mv). Загрязнение 400 м от автомагистрали |
ВУ |
Спектральное отношение S360 /S254 |
|
Аскорбиновая кислота |
119,46±15,12 |
100,67±12,61 -15,73% |
149,0±17,2 +24,73% |
2,64 |
0,008 |
|
Арбутин |
187,50±20,17 |
82,70±9,26 -55,89% |
325,0±29,13 +73,33% |
3,06 |
0,012 |
|
Галловая кислота |
1725,00±201,2 |
1320,0±168,41 -23,48% |
1100,0±25,23 -36,23% |
3,61 |
0,021 |
|
Кафтаровая кислота |
122,35±9,17 |
197,20±23,44 +61,18% |
232,6±6,81 +90,11% |
4,003 |
0,095 |
|
Салицин |
28,0±3,62 |
37,2±4,32 +32,85% |
47,0±4,69 +67,86% |
4,30 |
0,051 |
|
Кофейная кислота |
36,57±4,18 |
26,54±2,91 -27,43% |
64,0±5,97 +75,01% |
5,73 |
0,53 |
|
4-кофеоилхин- ная кислота |
68,42±7,64 |
28,76±3,17 -57,97% |
100,0±12,15 +46,16% |
6,70 |
0,303 |
|
Рутин |
95,03±11,27 |
73,23±8,17 -22,94% |
110,0±12,35 +15,75% |
9,46 |
0,84 |
|
Феруловая кислота |
26,0±3,32 |
14,0±1,85 -46,15% |
16,0±1,74 -38,46% |
9,57 |
0,212 |
|
5-кофеоилхин- ная кислота |
36,0±4,21 |
27,0±3,22 -25,0% |
62,0±5,82 +72,22% |
10,1 |
0,61 |
|
Гиперозид |
4000±523,67 |
1180,0±163,14 -70,50% |
1350,0±151,4 -66,25% |
10,93 |
0,884 |
|
Изокверцетин |
20,2±2,61 |
14,0±1,72 -30,69% |
17,0±18,52 -15,84% |
11,74 |
1,12 |
|
Мирицетин |
18,10±2,31 |
24,44±2,77 +35,02% |
22,3±25,14 +23,2% |
16,8 |
0,96 |
|
Кверцетин |
5,43±0,62 |
3,47±0,41 -36,09% |
10,0±11,65 +84,16% |
25,4 |
0,971 |
|
Кемпферол |
23,53±2,73 |
13,18±1,67 -43,99% |
24,5±2,88 +4,12% |
28,42 |
1,22 |
Хроматографический анализ листьев березы на расстоянии 400 м от автомагистрали продемонстрировал совершенно противоположные результаты. У 73,3% идентифицированных фенольных соединений активность, наоборот, значительно возрастала (табл. 2). Снижение активности отмечалось лишь у 26,7% фракций.
Обсуждение
Как уже отмечалось выше, фенольные соединения обладают антиоксидантной активностью. Поэтому мы исходим из предположения о том, что изменение активности синтеза этих фенольных соединений в условиях интенсивного техногенного воздействия является не случайным, а непосредственно связано с антиоксидантной активностью. Следовательно, дифференциация их по типу реакции может быть обусловлена тем, что фенольные соединения, активность которых ингибируется в условиях интенсивного техногенного загрязнения среды, неэффективно функционируют в этих условиях, тогда как у группы фенольных соединений, активность которых возрастает, она сохраняется и в этих условиях. Можно предполагать, что их антиоксидантная активность наиболее высока из всей группы изученных нами фенольных соединений.
Исходя из этого, самыми низкими антиоксидантными свойствами отличались: галловая кислота, феруловая кислота, гиперозид, кемпферол и изокверцетин. Наиболее высокоактивными были кафтаровая кислота, мирицетин, салицин. Их активность возрастала как при умеренном техногенном воздействии, так и при интенсивном. В состав фенольных соединений, сохраняющих высокую активность только в условиях умеренного техногенного воздействия, входила аскорбиновая кислота, арбутин, 4-КФК, 5-КФК, кофейная кислота, рутин и кверцетин. Интересно отметить, что в их составе как флавоноиды, так и фенолгликозиды, фенолкарбоновые и гидроксикоричные кислоты.
Сравнительный анализ полученных нами результатов ВЭЖХ с данными других авторов, которые, преимущественно, изучали динамику содержания суммарного количества фенольных соединений, показал, что они не совпадают. В целом общей доминирующей тенденцией в реакции фенольных соединений на окислительный стресс в клетках древесных растений является возрастание активности синтеза этих соединений [1; 21; 22; 26; 27]. Возможно, это обусловлено тем, что рядом авторов изучалось общее содержание фенольных соединений, а нами – изменение содержания индивидуальных фенольных соединений. Ряд исследователей предполагает, что эта реакция имеет двухфазный характер [1]. Автором показано, что в импактной зоне (вблизи источника загрязнения) синтез ряда фенольных соединений, обладающих сильной антиоксидантной активностью, заметно снижается [1]. Далее, в зоне умеренного загрязнения, он, наоборот возрастает. Сходные результаты по водорастворимым антиоксидантам получены также и другими авторами [16]. Это в полной мере совпадает с полученными нами результатами. Полученные нами результаты совпадают также с данными Гарифзянова А.Р. с сотр. [2], которые выявили снижение содержания аскорбиновой кислоты и ряда фенольных соединений в листьях березы в условиях промышленного загрязнения.
К настоящему времени пока не совсем ясно, каким образом происходит тонкая регуляция этой многокомпонентной системы клеточной защиты от окислительного стресса. Есть предположение, что в зависимости от интенсивности стрессового воздействия включаются те или иные компоненты антиоксидантной системы защиты. При низких концентрациях техногенных загрязнений может активироваться низкомолекулярная компонента защиты – увеличение синтеза фенольных соединений, а при более высокой – высокомолекулярная, когда возрастает активность СОД и стимулируются процессы накопления антоциановых пигментов [16]. Полученные нами результаты подтверждают это предположение.
В целом полученные нами результаты однозначно показали, что в зоне сильного техногенного загрязнения (вблизи городских автомагистралей) биохимическая подсистема антиоксидантной защиты древесных насаждений (березы повислой), включающая низкомолекулярные фенольные соединения, недостаточно эффективна, вследствие чего синтез большей части этих соединений, обладающих антиоксидантной активностью, ингибируется. В условиях более умеренной техногенной нагрузки, наоборот, активность синтеза большинства фенольных соединений в листьях березы значительно возрастает.
Проект выполнен при поддержке Интеграционного проекта УрО РАН (проект 12-И-4-2057).
Рецензенты:
Усольцев В.А., д.с.-х.н., профессор, профессор Уральского государственного лесотехнического университета, г. Екатеринбург.
Менщиков С.Л., д.с.-х.н., заведующий лабораторией экологии техногенных растительных сообществ ФГБУН «Ботанический сад Российской академии наук», г. Екатеринбург.
Библиографическая ссылка
Шавнин С.А., Колтунов Е.В., Яковлева М.И. ВЛИЯНИЕ ТЕХНОГЕННОГО ЗАГРЯЗНЕНИЯ НА СОДЕРЖАНИЕ ФЕНОЛЬНЫХ СОЕДИНЕНИЙ В ЛИСТЬЯХ БЕРЕЗЫ ПОВИСЛОЙ (BETULA PENDULA ROTH.) В УСЛОВИЯХ УРБАНИЗАЦИИ // Современные проблемы науки и образования. – 2014. – № 2. ;URL: https://science-education.ru/ru/article/view?id=12871 (дата обращения: 19.04.2024).



