В настоящее время в связи с появлением значительного количества штаммов бактерий, резистентных к антибиотикам широкого спектра действия, большую актуальность приобретают синтез новых антибактериальных препаратов и изучение механизмов их действия. Наиболее перспективными в этом отношении являются органические соединения халькогенов – селена и теллура. На протяжении последнего десятилетия обнаружена антибактериальная активность ряда органических [3] и неорганических [7] соединений теллура. Например, гетероциклические производные дийодида дибензоилтеллура показали антибактериальную активность против грамположительных (Bacillus subtilis, Staphylococcus aureus) и грамотрицательных (Escherichia coli, Pseudomonas aeruginosa и Salmonella typhi) бактерий [3]. Ранее сообщалось, что теллуроорганические соединения, у которых атом теллура расположен у алифатического атома углерода, обладали лучшей активностью, чем соединения, имеющие атом теллура у ароматического кольца [3]. Это, вероятно, обусловлено более легким разрывом связи «С-Те» у алифатического атома углерода и последующим освобождением атома теллура в виде неорганического теллурит-аниона (ТеО32-), который значительно токсичнее своей органической формы [1; 6]. На протяжении последних десяти лет проводится синтез и изучение биологической активности арилалифатических дикетонов, содержащих атомы халькогенов (селена и теллура) у алифатического атома углерода.
В связи с этим целью нашей работы явилось изучение антибактериального действия теллуроорганического соединения 1,5-дифенил-3-теллуропентандион-1,5 на клинические штаммы Еscherichia coli.
Материалы и методы
В эксперименте использовали соединение 1,5-дифенил-3-теллуропентандион-1,5, синтезированное под руководством д.х.н., профессора Б.И. Древко (рис. 1).
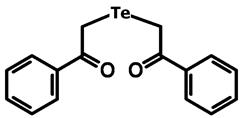
Рис. 1. Структурная формула 1,5-дифенил-3-теллуропентандион-1,5
Эксперимент проводили на десяти таксономически идентичных клинических штаммах Еscherichia coli (E. coli). Штаммы бактерий выделяли от больных с гнойными осложнениями, находящихся на лечении в травматолого-ортопедическом стационаре Саратовского научно-исследовательского института травматологии и ортопедии (СарНИИТО). Видовую идентификацию штаммов проводили на основании изучения фенотипических свойств. Бактерии обладали резистентностью к пяти и более профильным антибиотикам: бета-лактамам (цефалоспорины 1-2 поколения, оксациллин, метициллин), макролидам (эритромицин), фторхинолонам (ципрофлоксацин, левофлоксацин), аминогликозидам (гентамицин) и ванкомицину.
Суспензию бактерий готовили по стандарту мутности ГИСК им. Л.А. Тарасевича, путём последовательных разведений до конечной концентрации бактерий - 3·105 клеток в 1 мл.
1 мг соединения растворяли в 100 мкл ДМФА (диметилформамида), добавляли 900 мкл 0.9%-ного NaCl - проба 1 (1 мг/мл). В качестве контроля использовали 1 мл ДМФА с добавлением 9 мл 0,9%-ного NaCl. Затем из пробы 1 отбирали 100 мкл, добавляли 900 мкл из контрольной пробирки, получая пробу 2 (0,1 мг/мл). Из пробы 2 отбирали 100 мкл содержимого, добавляли 900 мкл из контроля, получая пробу 3 (0,01 мг/мл). Из пробы 3 отбирали 100 мкл раствора, добавляли 900 мкл из контроля, получая пробу 4 (0,001 мг/мл). Из пробы 4 отбирали 100 мкл раствора, добавляли 900 мкл из контроля, получая пробу 5 (0,0001 мг/мл).
В пробирки с разведениями соединения добавляли по 100 мкл конечной суспензии (3·105 КОЕ/мл) микроорганизмов, встряхивали и инкубировали в течение 30, 60, 90, 120, 150 минут при комнатной температуре.
В качестве контроля использовали такие же количества бактериальной взвеси, разведенные в аналогичных пропорциях с контролем (ДМФА с 0,9%-ным NaCl), а также выдержанные в течение тех же промежутков времени. После этого бактериальные взвеси из каждой пробирки в количестве 100 мкл высевали на чашки Петри с твердой питательной средой (мясо-пептонный агар), которые затем помещали в термостат на 24 часа при 37 ºС. Подсчет колоний производили на следующий день.
Статистическую обработку полученных данных осуществляли при помощи пакета программ Statistica 6,0. Проверяли гипотезы о виде распределений (критерий Шапиро-Уилкса). Большинство данных не соответствуют закону нормального распределения, поэтому для сравнения значений использовался U-критерий Манна-Уитни, на основании которого рассчитывался Z-критерий Фишера и показатель достоверности p. Критический уровень значимости при проверке статистических гипотез в данном исследовании принимали равным 0,05.
Результаты и их обсуждение
Теллуроорганический препарат 1,5-дифенил-3-теллуропентандион-1,5 оказывал выраженную антибактериальную активность на клинические штаммы E. coli в концентрациях 0,0001-1 мг/мл. В минимальной концентрации 0,0001 мг/мл соединение не вызывало значительного подавления роста клеток кишечной палочки (таблица 1). В данной концентрации препарат достоверно подавлял рост колоний при инкубации 90 минут (на 23,9%) и 120 минут (на 21,8%). При других режимах инкубации с исследованным соединением рост колоний кишечной палочки не отличался достоверно от контроля.
Таблица 1. Антибактериальное действие теллуроорганического соединения на клинические штаммы E. coli
|
|
Количество колоний на твердых питательных средах |
||||||
|
Контроль (ДМФА и физ. р-р) |
Опытные группы, концентрация вещества, мг/мл |
||||||
|
1 |
0,1 |
0,01 |
0,001 |
0,0001 |
|||
|
Время воздействия, мин |
30 |
906 (806;978)
|
1(0;8) Zк=3.77; pк=0.000157. |
67(28;453) Zк=3.77; pк=0.000157 |
385(367;453) Zк=3.77; pк=0.000157. |
562(458;567) Zк=3.51; pк=0.000440. |
872(845;897) Zк=0.90; pк=0.364347. |
|
60 |
903 (867;1011)
|
0(0;0) Zк=3.77; pк=0.000157. |
4(0;71) Zк=3.77; pк=0.000157 |
304(209;390) Zк=3.77; pк=0.000157. |
547(467;601) Zк=3.62; pк=0.000285. |
776(549;876) Zк=1.96; pк=0.049367. |
|
|
90 |
938 (867;1045)
|
0(0;0) Zк=3.77; pк=0.000157. |
0(0;0) Zк=3.77; pк=0.000157 |
266(107;376) Zк=3.77; pк=0.000157. |
385(311;483) Zк=3.77; pк=0.000157. |
713(598;906) Zк=2.19; pк=0.028366. |
|
|
120 |
926 (789;995)
|
0(0;0) Zк=3.77; pк=0.000157. |
0(0;0) Zк=3.77; pк=0.000157 |
178(84;205) Zк=3.77; pк=0.000157. |
390(267;534) Zк=3.77; pк=0.000157. |
724(503;892) Zк=2.19; pк=0.028366. |
|
|
150 |
936 (879;1067)
|
0(0;0) Zк=3.77; pк=0.000157. |
0(0;0) Zк=3.77; pк=0.000157 |
67(29;206) Zк=3.77; pк=0.000157. |
202(167;278) Zк=3.77; pк=0.000157. |
729(564;894) Zк=1.88; pк=0.058878 |
|
Примечания: в каждом случае приведены средняя величина (медиана – Ме), нижний и верхний квартили (25%;75%).Zк, pк – различия по сравнению с группой контроля
При низкой концентрации 0,001 мг/мл теллуроорганическое соединение эффективно подавляло рост бактериальных колоний: на 37,9% (30 минут), 39,4% (60 минут), 58,9% (90 минут), 57,9% (120 минут), 78,4% (150 минут) соответственно по сравнению с контролем (Р<0,001).
В концентрации 0,01 мг/мл соединение 1 оказывало сравнительно большее антибактериальное действие, уменьшая число бактериальных колоний на 57,5% (30 минут), 66,3% (60 минут), 71,6% (90 минут), 80,8% (120 минут), 92,8% (150 минут) соответственно (Р<0,001).
Наибольший антибактериальный эффект наблюдался в максимальных концентрациях соединения 1 (1 и 0,1 мг/мл). Теллурорганическое соединение в концентрации 0,1 мг/мл практически полностью подавляло рост штаммов кишечной палочки, уменьшая число бактериальных колоний на 92,6% при 30-минутной инкубации и на 99,6% при инкубации 60 минут (Р<0,001). Более длительные периоды инкубации приводили к полному подавлению роста бактерий (Р<0,001).
Максимальная концентрация соединения 1 (1 мг/мл) характеризовалась практически полным отсутствием роста бактериальных клеток кишечной палочки. При минимальной инкубации 30 минут рост бактерий подавлялся на 99,9% (Р<0,001), а увеличение времени инкубации приводило к полному прекращению роста бактерий (таблица 1).
Достаточно высокие антибактериальные свойства исследуемого соединения обусловлены токсичностью атома теллура в его составе, который, как предполагается, может освобождаться из соединения с образованием неорганической формы теллура, обладающей большей токсичностью по сравнению с органической формой [6]. По мнению ряда авторов, молекулярные механизмы токсичности соединений теллура определяются сильной окислительной способностью по отношению к свободным тиольным группам в клетке [5; 8; 10] или выработкой супероксидных радикалов в процессе восстановления теллурит-аниона до элементарного теллура бактериальной клеткой (Te32- + НАДФН + 3 H+ + 2 O2 → Te0 + 3 НАДФ+ + 2 О2- + 3 Н2О), что приводит к дисбалансу редокс-системы внутри клетки [4; 9].
Кроме того, необходимо учитывать, что для грамотрицательных бактерий характерно наличие сложной внешней мембраны, основу которой составляет липополисахарид. Липополисахаридный слой практически непроницаем для экзогенных гидрофильных соединений, к которым относится большинство питательных веществ (сахаров, аминокислот) и антибиотиков. Транспорт перечисленных соединений внутрь бактериальной клетки осуществляется через воронкообразные белковые структуры (пориновые каналы), встроенные в липополисахаридный слой.
Гидрофобные соединения (например, антибиотики хинолоны, макролиды и тетрациклины) способны диффундировать через липополисахаридный слой. Гликопептиды и природные пенициллины, которые можно отнести к высокомолекулярным антибиотикам, с трудом проникают через пориновые каналы грамотрицательных бактерий, чем и объясняется природная устойчивость данных микроорганизмов к перечисленным соединениям [2].
Заключение
Можно предположить, что высокая антибактериальная активность теллуроорганического соединения обусловлена, в первую очередь, его физико-химическими свойствами, а именно низкой молекулярной массой, гидрофобностью молекулы и значительной токсичностью, благодаря чему изученное соединение могло легко проникать через липополисахаридный слой внешней мембраны грамотрицательных бактерий и действовать как эффективный антибактериальный препарат.
Авторы выражают сердечную благодарность за помощь в подготовке статьи старшему научному сотруднику отдела фундаментальных и клинико-экспериментальных исследований ФГБУ «СарНИИТО» Минздрава России, к.м.н. Бабушкиной И.В.
Рецензенты:
Телесманич Н.Р., д.б.н., зам. директора по НИР ФКУЗ «Ростовский-на-Дону противочумный институт Роспотребнадзора», г. Ростов-на-Дону.
Внуков В.В., д.б.н., профессор, заведующий кафедрой биохимии и микробиологии ФГАОУ ВПО «Южный федеральный университет», г. Ростов-на-Дону.
Библиографическая ссылка
Русецкая Н.Ю., Саратцев А.В., Древко Б.И., Горошинская И.А., Бородулин В.Б. АНТИБАКТЕРИАЛЬНОЕ ДЕЙСТВИЕ ТЕЛЛУРОРГАНИЧЕСКОГО СОЕДИНЕНИЯ НА КЛИНИЧЕСКИЕ ШТАММЫ ESCHERICHIA COLI // Современные проблемы науки и образования. – 2014. – № 1. ;URL: https://science-education.ru/ru/article/view?id=12006 (дата обращения: 16.04.2024).



