Введение
Применение достижений генетики и селекции в практике лесного хозяйства позволяет в полной мере использовать большие потенциальные возможности генетических ресурсов для сохранения и приумножения лесных богатств (Калинин и др., 1992). В настоящее время в технологии in vitro для древесных культур достигнут значительный прогресс. Тем не менее остаются широкие возможности для улучшения этих методов в плане промышленного производства. Успешно размножают такие древесные растения, как тополь (Байбурин, 1996), береза (Durkovic, 1996), клен красный (Orlikowske, Gabryszewska, 1995), ель сибирская и лиственница, сосна обыкновенная (Калашникова, 1994). Для промышленного размножения лесных древесных растений методом клонального микроразмножения очень важно использовать в качестве исходного материала ценные формы, сорта, гибриды. В качестве эксплантов используют различные части и органы растений. Широко используются боковые или верхушечные почки, сегменты стеблей и корней, высечки из листьев, пыльники и т.д.
Из литературных данных следует, что растения осины (растения рода Populus) являются объектом исследования по культуре тканей. Один из способов размножения осины в культуре in vitro - получение растений-регенерантов из каллусной ткани.
Первые работы по культуре тканей древесных растений были опубликованы в середине 20-х годов прошлого столетия и связаны с именем Готре, который показал, что камбиальные ткани некоторых растений способны к каллусогенезу in vitro. Первые растения-регенеранты осины, доведенные до почвенной культуры, были получены лишь в середине 60-х годов Матесом. Со временем этот метод стал незаменим при размножении ценных видов растений (Кузьмина, 2005).
Г.П. Бутова и Т.М. Табацкая (1975) изучали каллусообразование и рост каллуса при пересадках у разных видов тополя, а также камбиальную активность in vitro в зависимости от времени года и вторичную дифференциацию и органогенез в каллусной ткани изучаемых тополей.
Целью данного исследования является изучение сомаклональной изменчивости при получении растений-регенерантов осины из каллусной ткани.
Основные результаты исследования
Для получения каллуса в качестве первичного экспланта нами были использованы черенки с вегетативными почками, нарезанные с однолетних побегов 5-6 летних корневых отпрысков, устойчивых к сердцевинной гнили клонов осины Матюшинского участкового лесничества Пригородного лесничества Республики Татарстан (квартал 81).
Для выращивания каллуса использовали питательную среду Мурасига и Скуга (MS). Почки вводили в культуру in vitro в мае месяце.
Для стерилизации нарезанные черенки помещали в марлевые мешочки и в ламинар-боксе погружали в 0,1%-ный раствор сулемы (двухлористая ртуть) на 10 минут. После этого черенки промывали в 3-5 объемах стерильной дистиллированной воды и слегка подсушивали. Затем готовили черенки для введения в культуру.
Готовый растительный материал с помощью стерильного пинцета горизонтально помещали в чашки Петри с питательной средой МS, содержащей в качестве стимуляторов каллусогенеза 2,5 мг/л 2,4-Д и 2,0 мг/л цитодеф (рис. 1). В пробирки, содержащие питательную среду MS в сочетании со стимуляторами каллусогенеза НУК (0,5 мг/л) и БАП (0,5 мг/л), помещали черенки осины с 1-2 почками (рис. 2).
Рисунок 1 - Чашки Петри с эксплантами

Рисунок 2 - Пробирка с черенками осины
Чашки Петри и пробирки с эксплантами закрывали плёнкой Parafilm (США) и ставили в световую комнату, где поддерживали температуру 22-25 °С.
Для дальнейшего формирования растений-регенерантов полученную каллусную ткань пересаживали на питательную среду WPM, содержащую в качестве ауксина ИУК (0,5 мг/л) и цитокины – 2iр (2-изопентениладенин) (2 мг/л) и БАП (2 мг/л). Сахароза во всех питательных средах присутствовала в концентрации 2%. Пересадку осуществляли 1 раз в 1,5 месяца. Условия выращивания были стандартные.
В результате проведенных исследований нами было установлено, что растения, полученные из каллусной ткани, отличались различной скоростью роста. Были получены растения двух типов: растения, характеризующиеся быстрым ростом, и растения, характеризующиеся медленным ростом. По морфологическим характеристикам данные растения не отличались друг от друга, однако проведенные биохимические исследования позволили выявить некоторые отличия по содержанию растворимых фенольных соединений.
Определение содержания суммы растворимых фенольных соединений проводили по следующей методике: навеску сырого материала 800 мг растирали в 70%-ном водном этаноле. Доводили объем жидкости до 10 мл, помещали на качалку на 1 час при 20 °С, центрифугировали при 3000 об/мин 10 минут (центрифуга Т-23, Польша). Определение в надосадочной фракции проводили с помощью реактива Фолина-Дениса (Шевелуха и др., 2004): 0,5 мл этанольного экстракта смешивали с 6,5 мл Н2О и 0,5 мл реактива Фолина-Дениса. Через 3 мин. добавляли 1 мл водного насыщенного раствора соды Na2CО3 и 2 мл Н2О. Через 1 час экспонирования в комнатных условиях спектрофотометрировали раствор при 725 нм и рассчитывали по калибровочной кривой.
Так, у растений, обладающих быстрым ростом на протяжении 5 пассажей, суммарное содержание растворимых фенольных соединений было на уровне 30–33 мг/г сырой массы, а у растений с медленным ростом данный учитываемый показатель существенно возрос и составил 52-58 мг/г сырой массы (рис. 3).
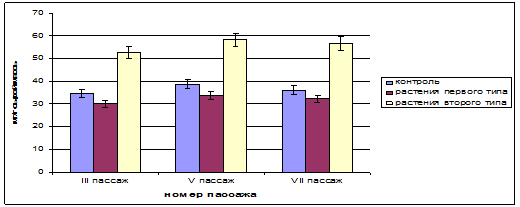
Рисунок 3 - Суммарное содержание растворимых фенольных соединений в растениях-регенерантах осины
(контроль – растения, полученные из пазушных почек; растения первого типа – растения, полученные из каллусной ткани, характеризующиеся быстрым ростом; растения второго типа – растения, полученные из каллусной ткани, характеризующиеся медленным ростом)
Можно сделать предположение, что медленный рост обусловлен повышенным содержанием фенольных соединений в тканях растений, которые в свою очередь могут вызывать ингибирование ростовых процессов. Полученные данные согласуются с результатами многих исследователей, свидетельствующими об ингибировании ростовых процессов фенольными соединениями, которые синтезируются в тканях растений как в условиях in vitro, так и в условиях in vivo (Кефели, 1974; Крамер, Козловский, 1983).
Таким образом, растения-регенеранты, полученные из каллусной ткани, отличались между собой по скорости роста, что, возможно, обусловлено изменением биохимических процессов, в частности фенольного метаболизма.
Кроме того, в результате проведения цитологических исследований нами были обнаружены изменения и на уровне числа хлоропластов в замыкающих клетках устьиц (рис. 4).
Как видно на схеме, растения из каллуса отличаются количеством хлоропластов в клетках замыкающих устьиц (листовая пластинка). Наибольшее количество хлоропластов было обнаружено у быстрорастущих растений, и наоборот – наименьшее – у медленнорастущих.
Таким образом, по всем обнаруженным показателям можно говорить о сомаклональной изменчивости. Являясь источником расширения генетического разнообразия исходного материала, сомаклональная изменчивость может быть использована в селекции для получения новых хозяйственно ценных генотипов. Растения-регенеранты осины, характеризующиеся быстрым ростом, могут успешно использоваться в лесном хозяйстве для получения необходимого количества высококачественного посадочного материала данной культуры.
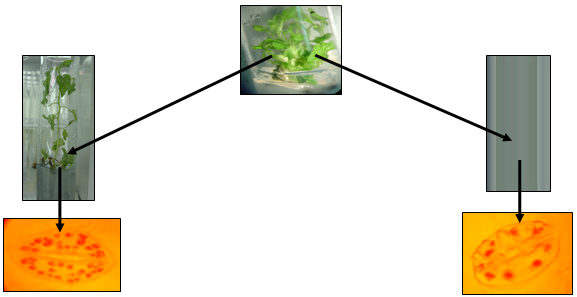
Рисунок 4 - Содержание хлоропластов в замыкающих клетках устьиц у быстрорастущих и медленнорастущих растений
Рецензенты:
Сабиров А.М., д.с.-х.н., профессор, заведующий кафедрой экологии и природообустройства ФГБОУ ВПО «Казанский государственный аграрный университет», г. Казань.
Шевелуха В.С., д.б.н., профессор кафедры генетики и биотехнологии ФГБОУ ВПО «Российский государственный аграрный университет - МСХА имени К.А. Тимирязева», г. Москва.
Библиографическая ссылка
Петрова Г.А., Калашникова Е.А. ИЗУЧЕНИЕ СОМАКЛОНАЛЬНОЙ ИЗМЕНЧИВОСТИ ПРИ ПОЛУЧЕНИИ РАСТЕНИЙ-РЕГЕНЕРАНТОВ ОСИНЫ ИЗ КАЛЛУСНОЙ ТКАНИ // Современные проблемы науки и образования. – 2014. – № 1. ;URL: https://science-education.ru/ru/article/view?id=11928 (дата обращения: 25.04.2024).



