Введение
Глобулины составляют около 40% всех белков сыворотки крови человека и содержат в своём составе от 14 до 19 L-аминокислот, среди них в больших количествах – лейцин, валин, лизин, глутаминовую кислоту, серин и треонин. Глобулины находятся в живом организме в форме биокомплексных соединений с липидами, углеводами и другими небелковыми веществами и выполняют транспортную, защитную и гормональную функции: переносят гормоны, витамины и другие вещества; защищают организм от вирусов, бактерий, токсинов, чужеродных белков, вырабатывая на них антитела; регулируют свертываемость крови; связывают половые гормоны, лекарства, углеводы и другие вещества [4]. Лекарственные препараты на основе глобулинов очень широко применяются в медицине ввиду жизненно важных функций данных белков в организме и возможности осуществлять эффективную терапию препаратами глобулинов. При этом к растворам для инъекций и инфузий предъявляются серьезные требования по изотоничности и изовязкости данных лекарственных форм крови человека.
Проблема определения концентрации белка в препаратах насчитывает уже более 60 лет. Очевидно, что создание «идеального метода» неосуществимо в силу уникальности структуры каждого белка. Спектрофотометрический метод определения – метод Лоури – обладает высокой чувствительностью (10-60 мг/л), но интенсивность окраски пропорциональна не концентрации общего белка, а количеству тирозина и триптофана. Содержание этих аминокислот в различных белках различно. Так, в альбуминах и γ-глобулинах оно различается более чем на 20%. Поэтому метод Лоури широкого применения в медико-биологической практике не нашел, хотя при определении концентрации индивидуальных белков он один из лучших.
В связи с этим целью данного исследования являлось изучение коллигативных и вязкостных свойств водных растворов иммуноглобулина противоклещевого и иммуноглобулина нормального на примере осмотического давления, понижения температуры замерзания и кинематической вязкости, а также обоснование использования метода Лоури для контроля качества белковых препаратов.
Материалы и методы исследования
В качестве объекта исследования использовали раствор иммуноглобулина нормального с концентрацией 10%, произведенный на Челябинской станции переливания крови, и раствор иммуноглобулина противоклещевого с концентрацией 10%, ОАО «Синтез», г. Курган. Определение температуры замерзания, эффективной осмотической концентрации и осмотического давления проводили на автоматическом криоскопическом осмометре ОМТ–5–02 [1, 2]. Испытуемые растворы иммуноглобулина объемом 0,2 мл помещали в кювету прибора, погруженную в термостат с контролируемой температурой, и замораживали. Осмолярность раствора автоматически определяется прибором по зафиксированной температуре замерзания. Для определения вязкости раствора альбумина для инфузий использовали капиллярный вискозиметр серии ВПЖ с диаметром капилляра 0,54 мм (константа капилляра ![]() ).
).
Количественное определение белка проводили по методу Лоури без предварительного осаждения белка [2]. Продукт взаимодействия иммуноглобулина с реактивом Фолина характеризуется максимумами светопоглощения при 330±2, 345±2 и 750±2 нм. Для построения калибровочного графика в мерную колбу вместимостью 25 мл вносили соответственно 0,1, 0,2, 0,3, 0,4 … 1 мл раствора стандартного образца предприятия, прибавляли по 5 мл реактива Фолина, доводили водой до метки, выдерживали 30 минут и измеряли оптическую плотность полученных растворов при выбранных длинах волн.
Результаты и их обсуждение
Известно, что изменение конформации белковой глобулы в целом приводит к изменению функциональной активности белка. В [3] было доказано, что молекулы альбумина в водных растворах с концентрацией до 10% находятся в виде сферических глобул. Глобулины по сравнению с альбуминами имеют более высокую молекулярную массу и также относятся к глобулярным белкам. С другой стороны, известно [6], что белковая глобула может иметь форму сферы и форму эллипса, причем форма эллипса характерна для белков с высокой молекулярной массой. Появление анизодиаметричности белковых глобул должно отразиться на коллигативных и вязкостных свойствах белковых препаратов.
Осмотическое давление в растворах белков описывается уравнением Галлера ![]() , где b – константа, учитывающая гибкость и форму макромолекул. При концентрациях ниже 1%, когда
, где b – константа, учитывающая гибкость и форму макромолекул. При концентрациях ниже 1%, когда ![]() , и в случае сферической глобулярной структуры макромолекул вещества в растворе (b = 0) уравнение Галлера переходит в уравнение Вант-Гоффа
, и в случае сферической глобулярной структуры макромолекул вещества в растворе (b = 0) уравнение Галлера переходит в уравнение Вант-Гоффа ![]() [5]. В [3] было показано, что коллигативные свойства растворов альбумина (понижение температуры замерзания и осмотическое давление) линейно зависят от процентного содержания белка в растворе. Проведенные эксперименты с растворами иммуноголобулина нормального и иммуноглобулина противоклещевого позволили выявить ряд существенных отличий. Анализ зависимостей эффективной осмотической концентрации от процентной концентрации иммуноглобулинов показывает, что в интервале концентраций 5-6% наблюдается перегиб, и эффективная осмотическая концентрация белков в растворе начинает возрастать быстрее. Соответственно, в указанном интервале концентраций формируется перегиб на графиках зависимости осмотического давления от процентного содержания белка (рис. 1). Аппроксимация данных для осмотического давления полиномом второй степени позволяет определить значения постоянной b, входящей в уравнение Галлера: для иммуноглобулина нормального b1 = 5,0, для иммуноглобулина противоклещевого b2 = 15,3.
[5]. В [3] было показано, что коллигативные свойства растворов альбумина (понижение температуры замерзания и осмотическое давление) линейно зависят от процентного содержания белка в растворе. Проведенные эксперименты с растворами иммуноголобулина нормального и иммуноглобулина противоклещевого позволили выявить ряд существенных отличий. Анализ зависимостей эффективной осмотической концентрации от процентной концентрации иммуноглобулинов показывает, что в интервале концентраций 5-6% наблюдается перегиб, и эффективная осмотическая концентрация белков в растворе начинает возрастать быстрее. Соответственно, в указанном интервале концентраций формируется перегиб на графиках зависимости осмотического давления от процентного содержания белка (рис. 1). Аппроксимация данных для осмотического давления полиномом второй степени позволяет определить значения постоянной b, входящей в уравнение Галлера: для иммуноглобулина нормального b1 = 5,0, для иммуноглобулина противоклещевого b2 = 15,3.
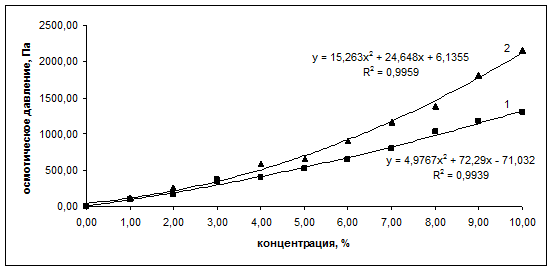
Рис. 1.
Зависимость осмотического давления от процентного содержания белка в растворе (кривая 1 – для иммуноглобулина нормального; кривая 2 – для иммуноглобулина противоклещевого)
Наличие перегиба на графиках рис. 1 свидетельствует о перестройке структуры белков в водных растворах. Для проверки данного утверждения провели пересчет экспериментальных данных и построили зависимости ![]() (рис. 2).
(рис. 2).
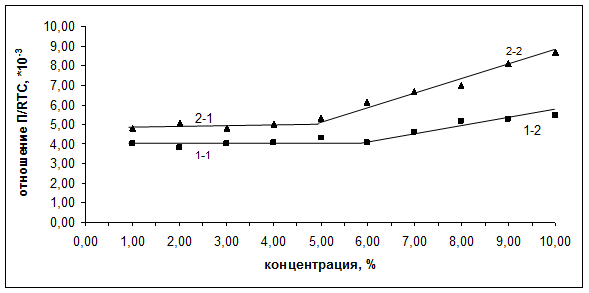
Рис. 2.
Зависимость отношения ![]() от содержания белков в водном растворе
от содержания белков в водном растворе
(кривая 1 (участки 1-1 и 1-2) – иммуноглобулин нормальный,
кривая 2 (участки 2-1 и 2-2) – иммуноглобулин противоклещевой)
На зависимостях ![]() также обнаруживается излом в диапазоне концентраций белков 5-6%. Практически горизонтальные участки 1-1 и 2-1 в диапазоне концентраций иммуноглобулинов 0-5% свидетельствуют о том, что молекулы белков в водных растворах данных концентраций находятся в виде сферических глобул. При концентрациях белков свыше 6% отношение
также обнаруживается излом в диапазоне концентраций белков 5-6%. Практически горизонтальные участки 1-1 и 2-1 в диапазоне концентраций иммуноглобулинов 0-5% свидетельствуют о том, что молекулы белков в водных растворах данных концентраций находятся в виде сферических глобул. При концентрациях белков свыше 6% отношение ![]() перестает быть постоянным, и участки графиков 1-2 и 2-2 отклоняются от горизонтали. Это является прямым доказательством того, что при концентрациях свыше 6% происходят изменения конформации белковых макромолекул иммуноглобулинов. Можно предположить, что нарушаются пропорции сферической формы, и глобулярная сферическая конформация переходит в глобулярную эллиптическую.
перестает быть постоянным, и участки графиков 1-2 и 2-2 отклоняются от горизонтали. Это является прямым доказательством того, что при концентрациях свыше 6% происходят изменения конформации белковых макромолекул иммуноглобулинов. Можно предположить, что нарушаются пропорции сферической формы, и глобулярная сферическая конформация переходит в глобулярную эллиптическую.
Линейный характер изменения кинематической вязкости раствора альбумина от содержания белка (рис. 3) дает основание говорить о применимости уравнения Эйнштейна к растворам альбумина с концентрацией, не превышающей 10%. Для нормального иммуноглобулина вязкость выше, чем для альбумина и, начиная с 6%-ного раствора, возрастает быстрее с ростом концентрации, чем это определено по линейному закону (рис. 3). Это подтверждает гипотезу о переходе сферической глобулярной структуры молекул иммуноглобулина нормального в эллиптическую глобулярную. Появление анизодиаметричности глобул приводит к искажению линейной зависимости кинематической вязкости растворов от концентрации белка.
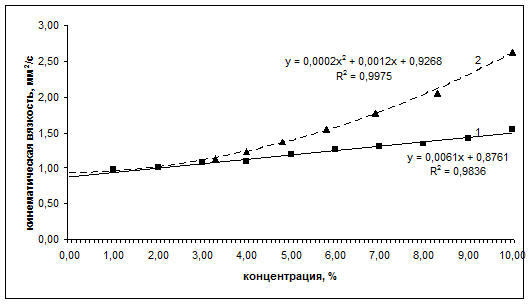
Рис.3.
Зависимость кинематической вязкости растворов от процентного содержания белка
(кривая 1 – для альбумина; кривая 2 – для иммуноглобулина нормального).
Понижение температуры замерзания растворов иммуноглобулинов линейно зависит от процентной концентрации белков в растворах (таблица 1) аналогично зависимости, выявленной для альбумина [3].
Как следует из полученных данных, значения коэффициентов корреляции отвечают критерию приемлемости (не ниже 0,99 по модулю). В этом случае для количественного определения содержания иммуноглобулина нормального и иммуноглобулина противоклещевого в водных растворах и контроля качества препаратов может быть использован метод осмометрии.
Таблица 1.
Результаты линейного регрессионного анализа зависимостей понижения температуры замерзания раствора от концентрации иммуноглобулинов
|
Результаты метрологической обработки |
Иммуноглобулин нормальный |
Иммуноглобулин противоклещевой |
|
Уравнение регрессии вида |
|
|
|
Погрешности в определении параметров a и b |
|
|
|
Коэффициент корреляции |
|
|
Растворы иммуноглобулинов с концентрацией 10% не являются изотоничными плазме и крови человека в отличие от 10%-ного раствора альбумина [3] (эффективная осмотическая концентрация составляет соответственно 970 мосмоль/кг и 550 мосмоль/кг).
При определении количественного содержания иммуноглобулина нормального методом Лоури в интервале концентраций 0,04-0,2% наблюдается линейная зависимость оптической плотности растворов от концентрации белка в максимумах светопоглощения при 345±2 и 750±2 нм. Полученные данные полностью соответствуют критерию приемлемости линейности методики (R2 = 0,9921 при аналитической длине волны 750 нм). Определение количественного содержания белка и валидационную оценку метода проводили по стандартному образцу (таблица 2). Правильность методики устанавливали путем измерения количественного содержания белка в растворах, полученных путем добавления определенного количества стандарта к исследуемому раствору (таблица 3).
По результатам определения метод Лоури отличается воспроизводимостью и небольшой погрешностью определения, что дает основание использовать его при количественной оценке содержания белка в лекарственных формах.
Среднее значение открываемости для иммуноглобулина составило 98,45 %. Согласно критерию приемлемости средний процент восстановления при использовании растворов заданных концентраций, скорректированный на 100%, и его средняя величина должны находиться в пределах 100 ± 5 %. Рекомендуемая методика определения содержания иммуноглобулина нормального по методу Лоури соответствует критерию приемлемости.
Таблица 2
Результаты количественного определения иммуноглобулина нормального методом Лоури
|
Найдено белка, % |
Xi - Xср |
(Xi - Xср)2 |
Метрологические характеристики |
|
9,98 |
- 0,1 |
0,01 |
Xср =10,08 % SD = 0,10517 x±∆x = 10,1±0,1 RSD = 1%
|
|
10,13 |
0,05 |
0,0025 |
|
|
10,14 |
0,06 |
0,0036 |
|
|
9,92 |
- 0,16 |
0,0256 |
|
|
10,18 |
0,1 |
0,01 |
|
|
10,14 |
0,06 |
0,0036 |
Таблица 3
Определение правильности методики количественного определения иммуноглобулина нормального методом Лоури
|
Содержание белка в исследуемом растворе, г |
Добавлено стандартного образца белка, г |
Расчетное содержание белка, г |
Найденное содержание, г |
Открываемость белка, % |
|
0,1008 |
0,25 |
0,3508 |
0,3458 |
98,57 |
|
0,1008 |
0,25 |
0,3508 |
0,3396 |
96,81 |
|
0,1008 |
0,25 |
0,3508 |
0,3424 |
97,61 |
|
0,1008 |
0,5 |
0,6008 |
0,5916 |
98,47 |
|
0,1008 |
0,5 |
0,6008 |
0,5954 |
99,10 |
|
0,1008 |
0,5 |
0,6008 |
0,5894 |
98,10 |
|
0,1008 |
0,75 |
0,8508 |
0,8423 |
99,00 |
|
0,1008 |
0,75 |
0,8508 |
0,8462 |
99,45 |
|
0,1008 |
0,75 |
0,8508 |
0,8397 |
99,00 |
|
Среднее значение открываемости |
98,45 |
|||
Выводы
1. Обосновано применение метода Лоури как высокочувствительного спектрофотометрического метода количественного определения содержания индивидуальных белков.
2. Для контроля содержания белка в препаратах иммуноглобулина возможно применение криоскопического метода, поскольку доказана линейная зависимость понижения температуры замерзания раствора от процентного содержания белка, имеется аппаратурная база, а сам метод является экспрессным и требующим достаточно малых количеств препарата для определения.
3. Детальное изучение коллигативных свойств водных растворов иммуноглобулина противоклещевого и иммуноглобулина нормального дало возможность выявить область концентраций (5-6%), в которой происходит переход глобулярной сферической конформации глобулярную эллиптическую. С появлением анизодиаметричности частиц увеличение %-ного содержания белка приводит к более быстрому росту эффективной осмотической концентрации и осмотического давления.
Рецензенты:
Цейликман В.Э., д.б.н., профессор, заведующий кафедрой биохимии, ГБОУ ВПО Южно-Уральский государственный медицинский университет, г. Челябинск.
Колесников О.Л., д.м.н., профессор, заведующий кафедрой биологии, ГБОУ ВПО Южно-Уральский государственный медицинский университет, г. Челябинск.
Библиографическая ссылка
Миняева О.А., Симонян Е.В., Евсельева Е.А., Позднякова Е.С., Музафарова А.Р., Саедгалина О.Т. СОВЕРШЕНСТВОВАНИЕ СПОСОБОВ КОНТРОЛЯ КАЧЕСТВА БЕЛКА В ПРЕПАРАТАХ ИММУНОГЛОБУЛИНА // Современные проблемы науки и образования. – 2014. – № 1. ;URL: https://science-education.ru/ru/article/view?id=11904 (дата обращения: 25.04.2024).



