Введение
Рост численности населения планеты и урбанизация являются причинами увеличения количества и разнообразия отходов, образуемых промышленными и сельскохозяйственными предприятиями [5]. На 2002 год количество отходов оценивалось в 12 млрд. тонн, из которых 11 млрд. тонн составляли промышленные отходы и 1,6 млрд. тонн – твердые бытовые отходы. К 2025 году аналитики предполагают увеличение количества отходов до 90 млрд. тонн [1].
Никакая другая отрасль общественного производства не связана так с использованием природных ресурсов, как сельское хозяйство. Вклад птицеводческой отрасли в производство мяса в России составляет 1,2 млн. т в год. При этом образуется 0,4 млн. т отходов потрошения птицы, что создаёт значительную проблему для перерабатывающей отрасли [3].
Среди всех отходов потрошения птицы наибольший интерес представляет перо-пуховое сырье, в котором содержится около 65% кормового белка (специализированный белок – кератин), поэтому решение проблемы перевода основного белка пера в усвояемую форму имеет первоочередное значение как с позиции мобилизации резервов животного белка, так и с точки зрения охраны окружающей среды [2, 4].
Важным направлением современной биотехнологии являются исследования, направленные на расширение возможностей переработки кератинсодержащего сырья с целью обеспечения экологичности производств за счет создания безотходных и малоотходных технологий при максимальном вовлечении побочных продуктов переработки в основное производство. В связи с этим актуальны исследования, направленные на использование ферментативных процессов переработки кератинсодержащего сырья, в том числе с применением штаммов-продуцентов кератинолитических ферментов [7].
Продуценты протеолитических ферментов обнаружены среди самых различных групп микроорганизмов: бактерий (Bacillus, Micrococcus, Pseudomonas), микромицетов (Aspergillus, Rhizopus, Penicillium), актиномицетов (Streptomyces, Actinomyces) [8]. Многие широко распространённые микроорганизмы секретируют значительное количество протеолитических биокатализаторов в окружающую среду, что значительно облегчает задачу их выделения и очистки. Возможность управления образованием ферментов за счёт подбора соответствующей питательной среды и условий культивирования позволяет не только увеличить выход ферментов, но и получать ферментные препараты с определёнными свойствами. Методы селекции и генной инженерии значительно увеличивают возможности целенаправленного биосинтеза ферментов. Существенна способность микроорганизмов вырабатывать ферменты, уникальные по своей субстратной специфичности (кератиназы, коллагеназы, эластазы) [6].
В целом следует отметить, что, несмотря на распространение протеолитических ферментов в природе и высокие объемы их производства в промышленности, протеолитические ферменты с кератиназным действием требуют более детального изучения [10].
Cчитается что, среди микроорганизмов только патогенные грибы (дерматофиты) и отдельные виды бактерий и актиномицетов обладают способностью вырабатывать внеклеточные ферменты, разрушающие белки кератинов [11].
Известно, что кератинрасщепляющие микроорганизмы могут быть выделены из природных субстратов (почвы, водоемов) и из тела животных. Такие организмы были найдены среди разных штаммов Streptomyces rimosus, S. griseus, S. roseochromogenes, S. praecox, S. parvus, S. scabies, S. griseoluteus, Nocardia rubra, S. microvlavus, S. globisporus vulgaris [9].
Даная работа направлена на идентификацию штамма-продуцента кератиназы, выделенного из мяса крупного рогатого скота, и анализ его биохимических свойств.
Материалы и методы исследований
Объектом исследования являлся штамм микроорганизмов, выделенный из мяса крупного рогатого скота.
С целью определения видовой принадлежности штамма использовали основные фенотипические характеристики. Фенотипические свойства изучали визуальным методом и методом микроскопирования. Анализировали форму, размер клеток, характер контура края колоний, рельеф, поверхность, цвет и структуру колоний, консистенцию.
Посев штаммов осуществляли на плотную питательную среду состава (г/л дистиллированной воды): панкреатический гидролизат рыбной муки – 12, пептон ферментативный - 12; натрия хлорид - 6; агар микробиологический. Оптимальная температура культивирования 37°С, рН среды 7,1-7,5.
Описание изучаемого штамма бактерий осуществляли в соответствии со стандартной методикой, руководствуясь правилами «Международного кодекса ботанической номенклатуры».
Для изучения биохимических свойств штамма использовали стандартизированные тест-системы API 50 CHB с программным обеспечением идентификации Аpiweb производства ВioMerieux (Франция). Данная тест-система включает 50 биохимических тестов по изучению углеводного обмена микроорганизмов и предназначена для идентификации бацилл, энтеробактерий и вибрионов.
Устойчивость штамма к антибиотикам определяли диффузионным методом с использованием дисков с антибиотиками. На поверхность агара в чашке Петри наносили бактериальную суспензию определенной плотности и затем помещали диски, содержащие определенное количество антибиотика. Диффузия антибиотика в агар приводила к формированию зоны подавления роста микроорганизма вокруг дисков. После инкубации чашек в термостате при температуре 35°С -37°С в течение 12 ч учитывали результат путем измерения диаметра зоны вокруг диска в миллиметрах. Определяли устойчивость к следующим антибиотикам: хлорамфеникол, стрептомицин, тетрациклин, канамицин, пенициллин, лизоцим.
Кератиназную активность штамма определяли спектрофотомтерическим методом, измеряя оптическую плотность культуральной жидкости при 340 нм. По калибровочной кривой, построенной по растворам сывороточного альбумина, определяли количество расщепленного белка (мкг/см3) культуральной жидкости за 1 час гидролиза.
Удельная активность фермента представляет собой число единиц активности, отнесенное к 1 мг белка в ферментном препарате.
Результаты исследований и их обсуждение
В результате анализа фенотипических свойств установлено, что бактерии образуют плоские, круглые, рельефные, шероховатые колонии неправильной формы с волнистыми краями телесного цвета. Консистенция колоний сухая, плотная с белым зернистым налетом, легко снимается с агара. Грамположительные бактерии размером 1,7-3×4,0-0,6 мкм при выращивании на питательной среде имеют вид толстых, больших палочек, иногда расположенных в цепочках. Палочки подвижны за счет перитрихиальных жгутиков. Культура образует эллипсоидные или цилиндрические споры размером 1,0-1,5×0,6-0,9 мкм.
Форму и размер клеток определяли на разных временных и температурных участках. Первое измерение для определения размера клеток проводили при температуре 37°С на вторые сутки. Полученные результаты представлены в таблице 1.
Таблица 1
Характеристика фенотипических свойств выделенного штамма
|
Размер |
1,7‒3×4,0‒0,6 мкм |
|
Форма |
Палочкообразная, споры эллипсоидные или цилиндрические |
|
Характер контура края |
Волнистые, неправильной формы |
|
Рельеф |
Рельефные |
|
Поверхность |
Шероховатые |
|
Цвет |
Поверхность телесного цвета |
|
Структура |
Узорчатая, зернистая |
|
Консистенция |
Колония сухая, плотная с белым зернистым налетом, легко снимается с агара |
Данные представленным в таблице 1, свидетельствуют о том что, микроорганизмы, полученные из мяса крупного рогатого скота, близки по фенотипическим показателям к бактериям рода Вacillus.
Результаты изучения биохимических свойств выделенного штамма представлены в таблице 2.
Таблица 2
Результаты биохимического тестирования микроорганизмов рода Bacillus
|
№ |
Название |
Результаты теста штамма |
№ |
Название |
Результаты теста штамма |
|
1 |
Глицерол |
+ |
26 |
Салицин |
+ |
|
2 |
Эритрит |
‒ |
27 |
Целлобиоза |
+ |
|
3 |
D-арабиноза |
‒ |
28 |
Мальтоза |
+ |
|
4 |
L-арабиноза |
+ |
29 |
Лактоза |
‒ |
|
5 |
Рибоза |
+ |
30 |
Мелибиоза |
‒ |
|
6 |
D-ксилоза |
+ |
31 |
Сахароза |
+ |
|
7 |
L-ксилоза |
‒ |
32 |
Трегалоза |
+ |
|
8 |
Рибит |
‒ |
33 |
Инулин |
‒ |
|
9 |
β-метил-ксилозид |
‒ |
34 |
Мелицитоза |
‒ |
|
10 |
Галактоза |
‒ |
35 |
D-рафиноза |
‒ |
|
11 |
D-глюкоза |
+ |
36 |
Крахмал |
+ |
|
12 |
D-фруктоза |
+ |
37 |
Гликоген |
+ |
|
13 |
D-маноза |
+ |
38 |
Ксилит |
‒ |
|
14 |
L-сорбоза |
‒ |
39 |
β-генцибиоза |
‒ |
|
15 |
Рамноза |
‒ |
40 |
D-тураноза |
‒ |
|
16 |
Галактит |
‒ |
41 |
D-ликсоза |
‒ |
|
17 |
Инозитол |
+ |
42 |
D-тагатоза |
+ |
|
18 |
Манитол |
+ |
43 |
D-фукоза |
‒ |
|
19 |
Сорбитол |
+ |
44 |
L-фукоза |
‒ |
|
20 |
α-метил-D-манозид |
‒ |
45 |
D-арабит |
‒ |
|
21 |
α-метил-D- глюкозид |
+ |
46 |
L-арабит |
‒ |
|
22 |
N-ацетил-глюкозоамин |
‒ |
47 |
Глюконат |
‒ |
|
23 |
Амигдалин |
+ |
48 |
2-кето-глюконат |
‒ |
|
24 |
Арбутин |
+ |
49 |
5-кето-глюконат |
‒ |
|
25 |
Эскулин |
+ |
50 |
Контроль |
‒ |
Данные, представленные в таблице 2, свидетельствуют о том, что грамположительные палочки ферментируют: глицерол, L-арабинозу, рибозу, D-ксилозу, D-глюкозу, D-фруктозу, D-маннозу, инозитол (циклогексан-1,2,3,4,5,6-гексол), маннитол, сорбитол (глюцит),α-метил-D-маннозид, амигдалин, арбутин (бета-D-глюкопиранозид), эскулин, салицин. Штамм бактерий обладает способностью вырабатывать целлобиозу (4-(β-глюкозидо)-глюкоза), мальтозу, сахарозу, трегалозу, крахмал, глюкоген, туранозу. Данные биохимические характеристики соответствуют виду Bacillus licheniformis на 98%, а тест на вид Bacillus subtilis показал принадлежность к таксону данного микроорганизма на 1,1%.
Таким образом, стандартизированные тест-системы API 50 CH и API 20 позволили провести комплекс биохимических исследований и за короткий промежуток времени (24 часа) определить видовую принадлежность грамположительных палочек рода Bacillus, выделенных из говяжьего мяса.
Изучали резистентность выделенного штамма к антибиотикам. Истинная природная устойчивость характеризуется отсутствием у микроорганизмов мишени действия антибиотика или недоступности мишени вследствие первично низкой проницаемости либо ферментативной инактивации. Природная резистентность к антибиотикам является постоянным видовым признаком микроорганизмов и легко прогнозируется. В связи с этим установление резистентности микроорганизмов является актуальным, так как позволяет упростить работы со штаммом в производственных масштабах.
Результаты анализа устойчивости штамма к антибиотикам представлены на рисунке 1 в таблице 3.
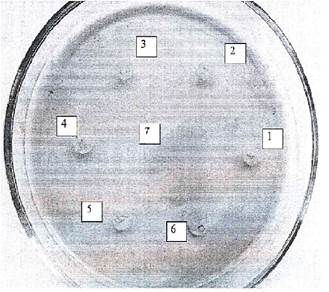
Рисунок 1. Антибиотическая устойчивость штамма Bacillus licheniformis: 1 – хлорамфеникол, 2 – стрептомицин, 3 – тетрациклин, 4 – канамицин, 5 – пенициллин, 6 – лизоцим, 7 – контроль
Таблица 3
Показатели антибиотической устойчивости Bacillus licheniformis
|
№ |
Наименование антибиотика |
Концентрация антибиотика, % |
Зона ингибирования роста бактерий, R, см |
|
1 |
Хлорамфеникол |
0,4 |
1,5 |
|
2 |
Стрептомицин |
0,4 |
1,3 |
|
3 |
Тетрациклин |
0,4 |
2,5 |
|
4 |
Канамицин |
0,4 |
2,2 |
|
5 |
Пенициллин |
0,4 |
1,7 |
|
6 |
Лизоцим |
0,4 |
0,3 |
|
7 |
Контроль |
0 |
- |
Из представленных данных (рисунок 1, таблица 3) следует, что микроорганизмы не обладают природной устойчивостью к пяти изученным антибиотикам (хлорамфеникол, стрептомицин, тетрациклин, канамицин, пенициллин), так как радиус зоны ингибирования составляет от 1,3 до 2,5 см. Однако микроорганизмы проявляют переменную устойчивость к антибиотику лизоцим. Так, на третьи сутки зона ингибирования составляет 0,3 см, а на седьмые сутки полностью исчезает и культура свободно растет на плашке с лизоцимом. Таким образом, штамм Bacillus licheniformis обладает устойчивостью к лизоциму, который на ранних стадиях развития культуры снижает скорость развития, но не ингибирует данный штамм.
Из литературных источников известно, что штамм Bacillus licheniformis является продуцентом фермента с кератинолитическим действием, избирательно расщепляющего кератин перьев и практически не действующего на кератин шерсти животных.
В связи с этим исследовали кератинолитическую активность выделенного штамма при оптимальной температуре 37°С (рисунок 2).
Из рисунка 2 следует, что штамм, выделенный из мяса крупного рогатого скота обладает высокой кератинолитической активностью, величина которой увеличивается с ростом продолжительности культивирования. Так, при продолжительности культивирования 2 ч активность равна 2,3 ед/мл, в то время как при продолжительности культивирования 24 ч – 5,0 ед/мл.
Полученные результаты свидетельствуют о возможности использования штамма Bacillus licheniformis в качестве источника кератиназы с высокой активностью.
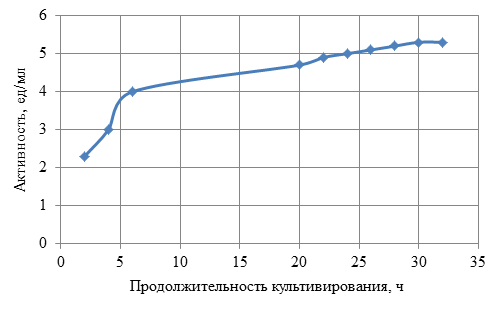
Рисунок 2. Кератинолитическая активность выделенного штамма в зависимости от продолжительности культивирования
Заключение
Изучены фенотипические свойства штамма, выделенного из мяса крупного рогатого скота. В результате анализа фенотипических свойств установлено, что выделенные микроорганизмы являются грамположительными палочками, образующими споры, и принадлежат к роду Вacillus. Проанализированы биохимические свойства изучаемого штамма, на основании которых выявлено, что микроорганизмы на 98% соответствуют виду Bacillus licheniformis. Изучена резистентность выделенного штамма Bacillus licheniformis к антибиотикам. Показано, что микроорганизмы не обладают антибиотическим действием по отношению к хлорамфениколу, стрептомицину, тетрациклину, канамицину и пенициллину, но устойчивы к лизоциму. Исследована кератинолитическая активность выделенного штамма. Установлено, что Bacillus licheniformis, выделенный из мяса крупного рогатого скота, обладает высокой кератинолитической активностью. Полученные результаты свидетельствуют о возможности использования штамма Bacillus licheniformis в качестве источника кератиназы с высокой активностью.
Работа выполнена при финансовой поддержке Российского Фонда фундаментальных исследований, конкурс «мол_ин_нр», договор № НР 13-08-90902/13.
Рецензенты:
Просеков А.Ю., д.т.н., профессор, заведующий кафедрой «Бионанотехнология», ФГБОУ ВПО «Кемеровский технологический институт пищевой промышленности», г. Кемерово.
Сидорин Ю.Ю., д.ф.-м.н., доцент, профессор-консультант Научно-образовательного центра, ФГБОУ ВПО «Кемеровский технологический институт пищевой промышленности», г.Кемерово.
Библиографическая ссылка
Бабич О.О., Касымов С.К., Линник А.И., Митрохин П.В., Кригер О.В. ИДЕНТИФИКАЦИЯ И АНАЛИЗ БИОХИМИЧЕСКИХ СВОЙСТВ ШТАММА-ПРОДУЦЕНТА КЕРАТИНАЗЫ // Современные проблемы науки и образования. – 2013. – № 6. ;URL: https://science-education.ru/ru/article/view?id=10999 (дата обращения: 20.04.2024).



