Введение
Использование функциональных проб в оценке функционального состояния различных систем позволяет нормировать изучаемые показатели для снижения влияния на них межиндивидуальной вариабельности, однако в клинической практике в оценке состояния проводящих свойств периферической нервной системы функциональные пробы практически не используются.
Актуальность исследования обусловлена тем, что индивидуальная оценка абсолютных показателей невральной проводимости в клинической практике является недостаточно надёжной в связи с высокой межиндивидуальной вариабельностью их значений. В эксперименте на животных и клиническом эксперименте для оценки резервных возможностей нервов используется так называемая «турникетная проба», заключающаяся в кратковременной локальной ишемии конечности [4, 6, 7, 8, 11]. Большинство работ посвящено экспериментальным исследованиям на животных, в клинической практике эта проба практически не используется, имеются единичные публикации по применению этой пробы в клинике. Турникетная компрессия нерва в клинике в основном используется для оценки возможных осложнений при хирургическом пособии и моделировании компрессии нерва при туннельных синдромах [7], а также как модель для оценки переживаемости нерва в условиях гипоксии и влияние её на показатели невральной проводимости и невральной возбудимости у человека [2, 5, 6].
По данным литературы большинство клинических экспериментальных исследований с «турникетной пробой» проведено у взрослых на верхней конечности на уровне плеча [5, 7, 9], единичные работы посвящены исследованиям компрессии нерва у взрослых на уровне предплечья [2], а также исследованиям у детей на уровне плеча [3]. Известно, что невральная проводимость в условиях патологии имеет большие изменения на дистальном участке нерва, проявляющиеся в значительном увеличении терминальной и резидуальной латентностей, имеющем место при воспалительных, дисметаболических и наследственных полиневропатиях. Учитывая эти обстоятельства, а также то, что неприятные болезненные ощущения при компрессии нерва уменьшаются при уменьшении объема ишемизированной ткани, компрессию нерва целесообразно проводить на более дистальном участке конечности – предплечье. Каковы закономерности изменения невральной моторной проводимости и диагностические возможности компрессионной пробы у детей при проведении компрессии нерва на предплечье, остаётся до настоящего времени не изученным.
Цель исследования – изучить надёжность, информативность и диагностическую значимость использования тестовой локальной ишемии периферического нерва на предплечье у детей в условиях клинического эксперимента по данным невральной проводимости.
Материалы и методы
Проведено электронейромиографическое (ЭНМГ) исследование с оценкой скорости проведения импульса (СПИ) по моторным волокнам локтевого нерва у 10 здоровых детей (1 группа) в возрасте от 6 до 15 лет (10,7±2,6) и 5 детей с перенесенной воспалительной полинейропатией (ПНП) (2 группа) в возрасте от 12 до 17 лет (15,2±2,2 лет) в семи временных срезах: до ишемической пробы, на 2, 5, 10 минутах пробы и на 1, 5, 10 минутах после ишемии. Дети второй группы имели сниженные показатели невральной проводимости вследствие перенесённой в анамнезе воспалительной полинейропатии в сроках от 60 до 180 дней, в среднем 57 дней. Исследование проводилось в экранируемом кабинете с постоянной контролируемой температурой (в среднем 24 °C).
ЭНМГ исследование проводилось на многофункциональном комплексе для проведения нейрофизиологических исследований «Нейрон-Спектр-5» производства фирмы «Нейрософт» (Россия). Проводилась супрамаксимальная стимуляция локтевого нерва прямоугольными электрическими импульсами (0,1 мс) дистально C1 (запястье) и проксимально C2 (локоть) относительно компрессионной манжеты. Запись моторных ответов (М-ответов) и оценка их латентностей с оценкой СПИ по моторным волокнам осуществлялась с m. abductor digiti minimi. Активный электрод накладывался на брюшко мышцы, референтный – на наружную поверхность пястно-фалангового сустава V пальца. Заземляющий электрод накладывался между стимулирующим и отводящим электродами.
Кратковременная ишемия конечности создавалась с помощью манжеты сфигмоманометра [2,7]. Манжета, шириной 14 см, накладывалась на предплечье. Давление в манжете нагнеталось на 20–30 мм рт. ст. выше систолического давления (в среднем 140–160 мм рт. ст.) и поддерживалось в течение 10 минут (рис. 1). Проводился контроль температуры кожи гипотенара с помощью инфракрасного термометра, температура кожи поддерживалась выше 30 °C с помощью грелки, укрытия исследуемой конечности махровой тканью.


Рис. 1. Слева: расположение электродов и манжеты сфигмоманометра на предплечье. Справа: схематическая позиция стимулирующих электродов и пневматической манжеты. С – стимулирующий электрод, Р – регистрирующие электроды, Nu – локтевой нерв, ADM – m. abductor digiti minimi
Изучались показатели СПИ в разные временные срезы проведения компрессионной пробы, оценка СПИ проводилась по стандартной формуле: V= ![]() (м/с), где V – СПИ, S – расстояние между стимулирующими электродами, T2 – латентный период М-ответа при стимуляции в проксимальной точке, T1 – латентный период М-ответа при стимуляции в дистальной точке. СПИ рассчитывалась до ишемии, на 2, 5, 10 минутах пробы и на 1, 5, 10 минутах после пробы. Степень изменения СПИ на локальную ишемию от фонового значения, выраженная в процентах, характеризовала динамику снижения невральной проводимости на кратковременную ишемию.
(м/с), где V – СПИ, S – расстояние между стимулирующими электродами, T2 – латентный период М-ответа при стимуляции в проксимальной точке, T1 – латентный период М-ответа при стимуляции в дистальной точке. СПИ рассчитывалась до ишемии, на 2, 5, 10 минутах пробы и на 1, 5, 10 минутах после пробы. Степень изменения СПИ на локальную ишемию от фонового значения, выраженная в процентах, характеризовала динамику снижения невральной проводимости на кратковременную ишемию.
Статистический анализ и обработка полученных данных СПИ проводились с помощью программного обеспечения STATISTICA, 10 версия (StatSoft, Inc., Tulsa, USA). По каждой группе и временному срезу проведения компрессионной пробы просчитывались среднее арифметическое значение, стандартное отклонение, достоверность снижения СПИ на ишемию непараметрическим критерием Вилкоксона и достоверность различия между группами непараметрическим U-критерием Манна – Уитни. Уровень значимости p-значения был принят <0,05.
Результаты
Исходно СПИ у здоровых испытуемых составляла от 54,7 до 70,0 (61,0±4,6) м/с, у детей с ПНП скорость проведения была достоверно ниже: от 32,9 до 51,4 (43,5±7,4) м/с (p<0,05).
В течение 10 минут ишемии происходило постепенное снижение СПИ в обеих группах. Уже на 2 минуте ишемии в 1 группе наблюдалось достоверное, по сравнению с фоном, снижение СПИ до 59,3±4,9 м/с (p<0,05), которое нарастало и было максимальным на 10 минуте ишемии – 55,6±3,9 м/с (p<0,05). Достоверное снижение СПИ во 2 группе имело место только на 10 минуте 41,8±7,5 м/с (p<0,05) (табл. 1). После снятия компрессии в 1 группе отмечалось быстрое достоверное повышение СПИ уже к 1 минуте, с практически полным восстановлением исходных значений к 10 минуте после ишемии – 59,6±4,4 м/с (p<0,05 по сравнению с 10 минутой ишемии). Во 2 группе после снятия компрессии изменение СПИ было недостоверно вплоть до 10 минуты после ишемии, однако имело тенденцию к повышению (p>0,05) (табл. 1).
Таблица 1
Показатели СПИ (м/с) у здоровых и детей с ПВПНП до, во время и после компрессионной ишемии (M±σ)
|
Этапы теста |
Здоровые, n=10 |
ПВПНП, n=5 |
|
До ишемии |
61,0±4,6 |
43,5±7,4 |
|
2 минута ишемии |
59,3±4,9* |
43,3±6,9 |
|
5 минута ишемии |
57,5±4,2* |
43,2±7,3 |
|
10 минута ишемии |
55,6±3,9* |
41,8±7,5* |
|
1 минута после ишемии |
58,5±4,7# |
41,3±8,8 |
|
5 минута после ишемии |
59,0±4,2# |
42,1±7,8 |
|
10 минута после ишемии |
59,6±4,4# |
43,3±9,4 |
*Достоверно значимое снижение СПИ по отношению к фоновым значениям (р<0,05).
#Достоверно значимое повышение СПИ по отношению к 10 минуте ишемии (р<0,05).
Сравнение динамики СПИ в двух исследуемых группах показывает значительно сниженную реактивность изменения СПИ при ПВПНП по сравнению со здоровыми испытуемыми. Вместе с тем графики зависимости изменения невральной проводимости от длительности ишемии нерва на предплечье имеют закономерную U-образную форму как в первой, так и во второй группах. Однако у детей 1 группы форма кривых имеет более яркую динамику (рис. 2), а во второй группе менее выраженную (рис. 3).
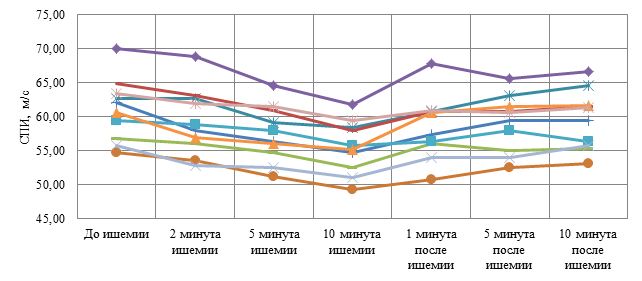
Рис. 2. Графики изменения СПИ моторной по локтевому нерву в ответ на локальную ишемию предплечья у здоровых детей (n=10) до, во время и после ишемии
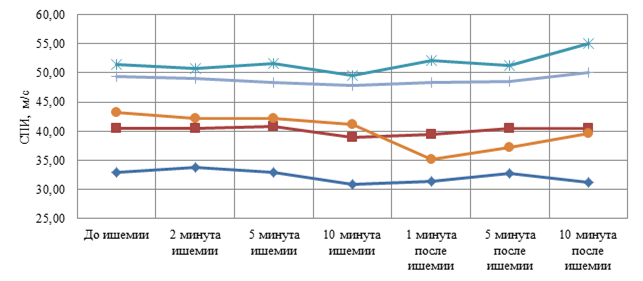
Рис. 3. Графики изменения СПИ моторной по локтевому нерву в ответ на локальную ишемию предплечья у детей с ПВПНП (n=5) до, во время и после ишемии
Для нормирования изменения индивидуальных показателей в группах расчёт динамики СПИ был проведен в процентах от фоновых значений и позволил характеризовать степень изменения невральной проводимости на кратковременную ишемию. На высоте ишемии (10 минут) СПИ в 1 группе снижалась на 6,1–11,9 %, составляя в среднем 8,8±2,2 %. Во 2 группе на максимальной длительности ишемии (10 минут) СПИ снижалась только на 3,3–5,9 %, составляя в среднем 4,3±1,1 % (рис. 4). Таким образом, степень снижения невральной проводимости во второй группе на 51 % достоверно меньше (p<0,05), чем у здоровых детей.
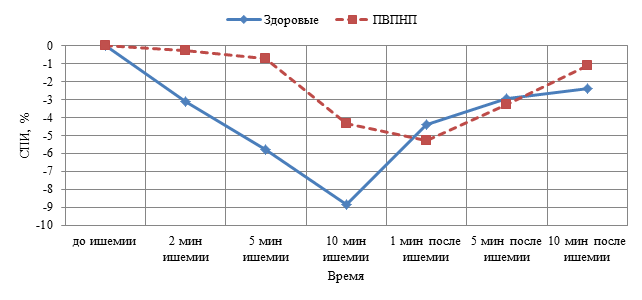
Рис. 4. Средние значения динамики снижения невральной проводимости у здоровых детей (n=10) и у детей с ПВПНП (n=5) во время и после ишемии
Все дети во время проведения турникетной пробы на 1–2 минуте ишемии в области компрессии описывали лёгкий дискомфорт и парестезии, сохранявшиеся на всём протяжении пробы. Сразу после снятия компрессии в области кисти возникали парестезии в виде покалывания, которые исчезали через 3–5 минут после появления.
Обсуждение
Полученные показатели динамики СПИ по моторным волокнам локтевого нерва при компрессии на предплечье у здоровых детей имеют U-образную форму и согласуются с полученными данными у взрослых при компрессии нерва на плече [7]. Значимое снижение СПИ на компрессию нерва на предплечье у детей в норме происходит уже на 2 минуте ишемии, однако более значимое снижение происходит на 10 минуте. Использовать более длительную по времени ишемию не целесообразно, так как это требует большего времени исследования, продолжительной стимуляции нерва и будет вызывать выраженные болезненные ощущения.
Максимальное снижение СПИ на 10 минуте ишемии у здоровых детей составило 8,8±2,2 %, что почти в 2 раза меньше по сравнению со снижением СПИ на компрессию нерва на уровне плеча у взрослых, которое составляет – 15,6 % [7]. По данным Bostock H. (1994), изучавшего состояние проводимости по дистальной латентности, снижение этого показателя при компрессии нерва на предплечье по расчётам представленного графика составляет ~7 %, что соизмеримо с полученными нами показателями. Меньшее снижение СПИ на ишемию на предплечье по сравнению со снижением на компрессию на уровне плеча может быть обусловлено меньшей миелинизацией нерва на дистальном участке по сравнению с проксимальным участком или связано с возрастным фактором, что требует дальнейшего изучения.
Исследования, проведенные в эксперименте на животных с последующей электронной микроскопией участков нерва, показали, что при давлении 1000 мм рт. ст. и выше развивается паранодальная демиелинизация, а при давлении 250 мм рт. ст. структурных изменений не наблюдается, развивается только обратимый физиологический блок [10]. Таким образом, применявшееся нами в настоящем исследовании давление, создаваемое в пневматической манжете (140–160 мм рт. ст.) с длительностью компрессии (10 минут) безопасно для функции нервных волокон.
Исследования невральной проводимости на локальную ишемию при ПНП в доступном нам объеме литературы не найдены. Направленность и степень изменения невральной проводимости при нейропатии на компрессионную пробу изучалась только при карпальном туннельном синдроме у взрослых. В работе Fullerton P. M. (1963) показано, что при длительной 30 минутной компрессии срединного нерва дистальная латентность была выше при нейропатии у взрослых в среднем на 6,2 % по сравнению с нормой, т. е. невральная проводимость по данным латентности на дистальном участке нерва при нейропатии имела более высокую реактивность, чем в норме. Динамика СПИ, по полученным в настоящем исследовании данным у детей, имела меньшую реактивность невральной в проводимости, чем в норме. Эти противоречивые данные требуют дальнейшего параллельного исследования СПИ и латентностей М-ответов у детей и взрослых, в норме и при различных нейропатиях.
Выводы
- 10-минутная невральная ишемия на уровне предплечья у детей является диагностически информативной, хорошо переносимой для надёжной оценки реактивной динамики невральной проводимости как в норме, так и при ПВПНП.
- Транзиторная локальная ишемия нерва на предплечье у здоровых детей вызывает закономерную U-образную форму динамики СПИ по моторным волокнам с менее значимым снижением проводимости (на 8,8 %) по сравнению с показателями у взрослых при компрессии нерва на плече (снижение на 15,6 % по данным литературы).
- При нейропатии с исходно сниженной невральной проводимостью имеет место менее выраженное снижение невральной проводимости (на 51 %), чем у здоровых детей (p<0,05).
- Турникетная компрессия локтевого нерва на предплечье в течение 10 минут не вызывает субъективных значимых негативных ощущений и может быть использована для стандартизованной оценки невральной проводимости у детей в условиях нормы и патологии.
Список сокращений
М-ответ – моторный ответ.
ПВПНП – перенесенная воспалительная полинейропатия.
СПИ – скорость проведения импульса.
ЭНМГ – электронейромиография.
Рецензенты:
Суворов Н. Б., д.б.н., профессор кафедры биотехнических систем Санкт-Петербургского государственного электротехнического университета “ЛЭТИ”, г.Санкт-Петербург.
Иванова Г. П., д.м.н., руководитель – ведущий научный сотрудник отдела интенсивной терапии неотложных состояний ФГБУ НИИ детских инфекций ФМБА России, г.Санкт-Петербург.
Библиографическая ссылка
Климкин А.В., Команцев В.Н., Скрипченко Н.В., Войтенков В.Б. ЛОКАЛЬНАЯ ИШЕМИЯ НЕРВА В ОЦЕНКЕ НЕВРАЛЬНОЙ МОТОРНОЙ ПРОВОДИМОСТИ У ДЕТЕЙ // Современные проблемы науки и образования. – 2013. – № 5. ;URL: https://science-education.ru/ru/article/view?id=10284 (дата обращения: 19.04.2024).



