Введение
Несмотря на тенденцию к снижению заболеваемости раком желудка, он остается одной из самых распространенных форм злокачественных опухолей. В России в структуре онкозаболеваемости рак желудка занимает 3-е место после рака легкого и кожи, и 2-е место в структуре смертности после рака легкого [2]. Основным методом радикального лечения больных раком желудка является хирургический, но даже при местной распространенности опухолевого процесса радикальность оперативных вмешательств составляет 30-40% [3].
Для улучшения результатов лечения разрабатываются методы, включающие химиолучевое лечение, однако их возможности ограничены резистентностью опухоли, низкой толерантностью окружающих тканей и высокой токсичностью химиопрепаратов [5]. Поэтому важным подходом при лечении больных раком желудка являются способы введения и доставки химиопрепаратов к опухоли [6]. Перспективным направлением является применение различных модуляторов, повышающих эффективность химиопрепаратов и влияющих на результаты лечения, к которым относится и озонотерапия.
Местное и системное парентеральное применение озонированных растворов в комплексном лечении различной патологии вызывает, наряду с другими позитивными эффектами, благоприятную динамику системных и локальных иммунологических параметров. Исследования показали, что применение озона приводит к повышению уровня SIgА в слезной жидкости, нормализации показателей Т- и В-клеточного звеньев иммунной системы, снижению содержания провоспалительных цитокинов (TNF-α, IL-1α, IL-6) и лактоферрина в крови и в ликворе на фоне возрастания уровня противовоспалительного цитокина IL-4 в ликворе [4; 7; 8]. Включение озонотерапии в комплексное лечение онкологических больных способствует не только получению клинического эффекта, но и запуску апоптоза [1]. Кроме того, описано снижение при озонотерапии сывороточного уровня sHLAI, вызывающего апоптоз CD3+CD8+ (CTL), чем можно объяснить протекторное действие озона на цитотоксические Т-лимфоциты, а также указано на стимуляцию экспрессии рецепторов CD50 и CD71 (участвующих в адгезии и активации) на мононуклеарных клетках [9].
Таким образом, имеется ряд данных об участии иммунной системы в реализации эффектов озонотерапии при различных заболеваниях. Ее иммунотропное действие может быть вторичным по отношению к антимикробному и противовоспалительному, но может и играть существенную самостоятельную патогенетическую роль при онкологических заболеваниях, демонстрируя разнонаправленное влияние на апоптоз опухолевых и мононуклеарных клеток.
Цель
Изучить влияние интраоперационной химиотерапии с озонированными средами на состояние локального иммунитета у больных резектабельным раком желудка.
Материал и методы
Проанализированы данные о 60 больных III стадией местно распространенного рака желудка, которым была выполнена радикальная гастрэктомия с расширенной лимфодиссекцией в объеме D2 в отделении общей онкологии ФГБУ «РНИОИ» МЗ РФ.
Больные были распределены на две группы. Основную группу составили 30 больных, которым проведено лечение, включающее радикальную операцию с интраоперационной химиотерапией с озонированными средами. Контрольную группу составили 30 больных, которым проведено лечение, включающее радикальную операцию без интраоперационного воздействия.
Сравнительная характеристика групп больных по возрасту, полу, гистологической структуре и степени распространенности опухоли, сопутствующей патологии не выявила достоверных различий, что позволило провести анализ результатов лечения.
Для проведения лечения с применением химиотерапии с озонированными средами больным основной группы при проведении стандартной гастрэктомии, после мобилизации желудка, выделяли левую желудочную артерию и вену, их перевязывали и пересекали. Левые желудочно-сальниковые сосуды и короткие желудочные сосуды не пересекали, по ним осуществлялся сброс крови и препаратов в общий кровоток. Катетеризировали культю левой желудочной артерии, вводили 50 мл озонированного физиологического раствора (концентрация озона - 1000 мкг/л) в течение 5 минут. Через 5 мин вводили оксалиплатин в дозе 85 мг/м2 на 150 мл 5%-ной глюкозы. После 30-минутной экспозиции выполняли гастрэктомию. Также во время операции внутривенно вводили 100 мл озонированной аутокрови (с концентрацией озона 400 мкг/л) со скоростью 40 капель в минуту. С интервалом 5 минут вводили лейковорин 100 мг/м2 и 5-фторурацил 500 мг/м2 (получен патент РФ № 2428993. 2011. Бюл. № 26).
Дальнейший ход операции осуществлялся по стандартной методике и не имел отличий от проведения больным контрольной группы.
Проводилось плановое морфологическое исследование удаленного желудка и лимфатических узлов. Гистологический материал фиксировали в 10%-ном нейтральном формалине со стандартной проводкой, заливкой в парафин и окраской гематоксилином и эозином. В выделенных образцах ткани опухоли, перитуморальной зоны (на расстоянии 3 см от опухоли) и линии резекции проводилось иммунофенотипирование субпопуляций лимфоцитов методом проточной цитофлюориметрии. Определяли субпопуляционный состав Т- (Т-общие - CD3+, хелперно-индукторные - CD4+-, цитотоксические - CD8+) и В-лимфоцитов (CD19+), а также натуральных киллеров NK (CD16+CD56+).
Результаты и обсуждение
Морфологическое исследование показало, что в основной группе по линии резекции отмечается повышенная лимфоцитарная инфильтрация (рисунок 1). Морфологическая картина опухоли характеризовалась наличием выраженного отека вокруг желудочных желез и пластов опухолевых клеток (рисунок 1).
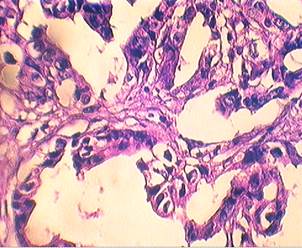
х 400 Выраженный отек вокруг опухолевых клеток и желез
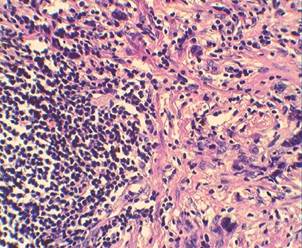
х 200. Выраженная лимфоцитарная инфильтрация по линии резекции
Рисунок 1. Морфологическая картина рака желудка после применения химиотерапии с озонированными средами (окраска гематоксилином-эозином)
Обращало внимание изменение структуры опухолевых клеток: увеличение в размерах ядер с дистрофическими и некробиотическими признаками, появление в цитоплазме вакуолей. Отмечалось незначительное содержание нейтрофилов и повышенная агранулоцитарная инфильтрация со значительным преобладанием лимфоцитов – признака локальных иммунных реакций. В контрольной группе описанных изменений не наблюдалось.
Различия состава субпопуляций лимфоцитов в соответствующих образцах тканей больных основной и контрольной группы представлены в таблице 1. Результаты исследования показали, что у больных контрольной группы в ткани опухоли содержится статистически значимо меньше зрелых Т-клеток по сравнению с тканью линии резекции и перитуморальной зоны. Эта разница обусловлена более низким уровнем CD3+СD8+ клеток в ткани опухоли (в 2 раза меньшим, чем в ткани по линии резекции, и в 3 раза меньшим, чем в перитуморальной зоне). При этом в ткани опухоли и перитуморальной зоне присутствует значительное количество NК-клеток, в 2-3 раза превышающее их уровень по линии резекции. Содержание СD3+СD4+ клеток, а также СD19+(В-лимфоцитов) в опухоли соответствует их уровню по линии резекции, однако оно оказалось минимальным в перитуморальной зоне.
Уровень CD3+ во всех исследованных образцах тканей больных основной группы превышал уровень контрольной группы (p<0,05). Содержание CD3+CD4+ в опухоли является максимальным, достоверно превышая как показатель контрольного образца в 1,2 раза, так и линии резекции и перитуморальной области внутри группы в 1,1 раза. В ткани перитуморальной области количество CD3+CD4+ оказалось в 1,4 раза выше (p<0,05), чем в контрольном образце. Содержание CD3+CD8+ в опухоли при действии химиотерапии с озонированными средами было хотя и ниже в 1,4 раза (p<0,05), чем в ткани по линии резекции, но в 2,2 раза выше (p<0,05), чем в контроле. Уровень В-клеток по линии резекции оказался в 3,6 раза ниже, чем в контроле, а уровень CD16+CD56+ – в 2,6 раза выше (p<0,05). Количество NK-клеток в ткани опухоли и перитуморальной области основной группы было достоверно ниже в 1,3 и 1,5 раза, чем по линии резекции.
Таблица 1
Уровень субпопуляций лимфоцитов в ткани опухоли желудка, перитуморальной зоне и линии резекции у больных основной и контрольной группы
|
Показатель, % |
Основная группа (n=30) |
Контрольная группа (n=30) |
||||
|
ткань опухоли |
пери-туморальная зона |
линия резекции |
ткань опухоли |
пери-туморальная зона |
линия резекции |
|
|
CD3+ |
66,1±6,23 |
65,9±5,93 |
70,2±5,73 |
46,7±3,01,2 |
56,1±3,8 |
59,7±4,4 |
|
CD3+CD4+ |
44,4±2,71,2,3 |
38,2±3,43 |
38,0±2,9 |
35,8±3,22 |
27,0±2,91 |
38,1±3,3 |
|
CD3+CD8+ |
21,0±4,01,3 |
24,8±3,5 |
30,5±3,73 |
9,5±2,81,2 |
27,2±3,8 |
19,8±5,4 |
|
CD19+ |
16,5±4,21,3 |
18,3±3,71 |
8,2±3,23 |
29,7±4,12 |
18,1±3,71 |
29,7±3,5 |
|
CD16+CD56+ |
16,0±3,11 |
15,1±3,31,3 |
22,4±3,23 |
22,0±4,21 |
23,1±3,71 |
8,4±3,8 |
Примечание:
1 - статистически достоверные отличия от линии резекции (p<0,05);
2 - статистически достоверные отличия от перитуморальной зоны (p<0,05);
3 - статистически достоверные отличия от контрольной группы (p<0,05).
Поскольку лечебное воздействие в виде химио- и озонотерапии является интраоперационным, состояние ткани, расположенной по линии резекции, имеет, на наш взгляд, наибольшее значение для дальнейшего течения заболевания. В связи с этим следует обратить особое внимание на выраженные благоприятные отличия локального клеточного иммунитета именно этой области. Применение предлагаемого нами варианта лечения способствует позитивным изменениям факторов локального иммунитета в немалигнизированной ткани линии резекции, а именно приводит к значительному повышению содержания лимфоцитов, способных к проявлению цитотоксической активности и относящихся к факторам как врожденного (NК), так и адаптивного (CTL CD3+CD8+) иммунитета, хотя они и являются рециркулирующими клетками.
Итак, полученные результаты свидетельствуют о том, что проведение интраоперационной регионарной и системной химиотерапии с применением озонированных сред влияет не только на состояние опухоли, но и прилежащих тканей, включая перитуморальную зону и линию резекции.
При оценке ближайших результатов лечения больных основной группы в сроки наблюдения от 18 до 24 месяцев установлено, что признаки генерализации опухолевого процесса наблюдались у 7 (23,3%) больных. Показатели локального иммунитета этих больных были сопоставлены с теми, у кого была показана положительная клиническая динамика без признаков прогрессирования заболевания (таблица 2-4).
Таблица 2
Уровень субпопуляций лимфоцитов в ткани опухоли у больных основной группы с различным клиническим эффектом
|
Показатель, % |
Основная группа больных (n=30) |
||
|
вся группа |
положительный эффект (n=23) |
отсутствие эффекта (n=7) |
|
|
CD3+ |
66,1±6,2 |
68,8±3,21 |
57,2±5,7 |
|
CD3+CD4+ |
44,4±2,7 |
44,8±2,01 |
38,2±2,3 |
|
CD3+CD8+ |
21,0±4,0 |
22,0±3,61 |
17,4±3,5 |
|
CD19+ |
16,5±4,2 |
15,2±3,31 |
20,8±3,9 |
|
CD16+CD56+ |
16,0±3,1 |
14,6±2,11 |
20,5±3,2 |
Примечание:
1 – статистически достоверные отличия в зависимости от клинического эффекта, в пределах группы (p<0,05).
Таблица 3
Уровень субпопуляций лимфоцитов в перитуморальной зоне у больных основной группы с различным клиническим эффектом
|
Показатель, % |
Основная группа больных (n=30) |
||
|
вся группа |
положительный эффект (n=23) |
отсутствие эффекта (n=7) |
|
|
CD3+ |
65,9±5,9 |
68,1±2,71 |
58,5±7,8 |
|
CD3+CD4+ |
38,2±3,4 |
39,3±2,41 |
34,8±4,1 |
|
CD3+CD8+ |
24,8±3,5 |
26,0±2,41 |
21,1±4,0 |
|
CD19+ |
18,3±3,7 |
17,2±3,01 |
21,8±3,8 |
|
CD16+CD56+ |
15,1±3,3 |
13,9±1,51 |
18,8±4,8 |
Примечание:
1 – статистически достоверные отличия в зависимости от клинического эффекта, в пределах группы (p<0,05).
Таблица 4
Уровень субпопуляций лимфоцитов по линии резекции у больных основной группы с различным клиническим эффектом
|
Показатель, % |
Основная группа больных (n=30) |
||
|
вся группа |
положительный эффект (n=23) |
отсутствие эффекта (n=7) |
|
|
CD3+ |
70,2±5,7 |
71,7±2,01 |
65,5±10,7 |
|
CD3+CD4+ |
38,0±2,9 |
38,4±1,5 |
36,5±5,5 |
|
CD3+CD8+ |
30,5±3,7 |
31,6±1,91 |
26,7±5,6 |
|
CD19+ |
8,2±3,2 |
7,0±1,31 |
11,7±5,0 |
|
CD16+CD56+ |
22,4±3,2 |
22,2±1,7 |
23,5±6,2 |
Примечание:
1 – статистически достоверные отличия в зависимости от клинического эффекта, в пределах группы (p<0,05).
Как видно из представленных таблиц 2-4, при отсутствии эффекта у больных основной группы в опухоли, перитуморальной зоне и по линии резекции отмечены наиболее низкие (p<0,05) (таблица 2-3), показатели Т-клеток (CD3+, CD3+CD4+, CD3+CD8+), а уровни В- (CD19+) и NК- (CD16+CD56+) клеток были максимальными (p<0,05) (таблица 2-3). В целом у больных основной группы при отсутствии эффекта наблюдается сходная картина с больными контрольной группы, хотя показатели были выше, чем в последней.
Итак, можно предположить, что эффективность лечения основной группы больных связана с уровнем клеточных факторов локального иммунитета, среди которых основную роль играет накопление в исследуемых образцах тканей Т-лимфоцитов с рецепторами CD3+, CD3+CD4+, CD3+CD8+.
Таким образом, полученная характеристика факторов локального клеточного иммунитета при раке желудка свидетельствует о влиянии на них предложенного метода лечения. Это влияние развивается быстро (в течение 30-минутной инкубации в оперируемом органе) и, по-видимому, не может быть связано с пролиферацией лимфоцитов и их миграцией из лимфоидных органов. Тем не менее усиление их миграции из сосудов микроциркуляторного русла представляется возможным, с учетом влияния озона на проницаемость сосудистой стенки или на адгезивные свойства эндотелия. Вероятно, некоторые из разновидностей лимфоцитов оказались более чувствительными к введению оксалиплатина и озонированных сред. Скорее всего, это В-клетки, уровень которых в опухоли, и особенно в ткани по линии резекции, снижается по сравнению с контролем. При этом происходит перераспределение процентного содержания в пользу более устойчивых к примененным воздействиям клеток, в частности возрастает доля CD3+CD4+ и CD3+CD8+ в опухоли, что формирует локальное преобладание лимфоцитов Т-ряда, реализующих адаптивный клеточный иммунитет, над эффекторами адаптивного гуморального (В-клетки) и врожденного клеточного (NK) иммунитета.
Изменения в ткани линии резекции могут вносить значительный вклад в обеспечение длительности бессобытийного периода после хирургического этапа лечения. Поэтому важным является отмеченное нами выраженное повышение содержания Т-лимфоцитов за счет CTL, а также NК-клеток в ткани линии резекции основной группы. Мы предполагаем, что присутствие высокого числа этих клеток может способствовать предотвращению развития рецидивов, которое не наблюдалось у больных основной группы и встречалось у 2 (6,6%) больных контрольной группы.
Выводы
Применение интраоперационной химиотерапии с озонированными средами благоприятно влияет на состояние локального клеточного иммунитета, способствует усилению лимфоцитарной инфильтрации в изучаемых образцах тканей желудка по сравнению с контрольной группой, с преобладанием в ткани опухоли содержания лимфоцитов Т-ряда (CD3+CD4+ и CD3+CD8+ в 1,2 и 2,2 раза, соответственно, p<0,05), реализующих адаптивный клеточный иммунитет, над эффекторами адаптивного гуморального (В-клетки) и врожденного клеточного (NK) иммунитета; способствует выраженному повышению (p<0,05) в ткани линии резекции уровня Т-лимфоцитов на 17,5% за счет CTL (увеличение на 54%), и NК-клеток (увеличение в 2,6 раза).
Рецензенты:
Николаева Н.В., д.м.н., н.с. отделения онкогематологии ФГБУ «РНИОИ» Министерства здравоохранения Российской Федерации, асс. кафедры онкологии ГБОУ ВПО «РостГМУ» Министерства здравоохранения Российской Федерации, г. Ростов-на-Дону.
Каймакчи О.Ю., д.м.н., асс. кафедры онкологии ГБОУ ВПО «РостГМУ» Министерства здравоохранения Российской Федерации, г. Ростов-на-Дону.



