Введение
Одним из источников попадания аммиака в воздушную среду является его испарение через воздушки из емкостей, используемых для хранения аммиачной воды. Источники эти относительно малотоннажные, территориально разобщены, поэтому применение для очистки отходящих газов от аммиака абсорбционных, конденсационных и каталитических методов [3], освоенных на предприятиях азотной промышленности, не рационально, так как их использование подразумевает сооружение специальных установок.
Вполне приемлемым является адсорбционный метод при условии работы адсорбента в режиме аккумулирования аммиака на поверхности и в порах поглотителя. Применяемый в цехах синтеза аммиака для очистки сдувочных газов силикагель в связи гидрофильности непригоден для поглощения аммиака из влажных газов. В этом случае представляет интерес адсорбция аммиака активным углем [2]. Его преимуществами является гидрофобность, селективность, достаточно высокая адсорбционная емкость, способность к регенерации.
Для создания условий, обеспечивающих длительную работу адсорбента без регенерации, целесообразно использовать образцы угля, обладающие максимальной емкостью по аммиаку, что может быть достигнуто модификацией сорбента солями металлов, образующих устойчивые аммиакаты.
Цель работы
Цель работы состоит в разработке технологии модификации активного угля хлоридом меди и в изучении влияния содержания модификатора на адсорбционную емкость угля по аммиаку.
Методика эксперимента
Модификацию угля вели путем пропитки в колбе с мешалкой раствором хлорида меди (II). В эксперименте измеряли объем раствора, использованного для импрегнирования угля (V1,л), массу угля, помещенного в колбу (m1,г), концентрацию меди в растворе в начале опыта (C1,моль/л) и в конце опыта (C2,моль/л), плотности растворов в начале (ρ1, г/л) и в конце (ρ2, г/л) опыта. Величины V1 и m1 измеряли, соответственно, мерным цилиндром и взвешиванием с точностью до 0,1 г; концентрации меди находили путем йодометрии; плотность раствора определяли пикнометрическим методом [5]. По мере увеличения времени контакта угля и раствора (τ), концентрация меди убывает, так что dc/dτ стремится к нулю. Насыщение прекращали и суспензию угля в растворе солей меди расфильтровывали после установления равенства dc/dτ=0. Массу адсорбционной меди mcu, ммоль/г вычисляли из равенства
mcu=V1C1-V2C2·m1-1 (1)
В уравнении (1) V2 – конечный объем раствора. Его непосредственное определение затруднено вследствие неполноты разделения системы «активный уголь - водный раствор солей меди» и наличия потерь воды при таком разделении. Значение V2 определяли косвенным путем: уголь после насыщения медью просушивали на воздухе и взвешивали, определяя массу угля m2 после насыщения медью, привес угля m2 – m1 равен массе компонентов раствора (соли меди и воды), сорбированных углем; учитывая, что масса раствора до опыта равна произведению V1 ρ1 , имеем:
V2=[V1 ρ1 – (m2-m1)] ρ2 -1 (2)
Эксперимент по определению равновесной емкости угля по аммиаку вели динамическим методом на установке, представленной на рис. 1.
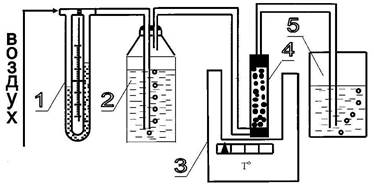
1 - водяной манометр; 2 - склянка Дрекселя; 3 - термостат; 4 - трубка с адсорбентом; 5 –гидрозатвор.
Рис. 1 Схема экспериментальной установки по поглощению аммиака.
Аммиачно-воздушную смесь подавали в реактор, заполненный активным углем АГ-3. Содержание аммиака в газе до и после реактора (соответственно Cам(1) и Cам(2)) определяли, пропуская пробу газа известного объема через дрекселя, заполненные 200 мл 0,5 н H2SO4. Концентрацию кислоты в дрекселе до и после пропускания пробы газа находим титрованием кислоты 0,5 н раствором NaOH в ячейке pH метра марки pH 210.
Результаты эксперимента
Зависимость равновесной емкости угля от концентрации модифицирующего раствора представлена в таблице 1. Исследование вели с использованием растворов с содержанием меди (II) менее 0,5 моль/л.
Таблица 1. Зависимость содержания меди в модифицированном угле от концентрации раствора пропитки при температуре 293 К.
|
Содержание меди в модифицированном угле, моль/г |
Содержание меди в растворе пропитки, моль/л |
|
0 |
0 |
|
0,001 |
0,045 |
|
0,002 |
0,112 |
|
0,0026 |
0,161 |
|
0,004 |
0,203 |
|
0,006 |
0,27 |
|
0,0079 |
0,35 |
|
0,008 |
0,41 |
Из таблицы видно, что до концентрации раствора порядка 0,08 моль/л равновесная емкость угля по меди растет практически линейно с ростом концентрации меди в растворе. С дальнейшим ростом концентрации меди емкость угля продолжает возрастать, асимптотически приближаясь к некоторому пределу. Насыщение угля солями меди даже при малых концентрациях раствора высоко селективно [4]. Так, например, для концентрации меди в модифицирующем растворе ≈10 г/л (0,16 моль/л) простое заполнение этим раствором адсорбционного объема пор угля (порядка 1 см3/г) соответствует содержанию меди на угле порядка 0,01 г/г; экспериментальная величина 0,2 г/г в 20 раз больше. При концентрации меди (II) в модифицирующем растворе около 0,2 моль/л на графике, отображающем изотерму адсорбции меди на угле, имеет место «ступенька», которая может указывать на переход от адсорбции в мономолекулярном слое к полимолекулярной адсорбции.
Анаморфоза графика, для построения которого использовались данные табл. 1, представлена на рис. 2 в обратных координатах, что позволяет определить емкость активного угля по хлориду меди (II) при гипотетической бесконечно большой концентрации раствора CuCL2 (мольная доля CuCL2 равна 1).
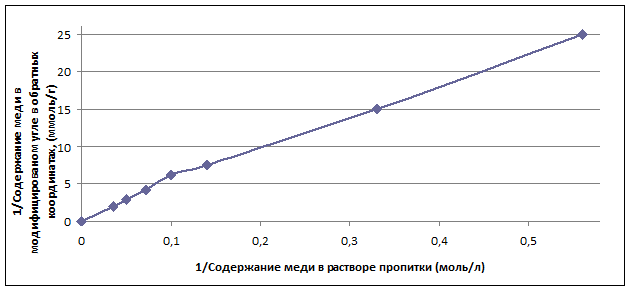
Рис. 2 Зависимость содержания меди в модифицированном угле от концентрации раствора пропитки в обратных координатах
Естественно, что такое состояние системы «CuCL2-H2O» не может иметь место, но для ряда технохимических расчетов может рассчитываться как некоторый предельный случай. Точка пересечения линейного графика с осью ординат показывает, что предельная емкость угля по меди (II) соответствует 0,25 г/г, что отвечает содержанию CuCL2 0,56 г/г. При плотности хлорида меди (II) 3,1 г/см3 предельный объем сорбтива в порах угля составляет 0,17 см3,что соизмеримо с объемом нанопор активного угля [1].
Материальные балансы опытов по импрегнированию активного угля раствором хлорида меди показывают, что разность V1 ρ1 – V2 ρ2, соответствующая убыли массы раствора, всегда больше, чем mcu , вычисляемая по уравнению (1). Это превышение убыли массы раствора над массой адсорбированной меди составляет 1,68÷2,25 г/г. Это соответствует связыванию меди (II) на угле не в виде ее хлорида (в этом случае превышение общей массы сорбированного вещества над массой связанной с углем меди не должно быть больше 1,12 г/г), а в виде гидратов CuCL2(2÷4)H2O. Это свидетельствует о том, что на угле образуется поверхностный раствор с содержанием CuCL2 65-79%, что совершенно не достижимо для объемного раствора, в котором растворимость CuCL2 не превышает 4,5 моль/л при 20 °С или 42%.
Зависимость содержания меди (II) на пропитанным раствором угле от равновесного содержания меди (II) в растворе соответствует уравнению:
mcu-1=mcu(0)-1+kCcu-1 (3)
для 20 °С mcu(0)-1 =0,4; k=0,375.
Данные по влиянию концентрации модификатора CuCL2 на равновесную адсорбционную емкость активного угля представлены в таблице 2.
Таблица 2. Влияние концентрации модификатора на равновесную адсорбционную емкость угля марки АГ-3 по NH3 (интерполированные данные) при парциальном давлении аммиака 37,3 кПа и температуре 293 К.
|
Содержание меди мг/г угля |
Равновесная адсорбционная емкость мг/г угля |
|
0 |
28,6 |
|
4,7 |
35,2 |
|
9,4 |
41,3 |
|
18,8 |
49,5 |
|
28,2 |
67,2 |
|
27,6 |
78,1 |
|
47,0 |
80,1 |
|
94,1 |
104,1 |
|
141,1 |
123,4 |
|
188,2 |
140,2 |
Анализируя таблицу, можно обратить внимание на неравномерность повышения равновесной адсорбционной емкости. Резкий ее подъем с 28,6 до 80,1 мг/г наблюдается при повышении концентрации модификатора до 47 мг/г угля. Затем равновесная адсорбционная емкость увеличивается более монотонно, достигая значения 140,2 мг/г угля при содержании модификатора 188,2 мг/г угля. Дальнейшее увеличение содержания хлорида меди в адсорбенте не целесообразно, т.к. большой расход модификатора не приведет к значительному повышению адсорбционной емкости. Объяснить это можно уменьшением удельной поверхности модифицированного угля за счет кристаллизации соли модификатора в пористой структуре адсорбента. По результатам было определено координационное число, соответствующее меди в образованных комплексах, равное 2,29.
Выводы
1. Получены результаты экспериментальных исследований по влиянию концентрации модификатора хлорида меди на адсорбционную емкость угля по аммиаку.
2. Установлена зависимость содержания меди в модифицированном угле от концентрации раствора пропитки в обратных координатах.
3. Изучено влияние концентрации модификатора на равновесную адсорбционную емкость угля марки АГ-3 по NH3 при давлении 37,3 кПа и температуре 293 К.
4. Подтверждена целесообразность использования модифицированного угля раствором хлорида меди для увеличения емкости сорбентов на основе активных углей, применяемых для поглощения аммиака.
Рецензенты:
Когтев Сергей Евгеньевич, доктор технических наук, профессор, директор по развитию производства, ООО «Синтез ПКЖ», г. Дзержинск.
Ульянов Владимир Михайлович, доктор технических наук, профессор, профессор кафедры «Машины и аппараты химических и пищевых производств», Дзержинский политехнический институт (филиал) Нижегородского технического университета им. Р.Е. Алексеева, г. Дзержинск.



