Введение
Проблема лечения сахарного диабета приобретает с каждым годом все более выраженный социальный характер. Высокий риск появления серьезных побочных эффектов пероральных противодиабетических средств сохраняет актуальность поиска новых химических соединений, обладающих гипогликемическими свойствами [1].
Химическая часть
Ранее проведенные исследования показали, что производные ароилпировиноградных кислот обладают гипогликемической активностью [2, 3, 4].
С целью дальнейшего изучения химических свойств 5-трет-бутил-2-гетариламино-4-оксогекс-2-еновых кислот (2), а также исследования биологической активности нами были синтезированы 5,5-диметил-2-гетариламино-4-оксо-2-гексеноаты 3-метил-2-пиридиламмония и 4-метил-2-пиридиламмония (3) и N-замещенные амиды 5-трет-бутил-2-гетариламино-4-оксогекс-2-еновых кислот (5) (схема 1).
Схема 1
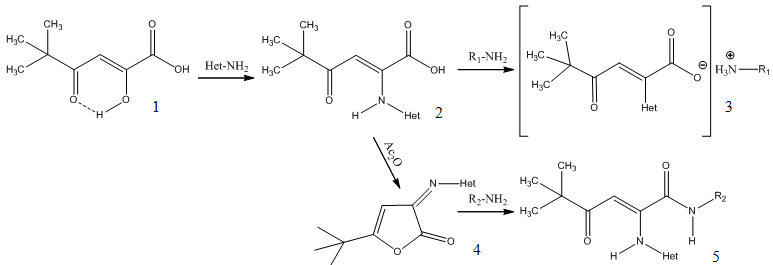
где
Het=антипирил-(3в,5в,5ж);3-карбоксамид-4,5,6,7-тетрагидробензотиофенил-2 (3а,3б,5а-5д,5е,5з-5к)
R1= 3-метил-2-пиридил (3а); 4-метил-2-пиридил (3б,3в)
R2=циклогексил-(5а, 5б); фенил- (5в); 2-гидрокси-3-изопропил-6-метилфенил (5г); 2-пиридил(5д); 3-пиридил(5е); 4-пиридил(5ж); 4-метил-2-пиридил(5з,5и); 6-метил-2-пиридил(5к).
Полученные соединения представляют собой бесцветные (3а,5а) или окрашенные в желтый цвет (3б,3в,5б-к) кристаллические вещества, растворимые в хлороформе, ацетоне, диметилсульфоксиде, диметилформамиде, малорастворимые в эфире, не растворимые в гексане и воде. Структура синтезированных соединений подтверждена данными ИК- и ЯМР 1Hспектроскопии.
Экспериментальная часть
ИК -спектры записаны на приборах Specord М-80, ФСМ-1201 в вазелиновой пасте. Спектры ЯМР 1Н получены на приборах Brucker 300A (300.05 МГц), TeslaBS-567A(100 МГц) в DMSO-d6 и CDCl3, внутренний стандарт -ГМДС. Химическую чистоту соединений и протекание реакций контролировали методом ТСХ на пластинках «Silufol 254 UV» или «Sorbfil» в системе эфир-бензол-ацетон (10:9:1), пятна детектировали парами йода.
5,5-Диметил-2-гетариламино-4-оксо-2-гексеноаты 3-метил-2-пиридиламмония и 4-метил-2-пиридиламмония (3а-в). К раствору 0,1 ммольсоответствующей енаминокислоты(2) в 10 мл безводного бензола добавляли 0,1 ммоль соответствующего пиридиламина в 10 мл безводного бензола. Нагревали в течение 5-7 минут. Реакционную смесь охлаждали, растворитель упаривали, сухой остаток перекристаллизовали из толуола.
N-Замещенные амиды5-трет-бутил-2-гетариламино-4-оксогекс-2-еновых кислот (5а-к).
К раствору 0,2ммольсоответствующего фуранона (4) в 10 мл безводного толуола добавляли смесь 0,2ммоль соответствующего амина в 10 мл безводного толуола и 0,1 мл уксусной кислоты. Нагревали в течение 10-15 минут. Реакционную смесь охлаждали, растворитель упаривали, сухой остаток перекристаллизовали из толуола (5а-5в, 5д-5ж, 5и,5к); из этанола (5г); из бензола (5з).
2-[(3-(Этоксикарбонил)-4,5,6,7-тетрагидробензо[b]тиофен-2-ил)амино]-5,5-диметил-4-оксо-2-гексаноат 3-метил-2-пиридиламмония (3а). Выход 0,45 г (48 %), Т.пл. = 149-150°С, (толуол). C25H33N3O5S.ИК спектр, n,см-1:3406 (ОN+H3), 3297 (NH), 1645 (С=О), 1598, 1573 (С=О, С=С).СпектрЯМР1Н,ДМСО-d6, d, м.д.:1.02 с (9Н, С(СН3)3), 1.14 с (9Н, С(СН3)3), 1.34 т (3Н, CH2СН3), 1.41-1.76, 2.52-2.71гр. с (8Н, циклогексил), 2.12 с (3Н, СН3), 2.30 с (3Н, СН3), 4.22кв (2Н, СН2CH3), 5.67 с (1Н,СН),6.16 с (1Н,СН), 6.51 т (3H, ОN+H3), 7.07 -7.78м (3H, 3-метилпиридил), 10.16 с (1H, NH),12.74 с (1H, NH).
2-[(3-(Этоксикарбонил)-4,5,6,7-тетрагидробензо[b]тиофен-2-ил)амино]-5,5-диметил-4-оксо-2-гексаноат 4-метил-2-пиридиламмония (3б). Выход 0,32г (51 %) , Т.пл. = 165-166 °С, (толуол). C23H32N4O4S.ИК спектр, n,см-1:3347 (ОN+H3, NH), 3160(NH), 1671 (С=О), 1612, 1570 (С=О, C=C). Спектр ЯМР1Н, ДМСО-d6, d, м.д.:1.15 с (9Н, С(СН3)3), 2.31 с (3Н, СН3), 1.68-1.84, 2.50-2.69 гр. с (8Н, циклогексил),5.78 с (1Н, СН), 6.44 с (3H, О+NH3),7.10-7.46 м (3Н, пиридил), 11.21 с (1H, NH).
2-[(1,5-Диметил-3-оксо-2-фенил-2,3-дигидро-1Н-пиразол-4-ил)амино]-5,5-диметил-4-оксо-2-гексаноат 4-метил-2-пиридиламмония (3в). Выход 0,54г (83 %), Т.пл. = 185-186 °С, (толуол). C25H31N5O4. ИК спектр, n, см-1: 3281(ОN+H3), 3188 (NH), 1668 (С=О), 1609, 1561 (С=О, С=С). Спектр ЯМР1Н,ДМСО-d6, d, м.д.:1.12 с (9Н, С(СН3)3), 2.11 с (3Н, СН3), 2.22 с (3Н, СН3), 2.93 с (3Н, СН3), 5.83 с (1Н,СН), 6.09 уш. с, 6.14 уш. с, 6.47 уш.с(3H, О+NH3), 7.01-7.37 м(8Н, С6Н5, пиридил), 11.23 с (1H, NH).
2-[(1-(Циклогексиламино)-5,5-диметил-1,4-диоксогекс-2-ен-2-ил)амино]-4,5,6,7-тетрагидробензо[b]тиофен-3-карбоксамид (5а). Выход 0,57 г (67 %), Т.пл. = 174-176 °С, (толуол). C23H33N3O3S. ИК спектр, n, см-1:3424 (CONH), 3320 (NH), 1650(СONH), 1614, 1568 (C=O, С=С).Спектр ЯМР1Н,ДМСО-d6, d, м.д.:1.15с (9Н, С(СН3)3), 1.22-2.56 гр.c(19Н, (2 циклогексил), 5.57с (1H, CH), 6.83 с (1H, CONH), 7.64с (1H, CONH), 8.40 д (1H, CONH), 11.39 с (1H, NH).
N-Циклогексил-2-[(1,5-диметил-3-оксо-2-фенил-2,3-дигидро-1Н-пиразол-4-ил)амино]5,5-диметил-4-оксогекс-2-енамид (5б). Выход 0,52 г (61 %), Т.пл. = 144-146 °С, (толуол). C25H34N4O3. ИК спектр, n, см-1:3284 (NH), 1690(СONH), 1664 (C=O), 1614 (С=О, С=С). Спектр ЯМР1Н,ДМСО-d6, d, м.д.:1.15с (9Н, С(СН3)3), 1.41-1.78гр.c (11Н, циклогексил), 2.19с (3Н, СН3), 3.04с (3Н, СН3), 5.63 с (1H, CH), 6.85 д (1H, CONH), 7.19-7.37м (5H, С6Н5), 10.54с (1H, NH).
2-[(-5,5-Диметил-1,4-диоксо-1-(фениламино)гекс-2-ен-2-ил)амино]-4,5,6,7-тетрагидробензо[b]тиофен-3-карбоксамид (5в). Выход 0,45г (34 %), Т.пл. = 198-199°С, (толуол) C23H27N3O3S.ИК спектр, n, см-1:3359 (CONH), 3163 (NH),1713 (СONH),1674(СONH),1642, 1620 (C=O, С=С). Спектр ЯМР1Н,ДМСО-d6, d, м.д.:1.16с (9Н, С(СН3)3), 1.71, 2.51-2.60 гр.c (8Н, циклогексил), 5.67с (1Н, СН), 7.07-7.34 м (5H, С6Н5), 7.60c (1H, CONH), 7.63 c (1H, CONH), 10.82c (1H, CONH), 12.25 с (1H, NH).
2-[(1-((2-Гидрокси-3-изопропил-6-метилфенил)амино-5,5-диметил-1,3,-диоксогекс-2-ен-2-ил)амино]-4,5,6,7-тетрагидробензо[b]тиофен-3-карбоксамид (5 г). Выход 0,9г (91 %), Т.пл. = 201-203 °С, (этанол). C27H35N3O4S. ИК спектр, n, см-1: 3190 (NH),1660 (СONH), 1650, 1630 (C=O, С=С). Спектр ЯМР1Н,ДМСО-d6, d, м.д.:1.15-1.28 гр. с (15Н, С(СН3)3, CH(СН3)2), 2.03с (3Н, СН3), 1.80, 2.71-2.76гр.c (8Н, циклогексил), 3.01м (1Н, СН(CH3)2), 5.29 с (1Н, СН), 5.65-5.95гр. с (3Н, СН,CONH2), 6.56 с, 6.83 с (3H, ОН, С6Н2), 9.25c (1H, CONH), 11.30 с (1H, NH), 12.88 с (1H, NH).
2-[(-5,5-Диметил-1,4-диоксо-1-(пиридин-2-иламино)гекс-2-ен-2-ил)амино]-4,5,6,7-тетрагидробензо[b]тиофен-3-карбоксамид (5д). Выход 0,48 г (58 %), Т.пл. = 139-141°С, (толуол).C22H26N4O3S. ИК спектр, n, см-1: 3485 (CONH), 3370 (CONH), 3168 (NH), 1724 (СONH),1665 (C=O), 1640, 1583 (C=O, С=С). Спектр ЯМР1Н,ДМСО-d6, d, м.д.: 0.92 с (9Н, С(СН3)3), 1.13с (9Н, С(СН3)3), 1.18 с (9Н, (ССН3)3), 1.72-2.68гр.c (8Н, циклогексил), 4.25 с (2Н, СН2), 5.78с (1Н, СН), 6.17 с (1Н, СН), 6.99-7.72 м (6Н, пиридил,CONH2), 9.56c (1H, CONH), 9.64c (1H, CONH), 10.99 с (1H, NH), 11.56 с (1H, NH).
2-[(-5,5-Диметил-1,4-диоксо-1-(пиридин-3-иламино)гекс-2-ен-2-ил)амино]-4,5,6,7-тетрагидробензо[b]тиофен-3-карбоксамид (5е). Выход 0,4 г (47 %), Т.пл. = 157-158°С, (толуол). C22H26N4O3S.СпектрЯМР1Н,ДМСО-d6, d, м.д.:0.87с (9Н, (ССН3)3), 1.82, 2.68гр. (8Н, циклогексил), 6.02 с (1Н, СН), 6.40 уш. с (2H, CONH2), 7.08-7.91 м (4Н, пиридил), 8.80 c (1H, CONH), 10.90 с (1H, NH).
2-[(1,5-Диметил-3-оксо-2-фенил-2,3-дигидро-1Н-пиразол-4-ил)амино]-5,5-диметил-4-оксо-N-(пиридин-4-ил)гекс-2-енамид (5ж). Выход 0,39г (46 %), Т.пл. = 208-210°С, (толуол). C22H26N4O3S. ИК спектр, n, см-1:3244 (CONH), 3171 (NH), 1690 (СONH), 1651, 1589 (C=O, С=С). Спектр ЯМР1Н,ДМСО-d6, d, м.д.: 1.02 с (9Н, С(СН3)3), 1.14 с (9Н, С(СН3)3), 2.20 с (3Н, СН3), 2.94 с (3Н, СН3), 5.69 с (1Н,СН),6.32 с (1Н,СН),7.09-8.33 м (9Н, С6Н5, пиридил), 10.70уш. c (1H, CONH), 10.89 с (1H, NH).
2-[(-5,5-Диметил-1-((4-метилпиридин-2-ил)амино)-1,4-диоксо-гекс-2-ен-2-ил)амино]-4,5,6,7-тетрагидробензо[b]тиофен-3-карбоксамид (5з). Выход 0,42г(62%), Т.пл. = 191-193°С, (бензол).C23H28N4O3S.ИК спектр, n, см-1:3398 (CONH), 3333 (NH), 3146 (NH), 1704 (СONH), 1662 (СONH), 1606, 1567 (С=О, C=С).СпектрЯМР1Н,ДМСО-d6, d, м.д.:0.83с (9Н, С(СН3)3), 1.08с (9Н, С(СН3)3С), 1.71-1.77, 2.51-2.87гр.c (8Н, циклогексил), 2.20 с (3Н, СН3), 2.35 с (3Н, СН3), 5.68с (1Н, СН), 6.01 с (1Н, СН), 6.93-8.35 м (5Н, пиридил, CONH2) 10.72c (1H, CONH), 11.27c (1H, CONH), 12.20 с (1H, NH).
2-[(1,5-Диметил-3-оксо-2-фенил-2,3-дигидро-1Н-пиразол-4-ил)амино)-5,5-диметил-N-(4-метилпиридин-2-ил)-4-оксогекс-2-енамид (5и68). Выход 0,52 г (78 %), Т.пл. = 186-188 °С, (толуол).C25H29N5O3.ИК спектр, n, см-1:3280 (CONH), 1671 (СONH), 1601, 1561 (C=O, С=С).СпектрЯМР1Н,ДМСО-d6, d, м.д.:1.11 с (9Н, С(СН3)3), 2.18 с (6Н, 2СН3), 2.94 с (3Н, СН3), 5.68 с (1Н,СН), 6.31 с (1Н,СОNН), 7.03-7.57 м (8Н, С6Н5, пиридил), 11.02 с (1H, NH).
2-[(-5,5-Диметил-1-((6-метилпиридин-2-ил)амино)-1,4-диоксо-гекс-2-ен-2-ил)амино]-4,5,6,7-тетрагидробензо[b]тиофен-3-карбоксамид (5 к). Выход 0,24 г (28 %), Т.пл. = 71-73 °С, (толуол).C23H28N4O3S.ИК спектр, n, см-1: 3429 (CONH), 3319 (CONH), 3191 (NH), 1710 (СONH), 1662 (СONH), 1595, 1573 (C=O, (C=С). Спектр ЯМР1Н,ДМСО-d6, d, м.д.:1.17с (9Н, С(СН3)3), 1.24 с (3Н, СН3), 1.72-1.81, 2.48-2.66гр.c (8Н, циклогексил), 5.79с (1Н, СН), 6.85 уш. c (2H, CONH2), 7.02-7.55 м (3Н, пиридил), 10.88c (1H, CONH), 11.38 с (1H, NH).
Биологическая активность
Проведен скрининг 10 соединений: амидов и солей 2-гетариламинопроизводных 5,5-диметил-4-оксо-2-гексеновых кислот с целью анализа их влияния на уровень гликемии интактных крыс. Эксперименты выполнены на нелинейных крысах-самцах массой 210-240 г. Исследуемые вещества и препараты сравнения вводили однократно через рот в скрининговой дозе 25 мг/кг в виде суспензии 1 % крахмальной слизи. В контрольной серии эксперимента в эквиобъемном количестве применяли одну крахмальную слизь. Содержание глюкозы в крови животных определяли глюкозооксидазным методом до, а также через 3 и 5 часов после введения исследуемых веществ. В качестве эталонов сравнения использовали препараты двух классов: производные сульфонилмочевины - гликлазид и карбутамид, а также производное бигуанидного ряда - метформин [5]. Результаты исследований указаны в таблице 1.
Таблица 1
Влияние амидов и солей 2-гетериламино-производных 5,5-диметил-4-оксо-2-гексеновых кислот на уровень гликемии интактных крыс
|
|
Уровень гликемии |
||
|
Серия опыта |
исходн., ммоль/л |
3 час, % от исх. |
5 час, % от исх. |
|
5л |
3,30±0,24 |
+10,40±6,67* |
+16,49±6,91* |
|
5ж |
3,92±0,26 |
-12,49±4,04 |
+6,81±5,48 |
|
Контроль |
3,65±0,06 |
-6,5±1,3 |
-4,5±2,0 |
|
|
|||
|
5з |
4,23±0,23 |
-8,10±4,85 |
-0,63±5,47 |
|
Контроль |
4,23±0,13 |
-4,56±2,11 |
-5,92±3,11 |
|
|
|||
|
5в |
4,67±0,11 |
-0,31±5,32 |
-11,59±4,14 |
|
5и |
4,45±0,19 |
-6,06±4,84 |
+5,41±1,80 |
|
Контроль |
4,73±0,14 |
-6,1±1,1 |
-9,7±2,2 |
|
|
|||
|
5в |
4,67±0,11 |
-0,31±5,32 |
-11,59±4,14 |
|
5и |
4,45±0,19 |
-6,06±4,84 |
+5,41±1,80 |
|
Контроль |
4,73±0,14 |
-6,1±1,1 |
-9,7±2,2 |
|
|
|||
|
3в |
5,05±0,15 |
-5,44±4,00 |
+0,11±5,03 |
|
Контроль |
4,96±0,14 |
-6,7±2,3 |
-11,2±2,5 |
|
|
|||
|
5к |
5,38±0,08 |
-12,99±1,71* |
+2,61±3,21* |
|
5г |
5,88±0,22 |
-11,49±4,31 |
-6,14±6,23 |
|
3а |
5,85±0,13 |
-7,09±4,01 |
-5,46±3,33 |
|
3б |
5,73±0,16 |
-8,74±3,40 |
-1,27±5,48 |
|
Контроль |
5,55±0,16 |
-3,05±4,10 |
-13,30±4,02 |
|
|
|||
|
Гликлазид |
4,28±0,39 |
-24,8±3,0* |
-14,5±4,9 |
|
Карбутамид |
4,10±0,13 |
-17,1±8,7 |
-19,5±2,2* |
|
Метформин |
4,10±0,79 |
+6,1±4,1* |
+ 8,9±4,6* |
|
Контроль |
4,02±0,14 |
- 5,5±2,4 |
-8,2±1,5 |
Примечание: достоверность отличий по сравнению с соответствующим контролем при Р ≤ 0,05 - *.
Показано, что соединения оказывают разнонаправленное влияние на содержание глюкозы в крови животных (табл. 1). Если вещество 5 л действует гипергликемически, то 5 к обладает двухфазным эффектом: первые 3 часа снижает уровень гликемии на 12,99 %, а спустя 5 часов повышает его на 2,61 %. Препараты сравнения группы сульфонилмочевины в этих условиях проявили слабую гипогликемическую активность. Так, гликлазид понижал сахар крови лишь через 3 часа с последующим уменьшением действия, а карбутамид, напротив, обеспечивал сахароснижающий эффект только к концу исследования. Бигуанидный эталон сравнения метформин при введении интактным крысам на всём протяжении опыта действовал гипергликемически.
Таким образом, проведенные исследования свидетельствуют о неоднозначном влиянии соединений данного ряда на уровень гликемии интактных животных. В отличие от производных сульфонилмочевины, обладающих гипогликемическим эффектом, и в отличие от производных бигуанида, повышающих сахар крови нормогликемических животных, изучаемые вещества на уровень глюкозы крови действуют двухфазно. Не исключено, что это свидетельствует об их возможном блокирующем влиянии на различные типы калиевых каналов и обусловленной этим вторичной активации потенциал чувствительных кальциевых каналов [6]. Данный эффект, как известно, может усиливать высвобождение из пресинаптических окончаний норадреналина, повышать опосредованную кальцием секрецию инсулина, одновременно увеличивая сосудистое сопротивление и артериальное давление. По-видимому, эта особенность изучаемых 2-гетериламинопроизводных 5,5-диметил-4-оксо-2-гексеновых кислот объясняет неоднозначность их гликемических свойств.
Рецензенты:
Сыропятов Б. Я., д-р мед. наук, профессор, зав. кафедрой физиологии и патологии Пермской государственной фармацевтической академии, г. Пермь.
Михайловский А. Г., д-р фармацевт. наук, доцент, профессор, зав. кафедрой неорганической химии Пермской государственной фармацевтической академии, г. Пермь.



