Введение
Рост злокачественных новообразований сопровождается продукцией веществ, угнетающих защитные силы организма. Это приводит либо к снижению противоопухолевого иммунного ответа, либо к полному его блокированию [12]. При этом опухоль перестает распознаваться иммунными клетками как чужеродная или дефектная ткань и становится биологически более агрессивной.
Известно, что одну из ключевых ролей в процессе ускользания опухоли от иммунного надзора играют иммуносупрессивные T-reg лимфоциты, а также дендритные клетки, присутствующие в значительном количестве в зоне локального иммунного ответа на границе роста опухоли [2]. Иммуносупрессивные T-reg клетки имеют фенотип CD3+/CD4+/CD25+/Foxp3 и могут происходить из зрелых периферических T-лимфоцитов с фенотипом CD3+/CD4+/CD25- [11]. Есть мнение, что увеличение в опухоли числа T-reg клеток сочетается с плохим прогнозом и низкой эффективностью лечения [13].
Кроме подавления локального иммунного ответа, опухоль обладает прямым токсическим влиянием на иммунные органы, что приводит к снижению продукции ими иммунокомпетентных клеток либо к выработке дефектных цитотоксических лимфоцитов, которые могут служить источником происхождения иммуносупрессивных T-reg клеток [6; 10]. Однако механизм прямого иммуносупрессорного влияния опухоли на иммунные органы до конца не ясен.
Немаловажное значение в развитии злокачественных новообразований принадлежит иммунодефицитам. Известно, что старение сопровождается угнетением многих звеньев иммунитета, при этом страдают как клеточный, так и гуморальный иммунный ответ [7]. В настоящее время снижение иммунной реактивности организма вследствие старения считается одной из причин более высокой заболеваемости раком у пожилых по сравнению с молодыми [3]. Есть мнение, что это может быть обусловлено возрастной инволюцией вилочковой железы [5].
Цель исследования – выявление особенностей изменений морфологии и молекулярного фенотипа тимуса при развивающейся злокачественной опухоли толстой кишки и их сравнение с изменениями при возрастной инволюции железы.
Материалы и методы исследования. Работа выполнена на 60 белых нелинейных крысах-самцах 5 месяцев массой 180-220 граммов. Уход и содержание животных проводили в соответствии с «Правилами проведения работ с использованием экспериментальных животных». Животные были разделены на две группы. Животным первой группы (30 крыс) внутрибрюшинно водили 1,2-диметилгидразин из расчета 20 мг/кг массы 1 раз в неделю в течение 5 недель в соответствии с экспериментальной моделью [4]. Животные второй группы – интактные (30 крыс) служили для исследования возрастных инволютивных изменений и контроля. Выведение животных из эксперимента проводилось через 30, 90 и 150 суток после окончания введения канцерогена путем декапитации. Одновременно выводились интактные животные соответствующего возраста. Объектом исследования служил тимус. В работе применялись следующие методы.
1. Иммуногистохимический метод с использованием четырех коммерческих моноклональных (МАКАТ) и поликлональных (ПКАТ) антител фирм Santa Cruze (США) и NovoCastra (Великобритания):
- МКАТ к кластеру дифференцировки лимфоцитов 3 типа;
- ПКАТ к белку нейроэктодермы S-100 для идентификации дендритных клеток;
- МКАТ к гликопротеиду пресинаптических везикул synaptophysin для идентификации нейроэндокринных клеток;
- МКАТ к белку клеточной пролиферации Ki-67.
Материал для исследования методом иммуногистохимии фиксировали 10%-ным нейтральным забуференным формалином в течение 24 ч, выполняли стандартную спиртово-ксилоловую проводку. Подготовленные образцы тканей заливали в парафин, готовили срезы толщиной 4 мкм, которые наносили на высокоадгезивные стекла и высушивали при температуре 37 °С в течение 18 ч. Демаскировка и иммуногистохимическая окраска проводилась на автостейнере Leica Bond Max (Германия). Контролем иммуногистохимической реакции служила неиммунизированная кроличья и мышиная сыворотка. Результат реакции оценивали путем подсчета позитивно окрашенных клеток на 100 клеток в десяти полях зрения при увеличении х400, выражая результаты в процентах и единицах в поле зрения.
2. Окраска срезов тимуса гематоксилином и эозином для изучения общегистологической картины микропрепаратов и проведения линейных морфометрических измерений.
3. Компьютерная морфометрия с использованием лицензионных программ Leica application suite 3.6.0 и «Микроанализ». Данные обрабатывались статистически, достоверность определялась t-критерием Стьюдента.
Результаты исследования и обсуждение. Возрастная инволюция тимуса сопровождается структурной перестройкой органа и проявляется в постепенном уменьшении лимфоидной ткани с увеличением количества жировой и фиброзной. Атрофия паренхимы железы выражается в снижении средней площади тимической дольки с 1,52 ±0,02 мм² у крыс 6 месяцев до 0,97 ±0,06 мм² (P˂0,01) у крыс 10 месяцев. При этом регистрируется снижение толщины коркового вещества с 328 ±56 мкм до 197 ±34 мкм (P˂0,001), а также площади мозгового вещества с 0,61 ±0,04 мм² до 0,46 ±0,05 мм². Отмечается замещение паренхимы жировой тканью, при этом процесс замещения идет с периферических отделов органа. При обработке препаратов тимуса антителами к кластеру дифференцировки лимфоцитов 3 типа в корковом и мозговом веществе выявляются многочисленные зрелые тимоциты. Установлено, что у интактных крыс 6 месяцев позитивную реакцию с CD 3 дают 13% клеток коркового и 53% клеток мозгового вещества (рис. 1). У животных 8 месяцев регистрируется увеличение числа этих клеток в корковом веществе до 21,5% (P˂0,01) и уменьшение их количества в мозговой зоне до 47%. Через 10 месяцев количество CD3+ тимоцитов коркового вещества достоверно возрастает до 29% (P˂0,001), тогда как в мозговом веществе снижается до 35% (P˂0,01) (рис. 2). Окраска препаратов интактных крыс 6 месяцев к маркеру нейроэктодермы S-100 и белку нейроэндокринной дифференцировки synaptophysin выявляет немногочисленные клетки, локализованные в мозговом веществе и на границе коркового и мозгового вещества. Их количество достигает 18,4±2,9 и 12,8±3,05 в поле зрения соответственно. У животных 8 месяцев отмечается увеличение числа S-100+ и synaptophysin+ клеток до 21,8±2 и 19±1,1(P˂0,01) в поле зрения соответственно. У крыс 10 месяцев регистрируется дальнейшее достоверное повышение числа этих клеток до 34,2±5,3 (P˂0,001) и 22,4 ±3,4 (P˂0,001) в поле зрения соответственно. Обработка препаратов тимуса интактных крыс 6 месяцев антителами к маркеру клеточной пролиферации Ki-67 выявляет многочисленные пролиферирующие клетки. Индекс Ki-67 у интактных крыс этого возраста составляет 39% в корковом и 11,6% в мозговом веществе дольки. Инволютивные изменения в тимусе у животных 10 месяцев характеризуются достоверным снижением индекса Ki-67 как в корковом, так и в мозговом веществе железы до 26,4% (P˂0,01) и 6,9% (P˂0,001) соответственно.
Введение канцерогена по указанной схеме через пять месяцев вызывает развитие злокачественной опухоли толстой кишки, имеющей морфологию дифференцированной аденокарциномы. Формированию опухоли предшествует пролиферация и клеточная дисплазия крипт слизистой оболочки кишки. Через один и три месяца после воздействия общегистологичекая картина тимуса и его морфометрические характеристики у крыс с введением канцерогена не имеют достоверных отличий от интактных животных. Однако через пять месяцев после введения канцерогена морфологическая картина железы существенно меняется и отличается от возрастной инволюции. Регистрируется достоверное и более значительное снижение площади тимической дольки и мозгового вещества до 0,69±0,01 (P˂0,01) и 0,29±0,01 (P˂0,01) мм2 соответственно, а также толщины коркового вещества до 168±12,4 мкм.
Отмечаются изменения и в молекулярном фенотипе железы, причем некоторые показатели имеют достоверные отличия от значений у интактных крыс уже через 3 месяца после воздействия. Обработка препаратов тимуса маркерами нейроэктодермальной и нейроэндокринной дифференцировки выявляет достоверное увеличение количества клеток, дающих позитивную реакцию к белку S-100 и synaptophysin до 34,2±4,2 (P˂0,01) и 38,9±2,6 (P˂0,001) соответственно, уже через три месяца после введения канцерогена. Подобные изменения сохраняются и через пять месяцев после воздействия (рис. 3, 4). Окраска препаратов тимуса антителами к кластеру дифференцировки лимфоцитов 3 типа выявляет достоверное увеличение числа CD 3+ тимоцитов в корковом веществе до 47% (P˂0,001), тогда как количество этих клеток в медуллярной зоне меняется не существенно. Исследование маркера клеточной пролиферации Ki-67 выявляет достоверное (P˂0,01) повышение его экспрессии в структурах коркового и мозгового вещества дольки по сравнению с интактными крысами соответствующего возраста через пять месяцев после введения канцерогена.
Как показали наши исследования, инволюция тимуса через один и три месяца после введения канцерогенеза не имеет существенных морфологических отличий от изменений у интактных животных соответствующего возраста, за исключением увеличения числа клеток нейроэктодермального и нейроэндокринного происхождения в структурах тимопоэтического окружения. Формирование злокачественной опухоли через пять месяцев после введения канцерогена существенно меняет как морфологию железы, так и ее молекулярный фенотип. Нами показано, что развившаяся опухоль толстой кишки ускоряет инволютивные процессы в тимусе, что выражается в более значительном снижении относительной массы железы и ее морфометрических показателей по сравнению с возрастными изменениями у интактных животных. Вероятно, также имеет место токсическое влияние опухоли на костный мозг, обусловливающее нарушение поступления клеток-предшественников в тимус и, как следствие, – относительное увеличение числа зрелых CD3+ кортикальных тимоцитов. В отличие от возрастной инволюции, при которой по мере старения происходит постепенное уменьшение числа CD3+ тимоцитов мозгового вещества, число этих клеток при канцерогенезе остается на постоянном уровне. Мы считаем, что это может быть обусловлено иммунной реакцией на рост опухоли. На это также указывает значительное увеличение числа клеток, дающих позитивную реакцию с S-100 и synaptophysin, а также повышенная экспрессия маркера клеточной пролиферации Ki-67 в структурах коркового и мозгового вещества.
Известно, что в тимусе позитивную реакцию с маркером нейроэктодермальной дифференцировки S-100 дают медуллярные дендритные клетки и некоторые популяции эпителиальных клеток, входящие в состав PVS (периваскулярных пространств), а с synaptophysin – нейроэндокринные клетки, которые причисляют к клеткам АПУД-серии [1; 8]. Нейромедиаторы, выделяемые нейроэндокринными клетками, регулируют деятельность клеток микроокружения тимоцитов и секрецию ими гормонов и интерлейкинов, которые, в свою очередь, необходимы для созревания и дифференцировки Т-лимфоцитов [9]. Мы считаем, что одновременное увеличение числа клеток, регулирующих дифференцировку тимоцитов, но имеющих разный гистогенез и механизм действия, на фоне повышения экспрессии маркера клеточной пролиферации, может указывать на усиление тимопоэза. Заключение. Таким образом, нами установлено, что на ранних сроках канцерогенеза (1 и 3 месяца) инволюция тимуса в целом повторяет изменения при возрастной атрофии. Исключение составляют популяция клеток АПУД-серии и клетки нейроэктодермального происхождения, которые, по-видимому, одними из первых реагируют на предопухолевые изменения и принимают участие в инициации противоопухолевого клеточного иммунного ответа. Канцерогенез на этапе инвазивной опухоли существенно изменяет морфологию тимуса и его молекулярный фенотип по сравнению с возрастной атрофией. При этом в железе, наряду с инволютивными изменениями, отмечаются признаки усиления тимопоэза. Вероятно, подобные изменения могут быть обусловлены как иммунной реакцией на рост опухоли, так и продукцией тимусом дефектных аутореактивных цитотоксических клеток, необходимых для формирования опухолевой иммунной толерантности.
Рисунки.
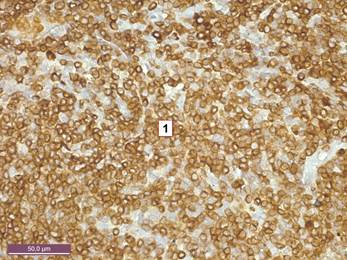
Рисунок 1. Тимус интактной крысы 5 месяцев. Экспрессия CD 3 в тимоцитах мозгового вещества. 1 – тимоциты, дающие мембранную окраску с CD 3. Иммуногистохимический метод с CD 3. Ув. 400.
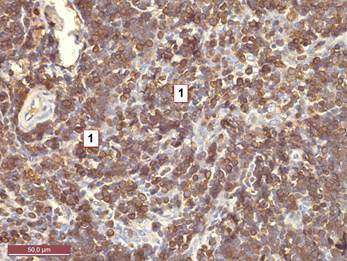
Рисунок 2. Тимус интактной крысы 10 месяцев. Уменьшение тимоцитов, экспрессирующих CD 3, в мозговом веществе. 1 – тимоциты, дающие мембранную окраску с CD 3. Иммуногистохимический метод с CD 3. Ув. 400.
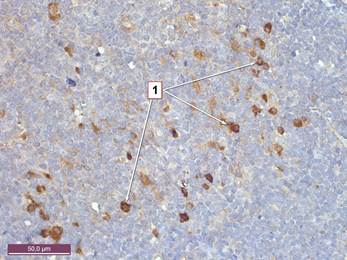
Рисунок 3. Тимус крысы 6 месяцев с введением канцерогена. Экспрессия S-100 в дендритных клетках мозгового вещества. 1 – клетки мозгового вещества, позитивные к S-100. Иммуногистохимическая реакция к белку S-100. Ув. 400.
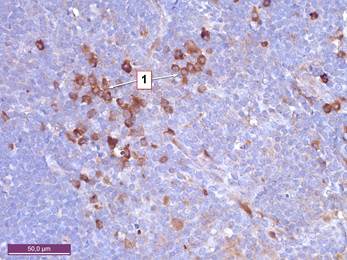
Рисунок 4. Тимус крысы 10 месяцев с введением канцерогена. Увеличение клеток, экспрессирующих S-100 в мозговом веществе. 1 – клетки мозгового вещества, позитивные к S-100. Иммуногистохимическая реакция к белку S-100. Ув. 400.
Рецензенты:
Воронов Леонид Николаевич, доктор биологических наук, профессор кафедры биологии и методики преподавания ФГБОУ ВПО «Чувашский государственный педагогический университет имени И.Я. Яковлева» Министерства образования и науки Российской Федерации, г. Чебоксары.
Долгов Игорь Юрьевич, доктор медицинских наук, профессор, главный врач БУ «Республиканский клинический онкологический диспансер», главный онколог Министерства здравоохранения и социального развития Чувашской Республики.



