Введение
В последние годы большое внимание уделяется электрическому разряду, с помощью которого можно генерировать окислители и инициировать разнообразные физико-химические процессы, а также возможности применения этих процессов в очистке воды.
Весьма интересным направлением является применение импульсного электрического разряда (ИЭР) в гетерогенных средах, например между металлическими гранулами в воде и водных растворах для получения мелкодисперсных порошков металлов и их соединений, а также для очистки природных и сточных вод [3; 6; 8]. Научный интерес в данной области определяется особыми условиями протекания химических реакций как в объеме, так и на электродах, их кинетикой и механизмом [2; 7].
Можно отметить, что анализ работ [3; 5; 6; 8-10] показывает, что диспергированный в процессе эрозии металл вступает в интенсивное взаимодействие со средой, в которой осуществляется процесс эрозии. В результате чего в продуктах эрозии в большем или меньшем количестве (в зависимости от свойств материала электродов и среды) образуются оксиды и другие соединения элементов, которые входят в состав электродов и среды. Отметим, что в описанном механизме ИЭР действует на металлический электрод (гранулы металла), а не на воду.
В альтернативных механизмах [4] рассматривается физико-химическое действие электрических разрядов на воду, в результате которых происходит образование химически активных частиц – H∙, ОН∙, О∙, НО2∙, пероксида водорода, молекулярного водорода, озона, гидратированных ионов.
Очевидно, что в случае применения ИЭР в процессах очистки воды одним из основных действующих факторов, влияющих на эффективность очистки, будут продукты эрозии – их размер, химический состав [1]. Анализ литературы показал, что опубликованные работы по исследованию применения импульсных электрических разрядов в слое металлических гранул в процессах очистки воды [3; 6; 8] содержат фрагментарные сведения о протекающих при этом химических реакциях: рассматривается только сам эффект очистки от примесей; механизм очистки воды при действии ИЭР в слое металлических гранул в ряде работ объясняется коагуляцией или сорбцией примесей на эродированных частицах металла гранул.
Ранее нами [1; 2; 7], были рассмотрены отдельные типы реакций, протекающие при электроимпульсном диспергировании металла (Fe) в водных растворах солей, содержащих ионы НSiO3–, Ni2+, As3+, Н2AsO4–, Mn2+, Cr2O72–.
Данная работа посвящена изучению механизма физико-химических процессов, протекающих в воде и разбавленных растворах солей при электроимпульсном диспергировании металла (Fe), на основании которого будет представлена модель данного процесса.
Материалы и методы исследования
Эксперимент проводили на установке, схема которой приведена в работах [1; 2; 7]. В качестве рабочих растворов применяли растворы, содержащие ионы, НSiO3–, Ni2+, As3+ Н2AsO4–, Mn2+, Cr2O72– различной концентрации (от 10 до 500 мг∙л–1), для приготовления которых использовали дистиллированную воду и соли: Na2SiO3 ×9 H2О, NiSO4 ×7 H2О, MnSO4 ×5H2О, NaH2AsO4, К2Cr2O7. Растворы, содержащие As3+, готовили из стандартов ГСО 7264-96.
При обработке импульсными электрическими разрядами металлических гранул, погруженных в рабочий раствор, происходит образование суспензии, состоящей из частиц эродированного металла и раствора. Для получения сухих электроэрозионных порошков суспензию фильтровали через фильтр «синяя лента» для отделения твердофазного продукта, который затем сушили при комнатной температуре или при 80 °С, в зависимости от задачи исследования. Образовавшийся фильтрат анализировали на содержание ионов Fe2+, Fe3+, Al3+, As3+, As5+, Cr6+, Ni2+, Mn2+, Si4+ методами вольтамперометрии и фотоколориметрии.
Исследования сухих электроэрозионных порошков проводили методом рентгенофазового анализа на дифрактометре ДРОН-3,0 по методу порошка. Исследования дисперсности и морфологии частиц проводились на просвечивающем микроскопе ЭМ-125 методом анализа угольных реплик с экстракцией. Исследования химического состава и строения соединений, образующихся при электроэрозии металлических гранул в воде и водных растворах, проводили методом ИК-спектроскопии с помощью ИК-Фурье спектрометра Nicolet 5700 в инфракрасной области спектра (4000 – 400 см–1) на приставке диффузного отражения в KBr (спектральное разрешение 4 см–1).
Результаты исследования и их обсуждение
В работе [1] было показано, что электроэрозия железных гранул в воде и растворах под действием ИЭР происходит c образованием нано- и микрочастиц по уравнению
[Feн]= kЭ · t0,72, (1)
где [Feн] – концентрация эродированного металла в суспензии, мг∙л–1; t – время действия ИЭР, с; kЭ – эмпирическая константа, зависящая от характеристик ИЭР, свойств электродов и среды, мг·(л·с0.72)–1. Показатель степени 0,72 учитывает изменение условий ИЭР в ходе электроэрозии.
Исследование электроэрозионных порошков и суспензии методом просвечивающей электронной микроскопии показало, что в них имеются частицы с размерами от единиц нанометров до единиц микрон (наибольший размер 5–10 мкм). Суммарно, по данным химического анализа, РФА и ИК-спектроскопии, основными твёрдыми продуктами, образующимися при диспергировании железа ИЭР в дистиллированной воде, являются: α – Fe, α – FeO, Fe2O3, Fe3O4, FeOOH и FeOOH∙nH2O [2; 7].
Таким образом, на основании проведенных исследований, можно заключить, что при действии ИЭР на слой гранул Fe в воде проявляется исключительно его окислительное действие. Большая часть энергии ИЭР расходуется не на химические реакции, а на нагревание и диспергирование металла [1; 8; 10; 11]. В дальнейшем происходит окисление водой и кислородом диспергированного железа по реакциям:
Fe0 + H2O = FeO + H2, (2)
4FeO + O2 + 2H2O = 4FeOOH, (3)
FeO + Fe2O3 = Fe3O4. (4)
При действии ИЭР на разбавленные растворы солей, содержащих анионы H2AsO4– и Cr2O72–, НSiO3– и катионы Ni2+, Mn2+, были получены кинетические зависимости, которые представлены на рис. 1 (а, б).
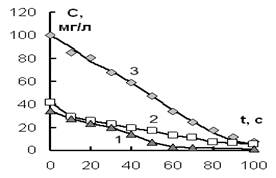
Рис. 1а. Изменение концентрации анионов (1) – Н2AsO4–, (2) – Cr2O72–, (3) – НSiO3– от времени обработки ИЭР. Объем раствора 600 мл.
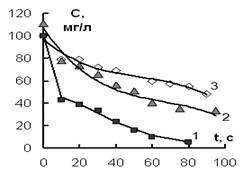
Рис. 1б. Изменение концентрации катионов (1) – Ni2+ и (2) – Mn2+, (объем раствора 100 мл), (3) – Ni2+ (объем раствора 600 мл) от времени обработки ИЭР.
Удаление примеси из раствора происходит по уравнению:
![]() , (5)
, (5)
где С0, Сi – начальная и текущая концентрация иона в растворе, мг·л–1; ![]() – эффективная константа скорости, включающая kЭ.
– эффективная константа скорости, включающая kЭ.
Уравнение (5) было получено при условии, что концентрация диспергированного металла в суспензии изменяется только за счет эрозии, то есть увеличивается.
![]() (6)
(6)
Следовательно, реакция взаимодействия диспергированного железа с примесью имеет первый частный порядок по обоим реагентам. Это значит, что активируются и реагируют все частицы Feн в зоне разряда. Адекватность описания проверена опытами с прерыванием ИЭР и с изменением начальной концентрации примеси, а также расчётами по другим уравнениям, которые показали значительно меньшую сходимость с экспериментом.
Качественно взаимодействие катионов или анионов соли с диспергированным железом можно представить в виде схемы:
![]() (7)
(7)
![]() (8)
(8)
где Fe – это железные гранулы; Feн – диспергированные частицы железа; В – извлекаемый ион или молекула, Р – продукт взаимодействия диспергированного железа с ионом или молекулой.
Для проверки соответствия приведенных выше кинетических зависимостей полученному полуэмпирическому уравнению были построены графики в координатах (lg C; t1.72) (рис. 2 а, б).
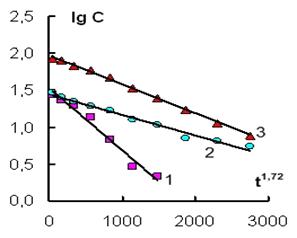
Рис. 2а. Зависимость lg С - t1.72 при действии ИЭР на железные гранулы в растворе соли, содержащей анионы (1) – Н2AsO4–, (2) – Cr2O72–, (3) – НSiO3–. Объем раствора 600 мл.
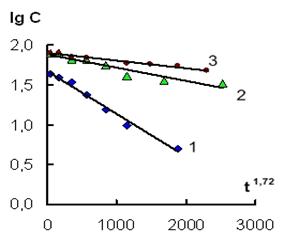
Рис. 2б. Зависимость lg С - t1.72 при действии ИЭР на железные гранулы в растворе соли, содержащей катионы (1) – Ni2+ и (2) – Mn2+ (объем раствора 100 мл), (3) – Ni2+ (объем раствора 600 мл).
Из рисунка 2 а, б видно, что экспериментальные зависимости соответствуют полученному уравнению (5). Необходимо также отметить, что данное кинетическое уравнение, описывающее извлечение ионов Н2AsO4–, Cr2O72–, НSiO3–, Ni2+, Mn2+ из растворов, оказалось однотипным как для катионов, так и для анионов. Рассчитанные значения величины достоверности аппроксимации для всех кинетических кривых R2 ≥ 0,98. Сравнение значений эффективных констант для анионов и катионов показало, что катионы удаляются из раствора гораздо медленнее, чем анионы (табл. 1).
Таблица 1 – Значения эффективных констант для анионов и катионов, приведенных к одному объему 600 мл
|
ион |
Н2AsO4– |
НSiO3– |
Cr2O72– |
Ni2+ |
Mn2+ |
|
|
8·10–4 |
4·10–4 |
3·10–4 |
9·10–5 |
3·10–5 |
ИК-спектроскопией определен состав продуктов, полученных в результате электроэрозии железных гранул в растворе соли, содержащей [2; 7]:
1) анионы Н2AsO4–: FeO-H2AsO4, FeO-H2AsO3, FeAsO4, FeAsO3;
2) анионы Cr2O72–: Сr2O3, Сr(OH)3, FeCrO4;
3) анионы НSiO3–: FeSiO3, Fe2(SiO3)3, SiO2, mSiO2 nH2O;
4) катионы Ni2+: Ni(OH)2, NiFe2O4;
5) катионы Mn2+: MnO2, Mn(OH)4, MnOOH.
На основании экспериментальных данных предложена качественная модель физико-химических процессов, протекающих при диспергировании металлов импульсными электрическими разрядами в воде и разбавленных растворах солей (рис. 3).
Установлена последовательность физико-химических процессов.
(1) Электрический пробой межгранульного промежутка происходит с образованием электропроводящего канала и выделением большой доли энергии на поверхности контактирующих гранул – образование «горячей» искры. Основная энергия расходуется на диспергирование металла, за счет плавления, испарения, разбрызгивания. Менее 10% энергии идёт на разложение воды, при этом образуются радикалы-окислители (O, OH), которые могут частично окислять ионы растворённой соли.
(2) Разогретые частицы металла Тнач.≈2000 К [1] реагируют с водой и растворенным кислородом с образованием высших и низших гидроксидов. Параллельно происходят процессы взаимодействия частиц металла с анионами или катионами соли по реакциям, зависящим от природы иона и металла:
– восстановление диспергированным железом ионов (Cr6+→Cr3+): Сr(OH)3; (As5+→As3+): FeAsO3;
– высокотемпературный гидролиз ионов (Mn2+, НSiO3–, Ni2+) с образованием соответствующих оксидов и гидроксидов.
(3) Далее происходят вторичные процессы:
– окисление гидроксидов растворенным кислородом (Fe(OH)2→Fe(OH)3; Mn(OH)2 → Mn(OH)4);
– адсорбция ионов (Н2AsO4–, НSiO3–) на поверхности продуктов окисления диспергированного железа с образованием FeO-H2AsO4, FeO-H2AsO3, (SiOFeOH);
– осаждение сверхравновесными ионами металла (FeAsO4, FeCrO4); реакции в твёрдой фазе (NiFeO4, FeSiO3) и соосаждение гидроксидов (Ni(OH)2, Mn(OH)4);
– окисление As (III) в As (V) продуктами разложения воды (OH, O).
Данная модель еще раз подтверждает возможность использования данного метода в очистке воды.
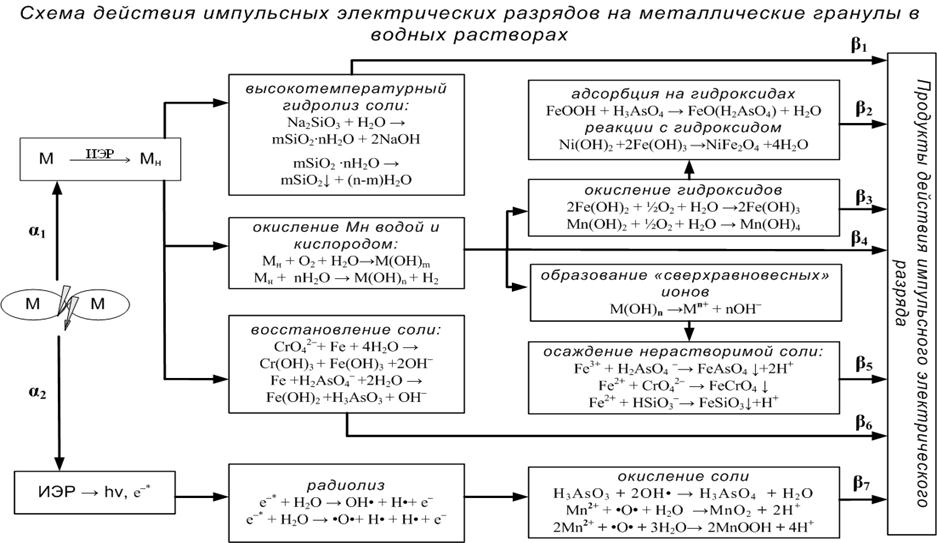
Рис. 3. Модель физико-химических процессов, протекающих при действии ИЭР на слой гранул в растворе (α1, α2 – доля энергии, которая идет на диспергирование металла и на разложение воды соответственно, причем α1>>α2, Σ α i = 1; β1 ÷ β7 – выходы продуктов химических реакций β7 << Σ(β1÷β6); Σ βi = 1).
Рецензенты:
Коробочкин Валерий Васильевич, д.т.н., профессор, зав. кафедрой общей химической технологии, Институт природных ресурсов НИ ТПУ, г. Томск.
Погребенков Валерий Матвеевич, д.т.н., профессор, зав. кафедрой технологии силикатов и наноматериалов, Институт физики высоких технологий НИ ТПУ, г. Томск.



