Введение
В настоящее время одним из основных направлений биоэлектроники является создание биотопливных элементов (БТЭ), функционирующих в физиологических жидкостях человека, как основы для создания потенциально имплантируемых автономных биоустройств [2]. Основными проблемами, сдерживающими практическую реализацию имплантированных источников тока, являются низкая операционная стабильность и низкая эффективность разработанных к настоящему времени биоустройств [1]. Улучшение основных характеристик отдельных электродов элемента (катода и анода БТЭ) может быть достигнуто за счет использования современных достижений нанотехнологии, а именно наноструктурирования поверхности электродов, а также инкапсулирования редокс-ферментов, основных биологических катализаторов БТЭ, в нанопоры трехмерных электродов. Для наноструктурирования используют золотые наночастицы [7], углеродные нанотрубки [8], графен [9] и другие наноматериалы. Однако при использовании наноматериалов неизбежно возникают трудности с масштабированием электродов, а значит и коммерческим производством БТЭ. Одним из возможных путей решения данной проблемы является использование коммерчески доступных технологий наноструктурирования электродов, например наноштамповой литографии.
Наноштамповая литография является многообещающей производственной технологией, имеющей очень широкий спектр возможного применения. Например, в настоящее время она используется в светодиодной промышленности, показывая высокую производительность и выход готовой продукции.
В качестве объекта исследования для настоящей работы были выбраны биокатоды потенциально имплантируемых БТЭ на основе билирубиноксидазы (БОД). Данный фермент обладает высокой активностью в реакциях электровосстановления кислорода по механизму прямого электронного переноса в широком диапазоне рН [5], в том числе и в физиологических жидкостях человека [7].
Целью настоящей работы являлось сравнение каталитической активности и стабильности биокатодов, полученных физической иммобилизацией БОД на немодифицированной и наноструктурированной методом наноштамповой литографии золотой поверхности.
Материалы и методы исследования
Реактивы. Все реактивы, использованные в работе, имели высокую степень чистоты и использовались без дополнительной очистки. H2SO4 была получена из компании Fluka (Букс, Швейцария), а NaCl и изопропиловый спирт были предоставлены Merck (Дармштадт, Германия). Остальные реактивы были куплены в компании Sigma-Aldrich (Сент-Луис, США). Все растворы готовились с использованием воды высокой степени чистоты (18 МОм∙см), очищенной с использованием системы PURELAB UHQ II (ELGA Labwater, Хай-Вайкомб, Великобритания). Кислород был получен из AGA Gas AB (Сундбиберг, Швеция) и использовался после дополнительной очистки при помощи фильтров Gas Clean Filters (Varian BV, Миддельбург, Нидерланды). Полимерные интермедиаты для изготовления электродов (IPS®) были любезно предоставлены компанией Obducat Technologies AB (Лунд, Швеция).
Ферменты. Билирубиноксидаза (БОД, билирубин: кислород оксидоредуктаза КФ 1.3.3.5) из гриба Myrothecium verrucaria была предоставлена компанией Amano Enzymes (Нагоя, Япония). Для очистки препарата БОД от возможных небелковых примесей и концентрирования препарата фермента навеску коммерческого препарата БОД (~300 мг) растворяли в 50 мл 10 мМ фосфатного буфера (ФБ), рН и диализовали против того же буфера. После диализа раствор наносили на колонку (3 х 50 см) с носителем Toyopearl DEAE-650M (TOSOH, Токио, Япония), предварительно уравновешенную 10 мМ фосфатным буфером, рН 7.0. Белки элюировали 100 мМ фосфатным буфером, рН 7.0. Фракции, обладающие активностью, дополнительно очищали методом гель-проникающей хроматографии среднего давления на колонке HiLoad 16/60 Sureddex 200 (Amersham Biosciences, Пискатавэй, США). Колонку уравновешивали 0,1 М фосфатным буфером, рН 7,0. На колонку вносили 1 мл препарата, скорость потока составляла 1 мл/мин.
Активность очищенного фермента, измеренная спектрофотометрически (Hitachi-557, Япония) с использованием в качестве субстрата АБТС (ε405 = 36800 М-1см-1), в насыщенном воздухом ФБ, рН 7.0, составила 58 мкмоль/мин на мг белка.
Изготовление электродов. Пластинки полимерного интермедиата IPS® обрабатывались методом наноштамповой печати (nanoimprint lithography) с помощью прибора 6”-Imprinter (Obducat Technologies AB, Лунд, Швеция) в течение 120 сек при температуре 160 °C и давлении 50 бар с последующей расформовкой в течение 40 сек при температуре 115 °C. Печати для проведения наномодификации были куплены в компании NIL Technologies (Дания) с последующей модификацией компанией Obducat Technologies AB, включавшей формирование на поверхности печати монослоя фторированных алкильных производных фосфорной кислоты [3]. Наномодифицированные и исходные образцы IPS® разрезались на квадраты 1 x 1 см, промывались ацетоном при комнатной температуре в течение 2 мин с последующим высушиванием в потоке азота.
На полученную заготовку наносился слой титана толщиной 5 нм (99.99+%, Goodfellow, Кембридж, Великобритания), а поверх него – слой золота (99.9999%, Dahlgren Ädelmetall, Мальмё, Швеция) толщиной 100 нм при помощи термического испарителя AVAC при давлении <10-6 мбар и скоростях осаждения ~1 Å/с для титана и ~10 Å/с для золота.
Для изготовления биокатодов на полученные немодифицированные (RE) и модифицированные методом нанолитографии (IE) электроды наносился раствор билирубиноксидазы, время иммобилизации составляло 20 минут.
Электрохимические исследования. Циклические вольтамперограммы (ЦВА) были получены с использованием потенциостата BAS CV-50W (BAS, Вест Лафайет, США) в стандартной трехэлектродной ячейке. В качестве электрода сравнения использовался насыщенный каломельный электрод (242 мВ отн. стандартного водородного электрода), в качестве вспомогательного электрода – платиновая проволока. В качестве рабочего раствора использовался физиологический буферный раствор (ФБР, 50 мМ HPO42-/H2PO4-, 150 мМ NaCl, pH 7.4)
Реальная (электрохимическая) площадь поверхности электрода рассчитывалась с использованием величины заряда (qreal), связанной в процессами восстановления кислорода на золотой поверхности, из ЦВА в интервале потенциалов -0,2 - +1,7 В в 0,5 М растворе H2SO4 со скоростью развертки потенциала 100 мВ/сек [4]. Теоретическая плотность заряда, связанная с электровосстановлением кислорода на поверхности золота, составляет 390±10 мкКл/см2 [6].
Сканирующая электронная микроскопия (СЭМ) проводилась с использованием электронного микроскопа высокого разрешения FEI Nova NanoLab 600 (FEI, Хиллсборо, США).
Результаты и обсуждение
СЭМ-изображение поверхности исходных и наномодифицированных электродов представлено на рис. 1.
Из данных рис. 1 видно, что обработка поверхности методом наноштамповой литографии приводит к образованию строго упорядоченной структуры с размером нанолакун диаметром около 100 нм.


Рис. 1. СЭМ-изображение поверхности немодифицированного (слева) и наноструктурированного (справа) электродов.
На рис. 2 представлены вольтамперограммы, полученные с использованием немодифицированного и наноструктурированного электродов в насыщенном воздухом и кислородом ФБР.
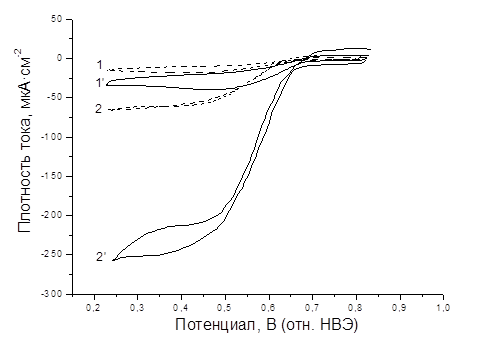
Рис. 2. ЦВА (2-й цикл), записанные на электродах, модифицированных билирубиноксидазой: 1 – ФБР, насыщенный воздухом, без перемешивания; 2 – ФБР, насыщенный кислородом, с перемешиванием; пунктирные линии (1, 2) – плоские электроды; сплошные линии (1’, 2’) – наноструктурированные электроды.
На всех представленных ЦВА наблюдается характерный каталитический пик электровосстановления кислорода (0,60–0,65 В), что свидетельствует о наличии прямого электронного переноса между молекулами фермента и золотой поверхностью. Плотность тока в насыщенном кислородом ФБР превышает таковую для раствора, насыщенного воздухом, в 3,35 и 7,82 раза для немодифицированного и наноструктурированного электродов, соответственно, достигая более 250 мкА/см2, что можно объяснить увеличением доступности внутренних поверхностей нанолакун при перемешивании раствора и устранением диффузионных ограничений.
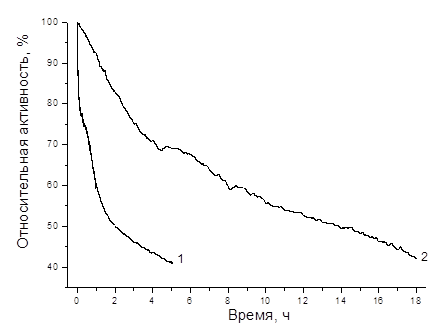
Рис. 3. Хроноамперограммы, записанные на электродах, модифицированных билирубиноксидазой: 1 – плоские электроды; 2 – наномодифицированные электроды (ФБР, насыщенный кислородом, с перемешиванием, потенциал 0,3 В).
Результаты изучения операционной стабильности биокатодов в насыщенном кислородом растворе приведены на рис. 3. Из данных рис. 3 видно, что наномодификация поверхности приводила к увеличению стабильности биокатода. А именно, время полуинактивации составляло около 2 и 14 часов для исходного и наноструктурированного электродов, соответственно.
Заключение
Проведенные исследования показали, что модификация поверхности золотых биокатодов методом наноштамповой литографии приводит к значительному увеличению плотности тока и операционной стабильности электродов в сравнении с немодифицированными образцами. Кроме того, выбранный метод структурирования делает возможным формирование унифицированной масштабируемой поверхности любых требуемых размеров, что позволит создавать стандартизированные, высокоэффективные гибкие биокатоды для БТЭ.
Работа выполнена при финансовой поддержке гранта РФФИ 12-04-33102 мол_а_вед.
Рецензенты:
Ярополов А.И., д.х.н., профессор, заведующий лабораторией Федерального государственного учреждения науки Института биохимии им. А.Н. Баха Российской академии наук, г. Москва.
Горичев И.Г., д.х.н., профессор кафедры общей и аналитической химии биолого-химического факультета Московского педагогического государственного университета, г. Москва.



