Введение
Филогенетически обонятельный анализатор является одной из древнейших сенсорных систем организма. Вместе с тем для большинства видов млекопитающих именно данный анализатор является основным или ведущим анализатором. Обонятельные сигналы играют исключительную роль в организации социального поведения млекопитающих, и в особенности грызунов. Обонятельные сигналы у грызунов – это основной источник информации о врагах, потенциальных жертвах, половых партнерах, пище. Нашими более ранними исследованиями было показано, что экспонирование беременных самок к моче домашней кошки на протяжении беременности приводит к уменьшению размеров выводка [7]. Запах кошки оказывает достоверное влияние на длину эстрального цикла у грызунов, долю циклирующих самок в группе [2; 10] в случае интактности дополнительной обонятельной системы т.е. вомероназального органа [7; 9]. Биологическая активность мочи хищника может быть обусловлена наличием серосодержащих веществ [4]. L-фелинин является уникальной серосодержащей аминокислотой, обнаруженной в моче кошачьих [1]. L-фелинин синтезируется в почках. Продукция L-фелинина зависит от типа диеты кошки, возраста, пола, сезона размножения. Содержание мяса в диете способствует повышению вывода L-фелинина с мочой. У домашней кошки концентрация L-фелинина в моче повышается в весенний период. Кастрация достоверно снижает вывод L-фелинина. Синтез фелинина связан с уровнем тестостерона в организме. В настоящее время фелинин рассматривается как феромон кошачьих [3].
Целью данной работы является исследование гормональных механизмов угнетения размножения домовых мышей в присутствии запаха естественного хищника – домашней кошки Felis catus.
Методы
В экспериментальных исследованиях мы использовали животных как отловленных в естественных условиях обитания (Mus musculus), так и из гетерогенной лабораторной популяции (M.musculus, M.domesticus). Мыши содержались в стандартных лабораторных условиях: вода, зерно и комбикорм для грызунов («Лабораторкорм») предоставлялись в свободном доступе. Световой режим был разделен на две фазы: 12 часов – свет и 12 часов – темновая фаза. Температура в помещении варьировала от 20 до 22 °С. В экспериментах использовали животных в возрасте 4-6 месяцев. Моча кота и морской свинки собиралась в эмалированную посуду и хранилась до использования в эксперименте при -20 °С. После размораживания мочу использовали однократно. Для оценки влияния запаха мочи домашней кошки (Felis catus) на уровень кортикостерона в плазме крови мышей мы экспонировали каждое животное (n=8) к образцу мочи кота (0.1 мл на фильтровальной бумаге) на протяжении 15 минут. По завершении экспозиции образец крови брали из подъязычной вены (0.1 мл). Процедура взятия крови не превышала 1-2 минут. В качестве контроля были использованы животные, экспонированные одновременно с экспериментальными к водопроводной воде (n=8), и группа животных (n=8), экспонированная к моче нехищного животного – морской свинки. В качестве позитивного контроля использовали помещение животных (n=8) в «открытое поле» (1.5 x 1.5m) с ярким освещением и высоким шумовым фоном. С целью исследования возможного процесса «привыкания» к экспозициям химических сигналов домашней кошки все вышеописанные экспериментальные воздействия были повторены трижды на протяжении недели с интервалом в 2 дня. Образцы крови немедленно после взятия центрифугировали в течение 15 минут при 12 000 об/мин. Аккуратно отделяли плазму крови и хранили при -20 °C до момента анализа. Измерение уровня кортикостерона в образцах плазмы осуществляли с использованием готовых наборов для ИФА (DRG, USA). Концентрацию конечного продукта измеряли с помощью планшетного спектрофотометра SpectraMax 340PC (Molecular Devices) при длинах волн: 450 нм и 630 нм. Анализ и статистическую обработку результатов измерения проводили с помощью пакета программ Statiatika 7 Software. Для оценки долгосрочного влияния химических сигналов домашней кошки на уровень секреции глюкокортикоидов у мышей мы использовали двухнедельные экспозиции феромона кошачьих L-фелинина (L-Felinine, 0,05%, 0,05 мл. US Biologicals). Экспериментальным животным (n=13) непосредственно в клетку помещали стерильные ватные диски, пропитанные фелинином (0,05 мл, 0,05% р-ра). Контрольным животным (n=13) в клетку помещали диски, смоченные водой. По окончании двухнедельного эксперимента у всех животных в одно и то же время отбирали индивидуальные образцы фекалий. Фекалии анализировали на наличие специфических метаболитов кортикостерона, имеющих в своей структуре группировку 5α-3b,11-ehol (Touma et al., 2003). Метаболиты глюкокортикоидов экстрагировали с помощью 80%-ного метанола и определяли методом иммуноферментного анализа. Первичные антитела были получены из лаб. проф. Э. Мостла, (Ветеринарный университет, г. Вена).
Результаты
Уровень кортикостерона в плазме крови мышей после 15-минутной экспозиции к моче домашней кошки составил 681,25±43,16 нг/мл (n=8), что достоверно (р< 0.001) отличалось от контрольной группы животных (n=8), экспонированных к чистой воде. При повторной экспозиции той же самой группе животных через 2 дня концентрация кортикостерона даже слегка повысилась – 706,25±123,63 нг/мл. После третьей экспозиции кортикостерон в плазме крови продолжал нарастать и составил 716,25±105,55 нг/мл (рис. 1). В контрольной группе животных эти показатели составили соответственно: 92,75 ±45,55 нг/мл (n=8); 77,88 ±23,79 нг/мл и 84,25± 17,70 нг/мл.
В качестве второго контроля мы использовали мочу нехищного животного – морской свинки. При экспозиции к моче морской свинки при первом предъявлении нового стимула отмечается резкий подъем кортикостерона по сравнению с контрольной группой (вода), но при повторных предъявлениях происходит постепенное снижение уровня этого гормона. При помещении мышей в «открытое поле» (отрицательный контроль) мы также отмечали реакцию угасания ответа на стрессирующий стимул. Таким образом, только в случае использования запаха хищника (моча домашней кошки) мы не наблюдали привыкания на уровне гормонального ответа при повторных предъявлениях стимула, что отражает врожденный характер ответа домовых мышей на запах хищника. Эти данные хорошо подтверждают полученные нами ранее результаты на серых крысах [8]. Полученные данные достаточно хорошо согласуются с результатами исследований долговременного непрерывного контакта домовых мышей с запахом домашней кошки. В этой серии экспериментов мы использовали феромон кошачьих L-фелинин (US Biologicals) в концентрации, сопоставимой с естественной в моче домашней кошки (0.05%). Экспозиция к феромону кошачьих на протяжении двух недель приводила к достоверному (p<0,001, n=13) повышению уровня специфических метаболитов глюкокортикоидов в фекалиях, тогда как в контрольной группе (n=13) концентрация этих метаболитов оставалась в норме (рис. 2). Так, в контрольной группе мышей (n=13) этот показатель составил 203,85±47,74 нг/мг, а в экспериментальной (n=13) – 702,15±122,24 нг/мг, (p<0,001 n=13). Таким образом, полученные результаты подтверждают факт отсутствия «привыкания» к запаху домашней кошки у домовых мышей, по крайней мере, на протяжении двух недель.
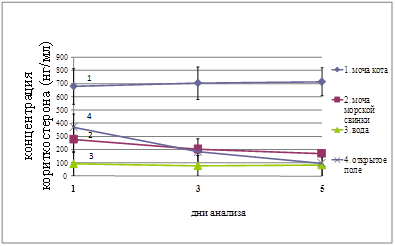
Рис. 1. Концентрация кортикостерона (нг/мл) в плазме крови мышей, экспонированных к моче хищника (Felis catus) (1); моче нехищного животного – морской свинки (2); к воде – негативный контроль (3); помещенных в «открытое поле» – позитивный контроль (4).
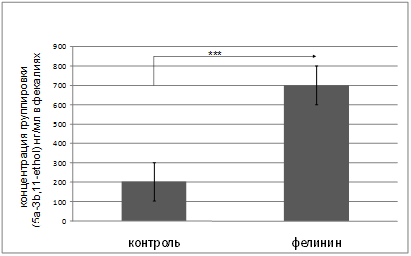
Рис. 2. Концентрация метаболитов глюкокортикоидов в фекалиях домовой мыши (Mus musculus) при длительной (две недели) экспозиции к L-Фелинину (L-Felinine, 0,05%, 0,05 мл. US Biologicals). *** - P<0.001. T – стандартная ошибка среднего.
«Ответ» лабораторных животных на химический сигнал, с которым они не имели опыта предварительных контактов, и отсутствие «привыкания» к данному стимулу может свидетельствовать о врождённом характере ответа.
Обсуждение
Химические сигналы являются единственной модальностью сигнала, который может сигнализировать о наличии хищника в его отсутствии. Ответные реакции на присутствие хищника разделяют на две основные условные категории: первичные и вторичные или в англоязычной литературе их называют «индуцированными» (inducible). Первичный ответ, предполагающий схватку или физическое избегание, энергетически очень дорог. Вторичные ответы обычно вызывают изменения поведения, морфологии или физиологических характеристик. В нашей работе мы получили данные, свидетельствующие о так называемых вторичных изменениях в результате контакта потенциальной жертвы с хищником. Хронически высокий уровень кортикостерона у домовых мышей в ответ на экспозицию запаха домашней кошки, прежде всего, влияет на репродуктивный успех. Повышение уровня кортикостерона запускает ряд гормональных реакций, влияющих на размножение. Так, стресс, вызванный экспозицией беременных самок к другим представителям грызунов различного социального статуса, влияет на овуляцию и объем выводка, синхронизацию овуляционных циклов среди самок одного выводка, удлинение или задержку созревания, блокировку беременности и нарушение имплантации бластоцистов. Экспозиция к запаху хищника также вызывает нарушение эстрального цикла и ряда репродуктивных показателей как у крыс, так и у мышей [Voznessenskaya et al.,1992; Kassesinova, Voznessenskaya, 2009]. Многочисленными исследованиями показано, что хронический стресс, сопровождающийся повышенным уровнем глюкокортикоидов, подавляет синтез тестостерона в клетках Лейдига семенников самцов что также способствует снижению их репродуктивного статуса. Сокращение размножения в ситуации высокой плотности хищника является адаптивным, поскольку снижает потребности в пищевых ресурсах и позволяет мигрировать животным на более значительные расстояния и основать колонии на новых территориях. Интересным моментом является врожденный, т.е. генетически запрограммированный, характер ответа. Мы наблюдали отсутствие привыкания к такому стрессирующему воздействию, как запах хищника, тогда как в том же самом эксперименте наблюдалось привыкание к другого рода стрессирующим воздействиям, например к другим новым запахам или к ситуации «открытого поля» (рис. 1). В эволюционном плане кошачьи сформировались как наиболее специализированные хищники. Возможно, что этим и объясняется наблюдаемый феномен. Домовые мыши не могут «приспособиться» к высокой плотности кошачьих: вероятность быть съеденным слишком высока; для сохранения жизни они должны покинуть эту территорию.
Подводя итог всему вышесказанному, можно сделать следующие заключения: экспозиция к моче кошки приводит к хроническому повышению уровня кортикостерона; L-фелинин и его производные являются сигнальными молекулами хищника, выполняющими роль кайромона у домовых мышей. У мышей не происходит адаптации при экспозиции к моче хищника и к L-фелинину на уровне гормонального ответа. Эффект долговременного повышения уровня глюкокортикоидов под влиянием L-фелинина или мочи кошки можно использовать в лабораторных условиях как модель хронического стресса. Такая модель представляет интерес для тестирования фармакологических препаратов в целях разработки новых лекарственных средств. Дальнейшее изучение эффектов L-фелинина может привести к созданию нетоксичного препарата, позволяющего регулировать численность грызунов.
Исследования поддержаны РФФИ 10-04-01599а и Грантом Президента МК- 709.2012.4.
Рецензенты:
Бутовский Руслан Олегович, доктор биологических наук, профессор, программный директор Фонда «Устойчивое развитие» (ФУР), г. Москва.
Блохин Геннадий Иванович, доктор с.-х. наук, профессор, заведующий кафедрой зоологии ФГБОУ ВПО «РГАУ им. К.А. Тимирязева» МСХ РФ, г. Москва.



