Оксид азота (NO) назван журналом «Science» молекулой 1992 года [1]. Это низкомолекулярное соединение, являющееся очень важным звеном в организме при запуске широкого спектра метаболических процессов, и сегодня, в начале XXI века, привлекает к себе большое внимание.
К настоящему времени накопилось такое огромное количество экспериментальных данных по метаболизму NO в организме [2,3], что они уже плохо вписываются в известные медико-биологические модели, в частности, в концепцию Реутова с колл.[3].
В настоящей работе приводится экспериментальное обоснование концепции, согласно которой в основе так называемого цикла оксида азота лежит не механизм регенерации NO при восстановлении ионов NO2¯/ NO3¯ нитритредуктазными системами, а реакция диспропорционирования радикала NO·, генерируемая NO-синтазами, по механизму (1).
NO·![]() NO+NO2¯/NO3¯ (1)
NO+NO2¯/NO3¯ (1)
Результаты и обсуждение
За последние годы концепция цикличности эндогенного оксида азота (NO) находит общебиологическое признание [4]. В соответствии с концепцией Реутова с колл. [3,4] под цикличностью NOподразумевается наличие в клетках животных NO-синтазного эндогенного пути синтеза NO, ионов NO2¯ и NO3¯ ферментным окислением L-аргинина (или другого субстрата) в присутствии супероксид-анион радикала •О2¯ и превращение указанных ионов (NO2¯, NO3¯) в NO с замыканием цикла при их восстановлении нитритредуктазными системами по цепочке метаболизма (2).
NO(NO˙)![]() NO2¯/NO3¯
NO2¯/NO3¯![]() NO+продукты восстановления (2)
NO+продукты восстановления (2)
Механизм замкнутости циклического пути метаболизма оксида азота (NO) по (2) требует определённых уточнений. Например, если принять NO-синтазный путь синтеза NO˙ окислительным, а нитритредуктазный-восстановительным, то оксид азота должен находиться в динамическом равновесии (3) вследствие эквивалентности их окислительных и восстановительных потенциалов (5,6).
![]() NO+О2
NO+О2 ![]() NO2¯/NO3¯ (3)
NO2¯/NO3¯ (3)
NO+2H2O![]() NO3¯ + 4H‾ (4)
NO3¯ + 4H‾ (4)
NO3¯ +4H+ +3ē![]() NO+2H2O (5)
NO+2H2O (5)
Имеется в виду, что цепочка метаболических превращений по (2) замыкается в цикл восстановлением нитрит-/нитратредуктазными ферментами ионов NO2¯ и NO3¯ .
В то же время известно, что количество нитритов и нитратов, выводимых из организма, заметно больше, чем их число, поступившее в организм с пищей [7]. При низких концентрациях в газовой фазе NO практически не реагирует с О2. В условиях in vivo константа скорости убыли NO в реакции с кислородом составляет всего К=0,124 с‾1 [2].
NO + ½O2 → NO2
NO2+ NO → N2O3
N2O3+ H2O → 2NO2 + 2H+ (6)
Стационарные концентрации NO(NO˙), продуцируемые in vivo NO-синтазами, крайне низкие 10-100 нм (10-100·10-9 моль) [2]. Из-за низких концентраций взаимодействие in vivo NO(NO˙) с О2по (6) практически не играет заметной физиологической роли.
С другой стороны, радикал оксида азота NO˙ (продукт генерации NO-синтазных ферментов) необратимо взаимодействует с супероксид-анион радикалом •О2¯ с образованием в основном цис-пероксинитрита с огромной скоростью 6,7·109 М-1 с-1, что в три раза превышает скорость реакции супероксиддисмутазы с супероксидом.
L-аргинин → NO˙+ цитруллин
NO˙ + •О2¯ → ONOO‾+H+ (7)
Образующаяся в реакции (7) молекула цис-пероксинитрит иона (ONOO‾) достаточно стабильная и не может служить источником генерации in vivo NO2¯/ NO3¯. Вследствие устойчивости этой молекулы она способна диффундировать на расстоянии в несколько диаметров клеточных тел.
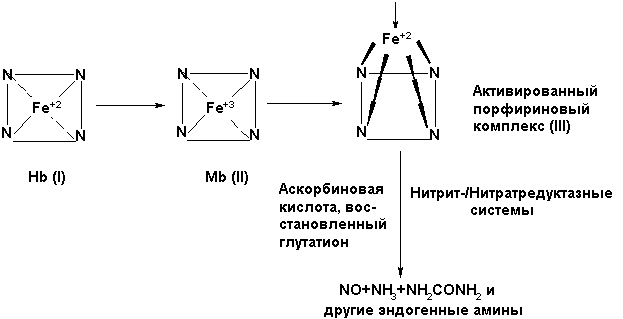
Важную роль в соответствии с концепцией [7] в генерации NO по (1) при восстановлении в крови NO2¯/ NO3¯ нитрит-/нитратредуктазными системами играет дезоксигемоглобин (дезокси-НЬ), в миокарде и скелетных мышцах-(миоглобин МЬ), в тканях ,в митохондриях (цитохромоксидазами) , микросомах (цитохромом Р-450) [7,8].
Однако с учётом того, что при окислении дезоксигемоглобина (Ι) в миоглобин (ΙΙ) генерируется супероксид-анион радикал, а в митохондриальной дыхательной цепи генерируется значительное количество •О2¯ как в норме, так и в патологии, происходит запуск неферментативной реакции (9), а это ставит под сомнение утверждение ингибирования NO-синтазного механизма запуска метаболизма NO-цикла при ишемии/гипоксии.
NO2¯/ NO3¯
При введении цыплятам-бройлерам per os значительных доз азотнокислого натрия (NaNO2 или NaNO3) в условиях формирования хронической ишемии/гипоксии содержание компонентов красной крови обычно уменьшается, а содержание метгемоглобина сильно возрастает [Л.С.].
НЬ(Ι) + O2→ НЬO2(Fe+2)→MЬ(ΙΙ)+ •О2¯ (8)
NO + •О2¯→ NO˙ + O2
NO˙ + •О2¯ → ONOO‾ + H+ (9)
Однако из экспериментальных результатов по влиянию комплексных соединений соли цинка с пиридином или никотинамидом в различных модификациях с витамином С на гемотологические показатели цыплят-бройлеров следует, что концентрация эритроцитов и гемоглобина возрастает относительно нормы, а концентрация метгемоглобина существенно снижается [Л.С.].
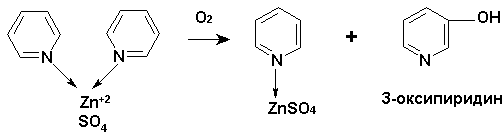
Подобное разнохарактерное влияние ионов цинка на гемотологические показатели опытных и контрольных групп цыплят-бройлеров можно объяснить окислением пиридина в комплексе с сульфатом цинка до α-кетоглутаровой кислоты (рис.1).
В литературе [3] известны только несколько примеров деградации пиридина микроорганизмами, что свидетельствует о высокой химической инертности пиридиновых оснований. Окисление пиридина в животном организме ферментативными системами протекает с незначительной скоростью.
Нами впервые обнаружено окисление пиридина в животном организме (цыплята-бройлеры) до нетоксичного и биологически активного З-оксипиридина.
Вскармливание цыплят комплексом состава 2С5Н5N·ZnSO4 с дозой 0,3 г на 1 кг комбикорма до 60 дневного возраста показало (табл. 1), что к убойному сроку средняя живая масса бройлеров опытной группы на 11,1% выше, чем в группе вскормленных только сульфатом цинка (1921 г против 1728 г в контроле).
Поглощение в спиртовом экстракте мяса опытных цыплят в УФ области λmax 218-220 и 277-278 нм свидетельствует о наличии в экстракте окисленной формы пиридина. Эта область поглощения обычно приписывается З-оксипиридину. Методом ТСХ обнаружено, в сравнении со свидетелем, наличие З-оксипиридина в спиртовом растворе мяса животных, хотя возможно наличие и других окисленных производных пиридина. Усиление интенсивности роста массы цыплят ΙΙ опытной группы относительно массы цыплят контрольной группы, очевидно, объясняется способностью З-оксипиридина усиливать обменные процессы в организме.
Деградация пиридина в животном организме, по-видимому, протекает по следующей схеме (рис.1).
В организме животных аланинаминотрансфераза (АлАТ) катализирует обратимую реакцию переноса аминогруппы с аланина на α-кетоглутаровую кислоту [10].
Накопление в организме α-кетоглутаровой кислоты вследствие окисления пиридина в комплексе с сульфатом цинка (2Py·ZnSO4) сопровождается возрастанием концентрации L-глутаминовой кислоты-важного субстрата цикла лимонной кислоты.
А.
 .
.
В.
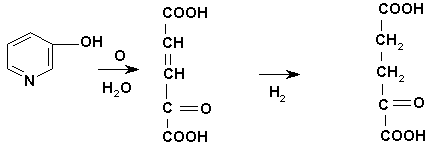
α-кетоглутаровая кислота
Рис. 1. Схема фрагментации пиридина в комплексе
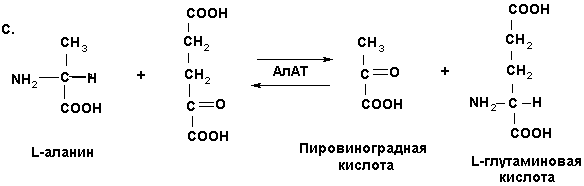
Увеличение концентрации этого субстрата сопровождается возрастанием в цикле лимонной кислоты синтеза АТР и значительным усилением метаболических процессов соответственно (рис. 1, табл. 1).
С другой стороны, α-кетоглутаровая кислота может служить исходным субстратом для генерации на этой структурной основе δ-аминолевулиновой кислоты, участвующей в синтезе протопорфирина.
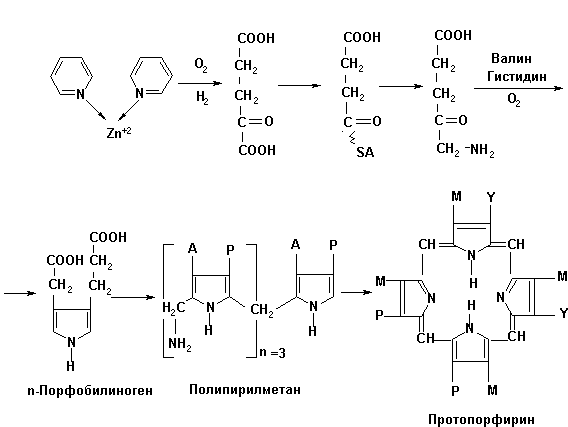
В свою очередь протопорфирин, по-видимому, взаимодействует с ионом цинка (Zn+2) c образованием цинкосодержащего порфирина, на поверхности которого (Zn+2) происходит фиксирование и восстановление нитрит- и нитратредуктазами оксида азота NO˙ по известной схеме [7,8].
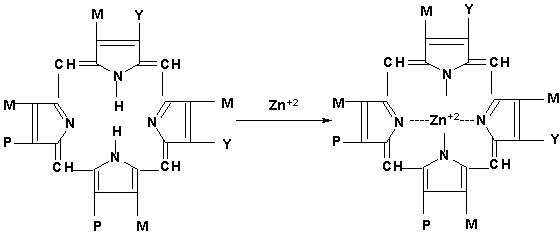
М, Р,Y- различные функциональные заместители
Выше указывалось что, NO-короткоживущая молекула, она стабилизируется посредством включения в динитрозольные комплексы железа с тиоловыми лигандами или в S-нитрозотиолы, которые в дальнейшем могут высвобождать NO˙ в зависимости от места локализации. По-видимому, этим и объясняется разный характер локализации нитратов и нитритов в органах и тканях подопытных цыплят (табл. 1).
Таблица 1. Влияние пиридина, комплекса пиридина с сульфатом цинка, сульфата цинка на сохранность (6) и прирост живой массы цыплят-бройлеров, г (Р ‹ 0,001)
| Группы цыплят | Возраст цыплят (в днях) М± м | ||||||
| 1 | 13 | 30 | 40 | 48 | 58 | 70 | |
| Ι среднееG% | 42,0±2,3 – | 150,0±4,3 98 | 500,0±17,5 89 | 740,0±15,2 78 | 847,2±17,5 76 | 1161,0±19,6 76 | 1736,0±22,1 74 |
| ΙΙсреднееG% | 40,0±3,1 – | 150,0±4,5 98 | 506,0±16,4 93 | 840,0±18,3 76 | 875,9±16,8 77 | 122,0±18,5 73 | 1920,7±23,0 70 |
| ΙΙΙсреднееG% | 41,0±2,1 – | 147,0±5,0 98 | 508,0±5,0 93 | 805,0±18,2 79 | 865,1±18,3 76 | 1179,8±19,5 76 | 1745,3±21,7 74 |
| ΙVсреднееG% | 40,0±3,4 – | 147,0±4,7 98 | 475,0±15,0 90 | 757,0±16,5 83 | 815,9±18,8 82 | 1120,3±17,6 78 | 1373,7±22,3 78 |
| VсреднееG% | 40,0±2,5 – | 138,0±4,4 100 | 500,0±16,3 96 | 773,0±17,6 84 | 941,4±17,1 84 | 1174,0±18,4 80 | 1728,3±21,5 80 |
| VΙсреднееG% | 40,0±2,8 – | 115,0±4,5 90 | 430,0±15,4 75 | 721,0±18,0 65 | 822,3±16,9 65 | 1050,0±19,5 60 | 1386,7±21,7 60 |
Обозначения: Ι группа-контрольная, ΙΙ-VΙ группы- опытные. Животные вскармливались на обычном корме. Отличие составило то, что ΙΙ группе в корм вводилось 0,3 г комплекса 2Py·ZnSO4 на 1 кг корма, ΙΙΙ группе- 0,6 г 2Py·ZnSO4, ΙVгруппе- 0,9 г 2Py·ZnSO4, V группе-0,6 г ZnSO4 и VΙ группе-0,3 г пиридина (Py) на 1 кг корма. Количество цыплят в каждом опыте около 1000.
Тогда из приведённого выше экспериментального материала можно заключить, что ключевым моментом запуска по замкнутому циклу NO˙ является реакция диспропорционирования эндогенного NO˙ по цепочке.
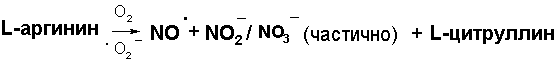
NO˙ → NO + NO2¯/NO3¯ (больше) (1)
Таким образом, наличие NO-синтазного механизма эндогенного синтеза NO˙ и частично ионов NO2¯/ NO3¯,а также нитрат -/нитритредуктазных систем и других низкомолекулярных соединений: витамина С и других, обеспечивающих восстановление NO2¯/ NO3¯ как в норме, так и в патологии в ферро-дезокси-и цинкгемосодержащих биоструктурных единицах создаёт условия для функционирования цепочки (1) по замкнутому циклу.
Материал и методы
Нами проведена серия научно-хозяйственных, физиологических и производственных экспериментов на цыплятах-бройлерах проса «Смена», «Белый леггорн», курах-несушках проса «Смена-2» и ремонтном молодняке в условиях птицефабрик «Северо-Осетинская» и «Владикавказская» РСО-Алании. В ходе эксперимента были поставлены 4 научно-хозяйственных, 2 физиологических и 1 производственный опыты. Были сформированы по 5 групп по 100 голов в каждой 43 цыплят-бройлеров, и ремонтного молодняка по 5 групп по 80 голов кур-несушек. Контрольная 1 группа получала основной рацион (ОР). Экспериментальные группы получали:
1 опытная ОР+0,5% цинкового комплекса пиридина
2 опытная ОР+0,5% никотината цинка
3 опытная ОР+0,5% цинкового комплекса пиридина +0,5% витамина С
4 опытная ОР+0,5% никотината цинка +0,5% витамина С.
В ходе эксперимента изучали следующие показатели: сохранность и оплату корма приростом, морфологический и биохимический состав крови, перевариваемость и использование питательных веществ рациона, морфологические и биохимические показатели яиц, морфологические и биохимические показатели органов и тканей, эколого-биохимические характеристики органов и тканей, экономическую эффективность.
Всего в Ι эксперименте 1400 голов.
Показатели крови по И. Кондрахину.
Щелочную фосфатазу по О. Bessey et.al. (1966).
ПОЛ и состояние антиоксидантной защиты в крови по Л.М. Двинской и Л.И. Никифоровой (1975).
Активность каталазы (М. А. Королюк и др. 1988).
Активность глутатионредуктазы (Д. Haferman et. аl. 1974).
Активность трансаминаз (аспаргат-и аланинтрансфераз по В.В. Меньшикову 1987).
Баланс азота, азотистых веществ по М.И. Дъякову (1959).
Глутаматдегидрогеназную активность по М. Balazs (1965).
СПИСОК ЛИТЕРАТУРЫ:
1. Koshland D.E.//Science. 1992.vol. 258. с.1861
2. Роль оксида азота в норме и патологии. В журнале: Вестник Российской АМН, №4, 3-52 (2000)
3. Реутов В.П., Сорокина Е.Г., Косицын Н.С.//Усп. Современной биологии. 2005. 125. №1. с.41-65
4. Реутов В.П., Сорокина Е.Г., Охотин В.Е., Косицын Н.С. Циклические превращения оксида азота в организме млекопитающих. - М., 1997
5. Ванин А.Ф.//Вестник РАМН. 2000. №4. с.3-5
6. Викторов И.В.//Вестник РАМН. 2000. №4. с.5-10
7. Antonini E., Brunori M. Нemoglobin and Myoglobin in their Reactions with Ligands.- Amsterdam, 1991. с.5-10
8. Северина И.С., Буссыгина О.Г., Пятакова Н.В.//Вестник РАМН. 2000. №4. с.25-30
9. Коростелева Л.А., Кост А.Н., Воробъева Л.И., Модянова Л.В., Терентьев П.В., Куликов Н.С.//Прикладная биохимия и микробиология. 1981. 17(вып.3). с.380-388
10. Лохова С.С., Лохов А.Р. Материалы III Междунар. конф. «Экологически безопасные технологии в сельскохозяйственном производстве ХХI века». Владикавказ. 2000. с.449
11. Лохов А.Р. «Использование комплексных соединений цинка с пиридином и никотиновой кислотой и витамина С для устоксикации нитратов в организме цыплят-бройлеров». Дисс. канд.биол. наук. Владикавказ. 2002.



