В последние 30 лет получила признание гипотеза свободнорадикального механизма развития многих патологий путем нарушения проницаемости биомембран за счет изменения интенсивности свободнорадикального окисления липидов и полярности биомембран [4, 8]. Поэтому в медицине развивается метод антиоксидантотерапии для профилактики и лечения различных патологий [6, 7]. Очевидно, что прогресс в антиоксидантотерапии возможен на основе разработки способов тестирования эффективности водорастворимых антиоксидантов.
Как показано в предыдущем сообщении, большинство известных способов тестирования антиоксидантов рассчитано на безводную среду, применение в качестве субстратов этилбензола, кумола или их растворов в хлорбензоле [5, 9]. Приведены результаты тестирования природных и синтетических липидрастворимых антиоксидантов с помощью кинетической метиллинолеатной модели.
Для тестирования водорастворимых биоантиоксидантов известно применение биологических субстратов: микросом, суспензий митохондрий или желточных протеинов, модельных системы липосом, сформированных из раствора яичного лецитина в глициновом буфере [11, 12]. Однако, эти способы имеют качественный характер и не позволяют получать количественные, воспроизводимые результаты из-за нестандартности субстратов, а также невозможности оценивать механизм действия антиоксидантов из-за неизвестного механизма окисления субстратов.
В настоящей работе приведены результаты разработки и оценки эффективности кинетической водно-липидной модели тестирования антиоксидантов. С этой целью разработан оптимальный состав водно-липидного субстрата, исследована эффективность стандартных подходов при тестировании антиоксидантов в безводных растворах, а также оригинального кинетического подхода. Модель апробирована на примере стандартного, синтетического и природного ингибиторов – ионола, α-токоферола и капотена.
Методы эксперимента
Условия окисления и волюмометрических измерений, получение метиллинолеата, очистка ионола (2, 6-дитретбутил-4-метилфенола), капотена (1-[(2S)-3-метилпропионил]-L-пролина), α-токоферо-ла (2, 5, 7, 8-тетраметил-2-(4, 8, 12-триметилтридецил)-6-оксихроман) описаны в предыдущем сообщении (сообщ. 1). Этилолеат получали из олеиновой кислоты марки «ч.» путем реакции этерификации пятикратным избытком абсолютного спирта в кислой среде с последующей экстракцией эфиром и вакуумной перегонкой [3]. Цетилтриметиламмоний бромид марки «х.ч.» используют без дополнительной очистки. Хлорид меди очищают кристаллизацией, используют бидистиллированную воду.
Результаты исследования
Для разработки способа тестирования водорастворимых антиоксидантов исследовано мицеллообразование в двух- и трехкомпонентных системах: вода – этилолеат или метиллинолеат, вода – ПАВ, вода – ПАВ – эфир. В качестве ПАВ исследуют цетилтриметиламмоний бромид, додецилсульфонат натрия. По наименьшей величине критической концентрации мицеллообразования (1–3)∙10-3 моль/л в качестве эмульгатора выбран цетилтриметиламмоний бромид. Большинство последующих экспериментов проведено с этилолеатом, как более доступным субстратом. Поскольку большинство промышленных инициаторов не совместимы с водой, то для ускорения процесса окисления использованы катализаторы. Для оценки их эффективности исследована кинетика окисления этил-олеата в присутствии солей CuCl2, FeCl2, FeCl3, CoCl2, NiCl2 в зависимости от концентрации. Результаты приведены на рис.1.
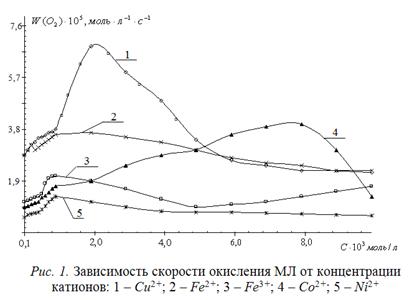
Из рисунка видна экстремальная зависимость скорости окисления от концентрации исследованных катализаторов. Для большинства катализаторов, кроме катионов кобальта максимум соответствует концентрациям (1 – 2)∙10-3 моль/л. Для катионов кобальта максимальная скорость окисления достигается при концентрации (6–8)∙10-3 моль/л. Наиболее эффективным является хлорид меди, который выбран в качестве рабочего катализатора.
Каталитическая активность исследованных солей падает в ряду: Cu2+>Fe2+>Fe3+>Co2+>Ni2+. В целом, по результатам проведенных исследований подобран состав субстрата, который содержит эмульсию этилолеатат в воде в соотношении 1 : 3 (по объему), добавки цетилтриметиламмония бромида и хлорида меди в концентрациях (1–3)∙10-3 моль/л.
Для оценки возможности тестирования антиоксидантов исследована кинетика окисления указанного субстрата в присутствии стандартного синтетического ингибитора – ионола в зависимости от его концентрации. Типичные кинетические кривые (КК) приведены на рис. 2.
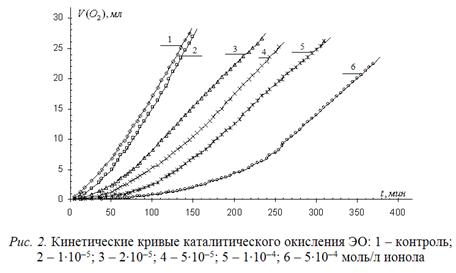
Из рисунка видно, что ионол тормозит процесс окисления водно-липидного субстрата пропорционально концентрации.
По описанной в предыдущем сообщении методике вычислены значения ![]() при разных концентрациях ионола. Результаты приведены в табл. 1.
при разных концентрациях ионола. Результаты приведены в табл. 1.
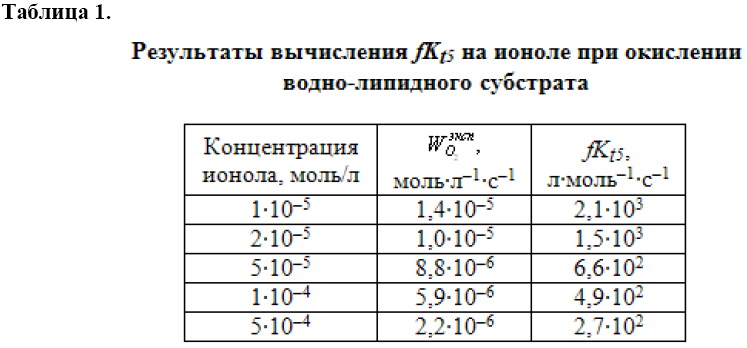
Из таблицы видно изменение значений ![]() примерно в 10 раз при изменении концентрации ионола
примерно в 10 раз при изменении концентрации ионола ![]() в 10 раз, что свидетельствует о сложном механизме его действия в водно-липидном субстрате. Поскольку параметр
в 10 раз, что свидетельствует о сложном механизме его действия в водно-липидном субстрате. Поскольку параметр ![]() не может служить критерием эффективности ингибитора в водно-липидном субстрате, то результаты эксперимента обработаны путем аппроксимации КК методом наименьших квадратов и последующего их дифференцирования. Результаты приведены в табл. 2.
не может служить критерием эффективности ингибитора в водно-липидном субстрате, то результаты эксперимента обработаны путем аппроксимации КК методом наименьших квадратов и последующего их дифференцирования. Результаты приведены в табл. 2.
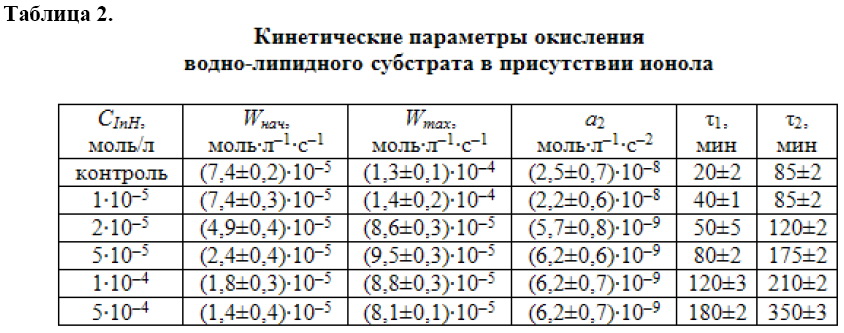
В качестве критериев эффективности и механизма действия ингибитора в водно-липидном субстрате использованы описанные ранее кинетические параметры: начальная (Wнач), максимальная (Wmаx) скорости окисления, периоды полного торможения (τ1) и окончания ускорения (τ2), ускорение (а). По начальной скорости и периоду полного торможения судят об эффективности обрыва цепей на ингибиторе. По уменьшению максимальной скорости окисления с увеличением концентрации ингибитора судят об участии продуктов превращения ингибитора в реакциях обрыва цепей. По уменьшению величины ускорения с увеличением концентрации ингибитора судят об участии продуктов его превращения в реакциях разветвления цепей. Период окончания ускорения характеризует выход процесса на максимальную скорость и полный расход ингибитора. Кинетические параметры, приведенные в табл. 2 свидетельствуют о сложном механизме действия ионола в водно-липидном субстрате и о возможном его участии в реакциях продолжения и разветвления цепей. Тогда возможная схема механизма каталитического окисления водно-липидного субстрата в присутствии ионола включает дополнительные реакции:
Инициирование цепей:
![]() (0.1)
(0.1)
Разветвление цепей:
![]() (3.3)
(3.3)
Обрыв цепей:
![]() (7)
(7)
![]() (8)
(8)
![]() (9)
(9)
Таким образом, предлагаемый метод позволяет не только оценить эффективность ингибитора, но и сделать предположение о механизме его действия.
α-токоферол относят к важнейшим биоантиоксидантам, регулирующим интенсивность свободнорадикального окисления липидов биомембран и отвечающего за их проницаемость и формирование патологий [1, 10, 13]. В предыдущем сообщении (сообщ. 1) приведены высокие значения ![]() для α-токоферола в стироле и этилбензоле [2], а также показано, что в растворе метиллинолеата он действует по сложному механизму, как слабый ингибитор. В литературе мы не встречали данных об оценке эффективности α-токоферола в водных средах, поэтому представляло большой интерес исследовать его эффект в водно-липидном субстрате. С этой целью исследовано влияние α-токоферола на окисление водно-липидного субстрата в широком интервале концентраций от 1∙10-8 до 1∙10-1 моль/л. Типичные результаты приведены на рис. 3.
для α-токоферола в стироле и этилбензоле [2], а также показано, что в растворе метиллинолеата он действует по сложному механизму, как слабый ингибитор. В литературе мы не встречали данных об оценке эффективности α-токоферола в водных средах, поэтому представляло большой интерес исследовать его эффект в водно-липидном субстрате. С этой целью исследовано влияние α-токоферола на окисление водно-липидного субстрата в широком интервале концентраций от 1∙10-8 до 1∙10-1 моль/л. Типичные результаты приведены на рис. 3.
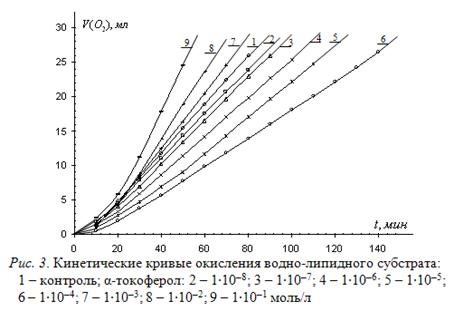
Из рисунка видно, что α-токоферол при концентрациях 1∙10-8 – 6∙10-4 моль/л слабо тормозит процесс, а при концентрациях 1∙10-3 – 1∙10-1 моль/л ускоряет процесс. Результаты свидетельствуют об изменении механизма действия в водно-липидной модели не только у ионола, но и у α-токоферола по сравнению с окислением безводных субстратов. В водно-липидном субстрате α-токоферол действует как буфер, ускоряя процесс при одних концентрациях и замедляя процесс при других концентрациях. Именно такой механизм действия характерен для многих биологически активных соединений (холестерина, гормонов), обеспечивающих гомеостаз.
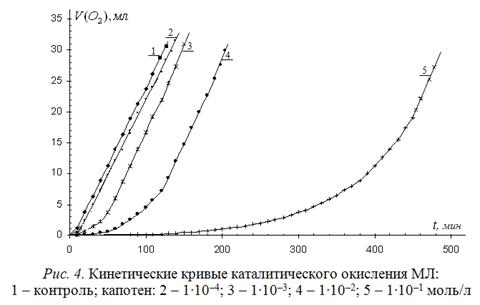
В предыдущем сообщении (сообщ. 1) капотен использован в качестве представителей тиолов. В настоящем сообщении приведены результаты исследования его антиоксидантной активности в водно-липидной среде. Типичные КК окисления водно-липидного субстрата приведены на рис. 4.
Из рисунка видно, что эффективное торможение наблюдается только при высоких концентрациях, превышающих 1∙10-3 моль/л, когда количество тиола равно или превышает концентрацию катализатора.
Для количественной оценки результатов и исследования механизма действия капотена КК аппроксимировали функциями, как описано выше, с последующим их дифференцированием. Рассчитаны кинетические параметры. Этот подход позволил выявить особенности влияния капотена в зависимости от концентрации. В результате показано (табл. 3), что при концентрациях капотена 1∙10-6 – 1∙10-4 моль/л наблюдаются два участка КК подобно контрольной пробе.
При концентрациях капотена 1∙10-3 моль/л и выше КК аппроксимируют тремя функциями, что свидетельствует об изменении механизма действия. Количественные показатели: Wнач, Wmаx,τ1, τ2, а совпадают с контрольной пробой вплоть до 1∙10-4 моль/л концентрации капотена. Уменьшение начальной скорости и ускорения, увеличение τ1 и τ2 наблюдается, начиная с концентрации капотена 1∙10-3 моль/л. Максимальная скорость и ускорение остаются постоянными при всех концентрациях капотена. Представленные результаты позволяют сделать вывод о том, что капотен в присутствии катионов меди легко окисляется подобно метиллинолеату. Процесс протекает по схеме:
Инициирование:
![]() (0.2)
(0.2)
![]() (0.3)
(0.3)
Продолжение цепей:
![]() (1)
(1)
![]() (2)
(2)
Обрыв цепей:
![]() (4)
(4)
![]() (5)
(5)
Вероятно, радикалы тиола менее активны, чем радикалы метиллинолеата, поэтому они рекомбинируют и не участвуют в реакциях продолжения цепей. Они быстро выводятся из процесса, практически не влияя на кинетику.
При концентрациях капотена в 5 – 50 раз, превышающих концентрацию катализатора, его избыток начинает участвовать в реакции обрыва цепей, обеспечивая торможение процесса. Схема механизма дополняется реакцией:
![]() (6)
(6)
Одинаковые максимальные скорости окисления, ускорения в контрольной пробе и в пробах с навеской капотена свидетельствуют о том, что продукты окисления капотена не участвуют в процессе окисления.
Выводы
Предложен состав водно-липидной системы для тестирования антиоксидантов.
Для качественной оценки эффективности тестируемых антиоксидантов предложен метод внешнего стандарта.
Для количественной оценки эффективности и механизма действия антиоксидантов предложен математический метод обработки кинетических кривых.
СПИСОК ЛИТЕРАТУРЫ:
1. Аристархова С.А. Изучение ингибирующей активности токоферолов / С.А. Аристархова, Е.Б. Бурлакова, Н.Г. Храпова // Известия АН СССР. Сер. хим., 1972. – № 12. – С. 2714 – 2718.
2. Бурлакова Е.Б. Кинетические особенности токоферолов как антиоксидантов: Препринт / Е.Б. Бурлакова, С.А. Крашаков, Н.Г. Храпова – Черноголовка, 1992. – 56с.
3. Васильева Н.В. Органический синтез: Учебн. пособие / Н.В. Васильева, Т.А. Смолина, В.К. Тимофеева и др. – М.: Просвящение, 1986. – 367с.
4. Владимиров Ю.А. Перекисное окисление липидов в биологических мембранах / Ю.А. Владимиров, А.И. Арчаков – М.: Наука, 1972. – 231с.
5. Денисов Е.Т. Механизмы гомолитического распада молекул в жидкой фазе // Итоги науки и техники. Сер. «Кинетика и катализ». – 1981. – Т. 9. – С. 1.
6. Джанашия П.Х., Назаренко В.А., Николенко С.А. Современные аспекты клинического применения ингибиторов ангиотензинпрерывающего фермента. – М.: РГМУ, 1999. – 48с.
7. Кобалова Ж.Д., Котовская Ю.В. Артериальная гипертония: ключевые аспекты дифференциальной диагностики, профилактики, клиники и лечения. М.: Фортэ - АРТ, 2001 – 208с.
8. Крепс Е.М. Липиды клеточных мембран. – М.: Наука, 1981. – 339с.
9. Семенов Н.Н. Цепные реакции. – М.: Наука, 1986. – 535с.
10. Ушкалова В.Н. Содержание, антиоксидантная активность и стабильность токоферолов в пищевых липидах // Вопросы питания, 1986. – № 3. – С. 10 – 17.
11. Харитонова А.А. Кинетический анализ свойств антиоксидантов в сложных композициях с помощью модельной цепной реакции / А.А. Харитонова, З.К. Козлова, Б.Ф. Цепалов, Г.П. Гладышев // Кинетика и катализ. – 1979. – Т. 20. – № 3. – С. 593 – 599.
12. Шелушенко Н.И. Определение ингибирующей эффективности антиоксидантов на модели аскорбатзависимого перекисного окисления липидов биологических мембран / Н.И. Шелушенко, С.А. Аристархова, Л.Н. Шишкина // Исследование синтетических и природных антиоксидантов in vitro in vivo. – М.: Наука, 1992. – С. 76 – 79.
13. Yanishlieva N. Natural antioxidants in lipid oxidation / N. Yanishlieva, E. Marinova // Buld. Chem. Commun. – 2003. – V. 35. – № 2. – P. 79 – 91.



